Lurong Zhang
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Cântecul Xiudao
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Liang Zhou
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Guoqiang Liang
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Heng Xu
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Fei Wang
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Fei Huang
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Guorong Jiang
Suzhou Academy of Wumen Chinese Medicine, Suzhou Hospital of Traditional Chinese Medicine, No. 18, Yangsu Road, Suzhou, 215003 Republica Populară Chineză Jiangsu
Date asociate
Seturile de date care susțin concluziile acestui articol sunt incluse în articol și în fișierul său suplimentar.
Abstract
fundal
Descoperirile noastre recente susțin ideea că 3-deoxiglucozona (3DG), o compoziție dietetică, a fost sugerată ca un factor independent pentru dezvoltarea prediabetului. S-a sugerat că secreția peptidei de tip glucagon-1 (GLP-1) este afectată în T2DM și în condiții asociate cu hiperglicemie. Deoarece biodisponibilitatea orală scăzută a 3DG a fost indicată într-un singur studiu de administrare, în studiul de față am examinat dacă 3DG este capabil să se acumuleze în țesutul intestinal al șobolanilor după administrarea de 2 săptămâni de 3DG, iar tratamentul 3DG afectează secreția GLP-1 și toleranta la glucoza.
Metode
Șobolanii au fost administrați prin gavaj gastric timp de 2 săptămâni. Am măsurat conținutul 3DG al țesuturilor intestinale (prin HPLC), nivelurile plasmatice ale GLP-1 total (prin ELISA), insulină și glucagon (ambele prin radioimunotest) și concentrațiile de glucoză din sânge. Expresiile subunităților receptorilor dulci (TAS1R2, TAS1R3) și a moleculei sale din aval TRPM5 în duoden și țesuturile colonului șobolanilor au fost cuantificate prin WB. Am examinat secreția GLP-1 în celulele enteroendocrine STC-1 expuse la 3DG.
Rezultate
Tratamentul 3DG timp de 2 săptămâni a crescut conținutul 3DG al țesuturilor intestinale, a concentrației de glucoză din sânge și a redus concentrațiile plasmatice de GLP-1 și insulină la post și la 15 și 180 de minute după încărcarea de glucoză și toleranța la glucoză pe cale orală împreună cu concentrațiile crescute de glucagon în plasmă. Expresiile TAS1R2, TAS1R3 și TRPM5 s-au dovedit a fi reduse în timp ce tratamentul 3DG nu a afectat activitatea dipeptidil peptidazei-4 plasmatice, indicând o secreție GLP-1 afectată la șobolanii tratați cu 3DG. Această idee a fost susținută și de faptul că expunerea la 3DG scade direct secreția GLP-1 în STC-1.
Concluzie
Este prima demonstrație că 3DG a fost capabil să se acumuleze în țesutul intestinal și, prin urmare, a scăzut secreția de GLP-1 și insulină într-un mod similar. Șobolanii tratați cu 3DG au dezvoltat o reglare a glucozei afectată (IGR) cu disfuncție celulară insulară evident pancreatică. Se concluzionează în continuare că o scădere a funcției biologice a GLP-1 care rezultă din secreția scăzută de GLP-1 este mecanismul cel mai probabil pentru secreția de insulină afectată, care a promovat în cele din urmă dezvoltarea IGR. Aceste rezultate vor contribui, de asemenea, la o mai bună înțelegere a semnificației pentru restabilirea secreției fiziologice de GLP-1.
Material suplimentar electronic
Versiunea online a acestui articol (doi: 10.1186/s13098-016-0194-9) conține materiale suplimentare, care sunt disponibile utilizatorilor autorizați.
fundal
În studiul actual, 3DG a fost administrat prin gavaj gastric șobolanilor Sprague-Dawley (SD) timp de 2 săptămâni pentru a investiga distribuția 3DG în țesuturile intestinale. De asemenea, am examinat efectele administrării intragastrice de 3DG asupra nivelurilor plasmatice de GLP-1, insulină și glucagon și reglarea glucozei. Mai mult, s-au investigat expresiile subunităților receptorilor dulci (TAS1R2, TAS1R3) și ale moleculei sale aval TRPM5 în duoden și țesuturile colonului șobolanilor, care este legată de secreția GLP-1. În plus, am folosit modelul de celule L STC-1 pentru a investiga efectul direct al 3DG asupra secreției GLP-1.
Metode
Sinteza 3DG
Conform metodei lui Kato și colab. [32], 3DG a fost sintetizat din glucoză așa cum s-a descris anterior [13].
Determinarea dozelor adecvate de administrare intragastrică de 3DG
Rapoartele anterioare au estimat un aport dietetic mediu de 3DG de aproximativ 50 mg/zi pe baza conținutului de 3DG din alimentele consumate în mod obișnuit [10]. Pentru a obține efectul echivoc al unui aport potențial de 3DG de 50 mg pe zi, am calculat o doză pe baza suprafeței corporale (4,5 mg/kg pentru șobolani). Anterior, am raportat că administrarea intragastrică de 5 mg/kg 3DG timp de 2 săptămâni a crescut ușor nivelul de glucoză plasmatică în cadrul testelor orale de toleranță la glucoză la șoareci. Prin urmare, am dat 5, 20 sau 50 mg/kg 3DG prin gavaj gastric.
Animale
Șobolani SD de 11 săptămâni au fost achiziționați de la Matt Albert Technology Co. Ltd (Suzhou, China) și găzduit într-o cameră cu temperatură controlată (23 ° C) și 12 h lumină/12 h ciclu întunecat. Toate procedurile experimentale pe animale au fost efectuate în conformitate cu Ghidul pentru îngrijirea și utilizarea animalelor de laborator (ediția a opta, 2011). Studiul a fost aprobat de comitetul local de etică al Spitalului de Medicină Tradițională Chineză Suzhou. Șobolanii au avut acces gratuit la o dietă standard pentru rozători (Shuangshi Laboratory Animal Feed Science Co. Ltd, Suzhou, China) și apă. Dieta conținea apă (≤10%), proteine brute (≥20,5%), grăsimi brute (≥4%), fibre brute (≤5%), cenușă brută (≤8%) și un amestec de vitamine și micronutrienți. După 1 săptămână de aclimatizare, șobolanii au fost împărțiți în mod aleatoriu în patru grupuri cu concentrație similară de glucoză în repaus alimentar și fiecare grup a fost format din șase șobolani. Vehiculul (martor), 5 mg/kg 3DG, 20 și 50 mg/kg 3DG au fost administrate zilnic prin gavaj gastric, cu o perioadă administrată de 2 săptămâni. Greutatea corporală a fost măsurată zilnic. Șobolanii au fost postiti peste noapte înainte de experimente.
Cultura celulelor STC-1
Celulele STC-1, o linie celulară intestinală enteroendocrină, au fost obținute de la Banca de celule a Academiei de Științe din China (Shanghai, China). Celulele au fost crescute în mediul Eagle modificat al lui Dulbecco (DMEM; Gibco; Thermo Fisher Scientific, Inc., Waltham, MA, SUA) conținând 15% (v/v) ser de cal, 2,5% (v/v) ser fetal bovin; Zhejiang Tianhang Biological Technology Co., Ltd., Huzhou, China) și 25 mmol/L glucoză la 37 ° C într-o atmosferă umidificată cu 5% CO2. Celulele au fost crescute la 70-80% confluență pentru experimente.
Test de toleranță orală la glucoză (OGTT)
După post peste noapte, o probă de sânge bazală a fost colectată dintr-o venă de coadă pentru măsurarea nivelurilor de glucoză în post folosind un glucometru (ACCU-CHEK, Roche, SUA). Apoi, șobolanii au fost hrăniți cu glucoză prin gavaj gastric (2,5 g/kg). Și probe de sânge suplimentare au fost colectate din vena cozii la 0, 30, 60, 90, 120 și 180 de minute după încărcarea glucozei, iar concentrația de glucoză a fost determinată cu un glucometru. Aria sub curbele glicemice (ASC) a fost calculată pentru fiecare grup de șobolani.
Măsurătorile GLP-1, GIP, insulină și glucagon în plasmă
Probele de sânge din aorta abdominală au fost colectate la 15 și 180 de minute după încărcarea glucozei pentru măsurători ale insulinei, glucagonului, GLP-1 (total). Nivelurile plasmatice de insulină și glucagon au fost testate cu kituri radioimunologice corespunzătoare (Beijing North Institute of Biological Technology, Beijing, China). Concentrația plasmatică a GLP-1 a fost măsurată folosind kiturile ELISA (Millipore, MA, SUA). GLP-1 total include atât amida intactă [GLP-1- (7-36)) cât și GLP-1- (7-37)] și forme inactivate de GLP-1 [GLP-19-36 amida și GLP-1 9-37 degradat de DPP-4).
Măsurarea activității plasmice dipeptidil peptidazei-4 (DPP-4)
Conform metodei lui Pederson și colab. [33], activitatea plasmatică DPP-4 a fost determinată printr-un test colorimetric, utilizând H-Gly-Pro-p-nitroanilidă (Sigma, St Louis, MO, SUA) ca substrat.
Distribuția 3DG în țesuturile intestinale după tratamentul cu 3DG exogen
După 2 săptămâni de administrare intragastrică de 3DG, șobolanii au fost apoi uciși și țesuturile intestinale au fost colectate pentru măsurarea conținutului 3DG prin HPLC. Înainte de măsurare, conținutul tractului gastro-intestinal a fost complet îndepărtat.
Analiza Western blot
La șobolanii tratați cu 50 mg/kg 3DG, duodenul și țesuturile colonului au fost colectate la 2 săptămâni după administrarea intragastrică de 3DG. Metodele de cuantificare a conținutului de proteine întregi și western blot au fost descrise anterior [13]. Anticorpii împotriva TAS1R2, TAS1R3 și TRPM5 au fost obținuți de la Cell Signaling Tech (Massachusetts, SUA).
Testarea secreției GLP-1 in vitro
Celulele STC-1 au fost însămânțate în plăci cu șase godeuri la o densitate de 2 × 105 celule/godeu timp de 48 de ore; celulele au fost apoi incubate cu L-DMEM (5,6 mmol/L glucoză) conținând 10% FBS. După 3 ore, mediul a fost ulterior îndepărtat și celulele au fost incubate cu sau fără 3DG la concentrații finale de 80, 300 și 1000 ng/ml în 0,2% BSA H-DMEM (25 mmol/L) conținând 5 × 10-7 M insulină timp de 6 ore. După incubare, mediul a fost colectat și centrifugat la 12.000 × g timp de 5 minute la 4 ° C pentru a îndepărta orice celule plutitoare. Concentrația GLP-1 în supernatant a fost măsurată prin ELISA (Millipore, MA, SUA).
analize statistice
Rezultatele studiilor experimentale sunt exprimate ca medie ± SD. Semnificația statistică a diferențelor a fost analizată prin testul t Student sau analiza unică a varianței. Toate valorile p ≤0,05 au fost considerate semnificative statistic.
Rezultate
Creșterea conținutului de 3DG în țesuturile intestinale ale șobolanilor la 2 săptămâni după administrarea intragastrică de 3DG
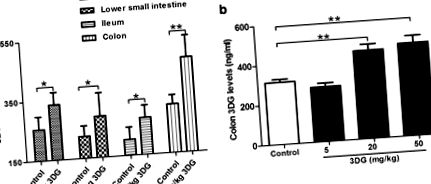
Deoarece rata de absorbție mai mică a 3DG a fost indicată într-un studiu de administrare unică [32], evaluăm în continuare dacă 3DG este capabil să se acumuleze în țesutul intestinal după administrarea orală continuă de 3DG. După administrarea intragastrică de 50 mg/kg 3DG timp de 2 săptămâni, nivelurile 3DG au fost semnificativ crescute la nivelul intestinului subțire superior (1,4 ori), intestinul subțire inferior (1,4 ori), ileon (1,4 ori) și colon (dublu) comparativ cu nivelurile bazale din grupul de control corespunzător. Colonul a avut cea mai mare creștere a nivelului de 3DG în comparație cu controlul și a avut cele mai ridicate niveluri în rândul țesutului testat (Fig. 1 a). Nivelul de colon 3DG a crescut în funcție de concentrația de 3DG administrat (Fig. 1 b). O anumită cantitate de 3DG în țesutul intestinal al șobolanilor martor poate proveni din aportul de 3DG exogen și producția de 3DG în intestin, care ar trebui examinată într-un studiu ulterior. Aceste observații sugerează că 3DG este capabil să se acumuleze în țesutul intestinal după administrarea regulată pe termen lung de 3DG dietetic.
Creșterea conținutului de 3DG în țesuturile intestinale ale șobolanilor la 2 săptămâni după administrarea intragastrică de 3DG, n = 6 pentru fiecare grup. Intestinul subțire superior, intestinul subțire inferior, ileonul (A) și colon (b) Nivelurile de 3DG au fost măsurate prin HPLC după administrarea de 2 săptămâni de 3DG sau vehicul. Valorile sunt medii ± SD. * p 2 a, vehicul vs. 20 mg/kg 3DG: 22,698 ± 1,466 pM vs. 20,572 ± 1,395 pM, * p 2 a, vehicul vs. 20 mg/kg 3DG: 34.048 ± 2.198 pM vs. 30,858 ± 1,093 pM, # p # p 2 b), ceea ce indică o scădere a secreției GLP-1 la șobolanii tratați cu 3DG. Am determinat apoi dacă 3DG afectează direct secreția GLP-1 din celulele L, celulele STC-1 enteroendocrine de șoarece au fost expuse la 3DG la concentrații similare cu cele obținute din conținutul de țesut intestinal la șobolanii tratați cu 3DG. Așa cum se arată în FIG. 2 c, secreția GLP-1 ca răspuns la tratamentul cu 300 sau 1000 ng/ml 3DG în medii de cultură obișnuite a fost semnificativ redusă. Mai mult, în condițiile testate 3DG la concentrații de 80, 300 și 1000 ng/ml nu a reușit să modifice viabilitatea celulei STC-1 (Fig. 2 d). Aceste rezultate au indicat o secreție GLP-1 afectată la șobolanii tratați cu 3DG.
Expresii reduse ale TAS1R2, TAS1R3 și TRPM5 în ambele duoden și colon de șobolani la 2 săptămâni după administrarea intragastrică de 3DG n = 6 pentru fiecare grup. După 2 săptămâni de administrare intragastrică de 50 mg/kg 3DG, duodenul și țesuturile colonului au fost proaspăt izolate de șobolani. Analiza reprezentativă western blotting a expresiilor proteinelor din duoden (A) și colon (b) țesuturi folosind anticorpi specifici împotriva TAS1R2, TAS1R3 și TRPM5
Concentrații plasmatice reduse de insulină și concentrații crescute de glucagon plasmatic la șobolani la 2 săptămâni după administrarea intragastrică de 3DG
Concluzii
Studiul nostru a demonstrat pentru prima dată că 3DG a fost capabil să se acumuleze în țesutul intestinal și să scadă secreția de GLP-1 și insulină în mod similar la șobolani după administrarea orală de 2 săptămâni de 3DG. De asemenea, am constatat că șobolanii tratați cu 3DG prezentau, în mod evident, o disfuncție celulară a insulelor pancreatice, care este una dintre caracteristicile tipice ale T2DM. Datele noastre indică posibilitatea ca o scădere a funcției biologice a GLP-1 rezultată din secreția scăzută de GLP-1 prin acumularea de țesut intestinal 3DG este cel mai principal mecanism pentru secreția de insulină afectată, care a promovat în cele din urmă dezvoltarea IGR. Aceste rezultate oferă o perspectivă asupra unei căi de acțiune potențiale care leagă consumul de ingrediente dietetice nedigestibile și dezvoltarea diabetului. De asemenea, va contribui la o mai bună înțelegere a semnificației pentru restabilirea secreției fiziologice de GLP-1 și ar putea duce la o nouă strategie pentru a preveni dezvoltarea prediabetului sau a stărilor IGR inversate.
Contribuțiile autorilor
Toți autorii au contribuit la conceptul și designul studiului și la interpretarea datelor. LZ, XS, LZ, GL, HX, FW, FH și GJ au achiziționat și analizat datele. GJ, LZ și XS au elaborat manuscrisul. GJ și LZ au revizuit manuscrisul pentru un conținut intelectual important. Toți autorii au revizuit articolul și au aprobat versiunea finală pentru publicare. GJ este responsabil pentru integritatea lucrării în ansamblu. Toți autorii au citit și au aprobat manuscrisul final.
- Acumularea de glicogen a țesutului adipos este asociată cu inflamația legată de obezitate la om -
- Restricția calorică îmbunătățește regenerarea în țesuturile intestinale
- Un studiu pilot al efectului kiwiului verde asupra fermentației intestinale umane măsurat de
- Un rol pentru lipogeneza țesutului adipos De Novo în homeostazia glucozei în timpul diabetului de creștere prin recuperare
- Rezumat P2023 Țesutul adipos perivascular ajută la relaxarea stresului arterial Pierderea asistenței în