Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
1 Corespondență: Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Gothenburg, Guldhedsgatan 10A, 41346 Gothenburg, Suedia. E-mail: [email protected]
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Departamentul de Chimie Clinică, Spitalul Universitar Sahlgrenska, Göteborg, Suedia
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
1 Corespondență: Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Gothenburg, Guldhedsgatan 10A, 41346 Gothenburg, Suedia. E-mail: [email protected]
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Departamentul de Chimie Clinică, Spitalul Universitar Sahlgrenska, Göteborg, Suedia
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Departamentul de cercetare reumatologică și inflamatorie, Universitatea din Göteborg, Suedia; și
Abstract
Raportăm că ADN-ul mitocondrial (ADNmt) este inflamator in vitro și in vivo ca urmare a prezenței secvențelor CpG nemetilate și a stării sale oxidative. MtDNA-urile umane și murine purificate au indus artrita atunci când au fost injectate intra-articular (i.a.) la șoareci. Important, oligodeoxinucleotida care conținea o singură bază deteriorată oxidativ a indus și artrita atunci când a fost injectată i.a. la șoareci. În contrast, nici ADN-ul uman, nici cel murin nu au indus inflamații. Artrita indusă de ADNm nu a fost dependentă nici de celulele B, nici de celulele T, dar a fost mediată de monocite/macrofage. mtDNA - factor nuclear indus - stimularea κB a dus la producerea factorului de necroză tumorală α, un factor puternic, artritogen. În cele din urmă, mtADN extracelular a fost detectat în fluidele sinoviale ale pacienților cu poliartrită reumatoidă, dar nu și al subiecților martor. Concluzionăm că ADNmt endogen prezintă proprietăți inflamatorii ca urmare a conținutului său de motive CpG nemetilate și a aductelor deteriorate oxidativ.
INTRODUCERE
Deoarece ADNmt este o țintă de deteriorare a radicalilor liberi ca urmare a apropierii sale de reacțiile în lanț de transfer de electroni și întrucât daunele mediate de radicalii liberi ADNmt sunt reparate cu eficiență scăzută, am investigat contribuția ADN-ului deteriorat oxidativ la artritogenitate. Într-adevăr, o oligonucleotidă care nu avea motive CpG, dar conținea un singur reziduu de 8-hidroxi-2 ′ - deoxiguanozină (8-oxodG) a fost inflamator in vivo. În schimb, o oligodeoxinucleotidă (ODN) cu exact aceeași secvență, cu excepția faptului că nu are reziduul oxidat, a fost total inertă in vivo.
MATERIALE ȘI METODE
Pregătirea probei de ADN
ADNmt a fost extras din mitocondriile musculare umane izolate și din mitocondriile musculare și hepatice murine (RMN) și esențial așa cum s-a descris anterior [6]. ADN-ul a fost extras din nucleele izolate din ficatul de șoarece RMN, în esență așa cum este descris [7]. Fragmentele de reacție în lanț ale polimerazei (PCR) - PCR - I și PCR - II ale ADN mt uman au fost obținute folosind primerii 5 ′ - TAGAAACCGTCTGAACTATC - 3 ′ (înainte) și 5 ′ - CCACAGATTTCAGAGCATT - 3 ′ (invers) pentru PCR - I și 5 ′ - CACATTACAGTCAAATCCCT - 3 ′ (înainte) și 5 ′ - TTGTATTGATGAGATTAGTA - 3 ′ (invers) pentru PCR - II. Fragmentele de ADN amplificat corespund secvențelor de la nucleotidă (nt) 7171 la nt 7611 (PCR - I; 421 bp) și nt 15761 la nt 16487 (PCR - II; 727 bp) în genomul mitocondrial uman (numărul de acces GenBank X93334; ref. [8]). Produsele PCR au fost purificate folosind trusa de curățare PCR (Boehringer Mannheim, Mannheim, Germania) și au fost reconstituite în soluție salină tamponată cu fosfat (PBS) înainte de injectarea intraarticulară (i.a.) (5 μg per articulația genunchiului) la șoareci RMN. GpC - ODN, 5 ′ - TCCATGAGCTTCCTGATGCT - 3 ′ și oxoGpC - ODN, 5 ′ - TCCATGAXCTTCCTGATGCT - 3 ′, unde X = 8 - oxodG, au fost sintetizate de SGSDNA (Stockholm, Suedia).
Injecții de ADN la șoareci
S-au injectat probe de ADNmt, nADN și ODN (20 μl vol conținând 5 μg ADN sau 10 nmol ODN) i.a. în genunchi de șoareci femele, cu vârste cuprinse între 6 și 8 săptămâni [șoareci BALB/c de la ALAB, Stockholm, Suedia; CB17 și șoareci de imunodeficiență combinată severă (SCID) de la M&B, Bomholtvej, Danemarca; Șoareci RMN de la B&K, Universal AB, Sollentuna, Suedia]. Toate animalele au fost găzduite în instalația pentru animale din cadrul Departamentului de Cercetare pentru Reumatologie și Inflamare, Universitatea din Gothenburg (Suedia), în condiții standard. Șoarecii injectați i.a. au fost uciși după 3 sau 14 zile, iar articulațiile au fost îndepărtate pentru histopatologie sau imunohistochimie.
Epuizarea in vivo a celulelor imune
Șoarecii femele RMN au fost epuizați din monocitele din sângele periferic prin tratamentul cu etopozid (Bristol Myers Squibb AB, Bromma, Suedia), care a fost injectat subcutanat (sc) la o doză de 12,5 mg/kg pe zi, începând cu 2 zile înainte de injectarea ADN și a continuat pe parcursul experimentului (3 zile). Acest tratament epuizează selectiv monocitele, așa cum s-a demonstrat anterior [9]. Șoarecii de control au primit s.c. injecții cu PBS. Șoarecii femele BALB/c (6-8 săptămâni) au fost epuizați de granulocite prin pretratare intraperitoneală (i.p.) cu 1 mg anticorp monoclonal (mAb) RB6-8C5 [10] 2 ore înainte de i.a. injecții de ADNmt. Șoarecii martori au fost pre-tratați cu un mAb anti-ovalbumină (anti-OVA) de șobolan cu imunoglobulină G (IgG).
Histopatologie și imunohistochimie a articulațiilor șoarecilor
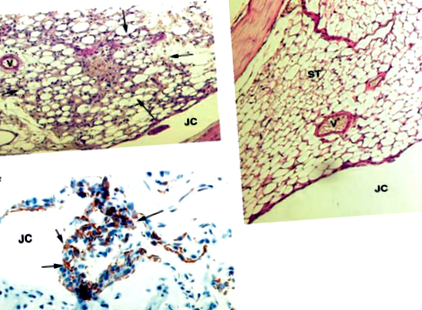
Examenele histopatologice și imunohistochimice ale articulațiilor șoarecilor au fost efectuate așa cum s-a descris anterior [4]. Severitatea artritei în secțiunile articulațiilor genunchiului a fost evaluată de un observator orbit și evaluată pe o scară de la 0 la 3, unde 0 = nu există semne de inflamație, 1 = inflamație ușoară caracterizată prin hiperplazie a stratului mucoasei sinoviale și 2-3 = creșterea nivelurilor de inflamație caracterizate prin aflux de celule inflamatorii în țesutul sinovial. În scopuri de referință, îmbinarea prezentată în Fig. 1a evaluează un scor de 2, iar cel observat în Figura 1b este marcat cu 0.
ODN antisens la factorul nuclear (NF) ‐κB
Expresia subunității p65 a NF - κB a fost blocată la șoareci femele RMN de i.p. administrare de 900 μg ODN antisens, 5 ′ - GAAACAGATCGTCCATGGT - 3 ′, sau ODN martor nepotrivit, 5 ′ - GAAACAGATCGTCTATGGT - 3 ′, cu 2 zile înainte de i.a. injectarea de ADNmt. Aceste ODN modificate cu fosforotioat au fost sintetizate de CyberGene AB (Huddinge, Suedia). Nu s-a observat nicio artrită în secțiunile histopatologice ale articulațiilor șoarecilor injectați i.p. cu antisens sau ODN nepotrivit singur la o doză de 900 μg per șoarece.
Măsurători ale factorului de necroză tumorală α (TNF - α)
Celule de splină naive, murine de la patru șoareci RMN individuali au fost incubate la o concentrație de 2 × 106 celule/ml în mediul Iscove conținând 10% ser fetal de vițel. Celulele au fost cultivate la 37 ° C în 5% CO2 în prezența de 10 μg/ml mtDNA, 10 μg/ml nDNA sau mediu singur timp de 24 de ore (test TNF-α) sau timp de 68 h (test de proliferare). Supernatanții de cultură de 24 de ore au fost testați pentru producția de TNF-a prin testul imunosorbent legat de enzime (ELISA; R&D Systems, Minneapolis, MN). Pentru a studia răspunsurile proliferative, culturile de 68 h au fost pulsate cu 3 H-timidină timp de 4 h, celulele au fost recoltate pe filtre și încorporarea 3 H-timidină a fost măsurată într-un contor β.
Analiza fluidelor sinoviale umane
REZULTATE
artrita indusă de ADNmt (MDIA)
O singură i.a. injectarea a 5 μg mtDNA în articulațiile genunchiului șoarecilor RMN a indus, în decurs de 3 zile, modificări histopatologice care s-au caracterizat prin îngroșarea membranei sinoviale și infiltrarea celulelor mononucleareFIG. 1a), o stare care a persistat cel puțin 14 zile. Inflamația a fost absentă în toate articulațiile de control care au fost injectate i.a. cu nDNA din ficatul șoarecelui (Fig. 1b) sau vehicul (PBS). Colorarea histochimică a articulațiilor MDIA a relevat prezența celulelor fagocitare mononucleare Mac1 + și Mac3 + (Fig. 1c) și absența totală a limfocitelor T CD4 + și CD8 +. Frecvența artritei observate la șoarecii cărora li s-a injectat ADNmt a fost de 70-80%. De asemenea, am ales două regiuni ale genomului mitocondrial uman cu frecvențe CpG diferite pentru amplificarea PCR: PCR-I (22 CpGs în fragmentul 421-bp) și PCR-II (22 CpGs în fragmentul 727-bp). Ambele fragmente PCR - amplificate au indus MDIA după i.a. injectare la șoareci (FIG. 2). MDIA ar putea fi reprodusă de i.a. injectarea de ADNmt în trei tulpini de șoarece diferite (RMN, CB17 și BALB/c) și la animale de vârste diferite (7 săptămâni și 9 luni) și a fost independentă de sursă, adică mușchiul șoarece/om sau țesuturile hepatice de șoarece ( datele nu sunt afișate).
Rolurile imunității înnăscute și dobândite în MDIA
Depleția granulocitelor la șoarecii RMN a condus la o scădere a frecvenței MDIA de la 91% la 55% (P= 0,055), dar nu a avut niciun efect semnificativ asupra severității MDIA (Tabelul 1). MDIA ar putea fi indusă cu frecvențe aproximativ egale în articulațiile șoarecilor SCID cu deficit de celule T și B sau a tulpinii lor de control congeneic CB17 (Tabelul 1). În total, aceste date indică faptul că răspunsurile imune înnăscute, dar nu dobândite, sunt esențiale în inducerea MDIA.
in absenta. injectarea unui ODN care conține o nucleotidă oxidată
Pentru a studia impactul daunelor oxidative asupra potențialului artritogen, am comparat inflamatogenitatea a două ODN sintetice 20-mer, unul cu o deoxiguanozină centrală (GpC - ODN) și celălalt cu un reziduu de 8 - oxodG substituit pentru această deoxiguanozină (oxoGpC - ODN ). Când a fost injectat i.a., GpC-ODN, așa cum era de așteptat, nu a declanșat inflamație la articulațiile șoarecilor, în timp ce oxoGpC-ODN a provocat artrită în 25/27 de cazuri (FIG. 5). În special, într-un număr mic de cazuri, a existat o inflamație articulară severă caracterizată prin formarea de panus și/sau distrugerea oaselor. Prin urmare, încorporarea unui singur nucleotid deteriorat oxidativ a avut un efect dramatic asupra capacității de a induce inflamația. Deoarece ADNmt conține de obicei nucleotide oxidate, reziduurile 8-oxodG din fragmentele de ADNmt eliberate sau cele excretate în timpul reparării daunelor contribuie probabil la acest tip de inflamație.
Analiza fluidelor sinoviale umane
Pentru a investiga o potențială legătură între prezența ADNmt extracelular și evenimentele inflamatorii în articulațiile inflamate ale oamenilor, am supus probe SF de la 54 de pacienți cu RA la analiza PCR pentru prezența ADNmt (extracelular) gratuit. Primerii PCR utilizați au fost concepuți pentru a amplifica un fragment de ADN 456 - bp în regiunea genomului mtDNA uman între nt 16031 și nt 16487. PCR - mtDNA amplificabil a fost detectat în 38/54 (70%) din probele SF de la pacienții cu RA și în 0/17 (0%) din probele martor.
DISCUŢIE
Reducerea în ceea ce privește frecvența și severitatea MDIA la șoarecii săraci cu granulocite a fost mai puțin pronunțată decât efectul epuizării monocitelor, ceea ce indică faptul că neutrofilele joacă un rol mai puțin proeminent în această inflamație. Celulele B și T nu par să participe la această afecțiune, pe baza constatării că MDIA ar putea fi indusă la șoareci SCID și CB17 cu aceeași frecvență și severitate. Mai mult, colorarea histochimică a secțiunilor articulațiilor de șoarece RMN imunocompetente care au fost injectate cu ADNmt au relevat o absență totală a celulelor T CD4- și CD8 - care exprimă.
Am analizat dacă ADN-ul endogen ar putea promova procesele distructive în gazdă prin inițierea autoinflamării. Recent, s-a postulat că dezvoltarea autoimunității ar putea avea loc ca răspuns la eliberarea autoantigenelor în timpul morții celulare [26]. ADNmt endogen eliberat din celulele supuse necrozei ar putea activa macrofagele pentru a produce citokine proinflamatorii și, prin urmare, să participe la procesul artritic. Studiul nostru asupra probelor SF de la pacienți sugerează că ADNmt este prezent în majoritatea articulațiilor RA și este absent din articulațiile subiecților non-artrite. Deși poate fi prematur să sugerăm că ADNmt detectat în aceste articulații participă la inflamație, există indicații puternice că componentele celulare endogene contribuie la boli inflamatorii. Sunt necesare lucrări suplimentare pentru a stabili un rol definitiv pentru ADNmt în artrita umană.
Până în prezent, s-au depus multe eforturi în identificarea ADN-ului bacterian în articulațiile umane inflamate [27, 28], iar raportul nostru recent arată în mod concludent că ADN-ul bacterian poate induce artrita la șoareci [4]. În acest studiu, am arătat clar că ADNmt este imunostimulator și, de asemenea, capabil să inducă artrită la șoareci. Se pare că prezența ADN-mt fără celule exacerbează inflamația prin stimularea producției de citokine proinflamatorii, creând astfel un cerc vicios de inflamație și distrugere celulară și accelerând eliberarea de ADN endogen, proinflamator suplimentar. În cazul particular al artritei, ar putea fi avute în vedere terapii, cum ar fi tratamente cu nuclează sau antisens, care să minimizeze sau să contracareze impactul ADNmt extracelular în articulații.
Analiza histopatologică și imunohistochimică a MDIA. (a) Histopatologia unei articulații a genunchiului unui șoarece RMN la 3 zile după i.a. injectarea a 5 μg mtDNA murin provenind din țesutul muscular. Infiltrarea celulelor mononucleare este evidentă. (b) Histopatologia unei articulații a genunchiului unui șoarece RMN la 3 zile după i.a. injectarea a 5 μg nADN. Țesuturile articulare par normale. (c) Imunohistochimia unei articulații a genunchiului care a fost tratată ca mai sus (a), prezentând expansiunea sinovială a celulelor care exprimă Mac1 (maro). JC, cavitate articulară; V, vas de sânge; ST, țesut sinovial; săgeți, celule inflamatorii în sinoviu.
Efectele i.a. injectarea de mtDNA întregi și fragmente de mtDNA asupra dezvoltării artritei la șoareci. Incidența artritei la articulațiile genunchiului la șoarecii RMN injectați i.a. cu PBS (n = 10), 5 μg ficat de șoarece nDNA (n = 13), 5 μg ficat de șoarece mtDNA (n = 43) sau 5 μg fiecare din fragmentele amplificate PCR ale genomului mitocondrial uman: PCR - I ( n = 5) sau PCR - II (n = 5). Șoarecii au fost uciși la 3 zile după injectarea ADN, iar articulațiile genunchiului au fost evaluate histopatologic pentru severitatea sinovitei. Diferențe semnificative statistic (∗∗∗, P
| Monocite | Etoposide s.c./NMRI | 25/n = 8 ∗ | 0,19 ± 0,13 ∗ |
| Control | PBS s.c./NMRI | 75/n = 8 | 0,69 ± 0,16 |
| Granulocite | mAb RB6‐8C5 i.p./BALB/c | 55/n = 11 ns | 0,73 ± 0,26 ns |
| Control | mAb anti - OVA i.p./BALB/c | 91/n = 11 | 1,09 ± 0,20 |
| Celulele T și B. | Niciuna/SCID | 100/n = 5 ns | 1,0 ± 0,0 ns |
| Control | Niciunul/CB17 | 80/n = 5 | 0,8 ± 0,20 |
- A Toți șoarecii au primit o singură i.a. injectarea a 5 μg mtADN. Șoarecii RMN au fost epuizați de monocite de s.c. injectarea de etopozid. Controalele au primit PBS. Șoarecii BALB/c au fost epuizați din granulocite cu 2 ore înainte de a primi ADNmt prin i.p. injectarea IgG mAb RB6-8C5 și șoarecii martor primiți i.p. injecții de IgG mAb anti-OVA. Șoarecii SCID cu deficit de celule T și B și controalele lor congenice CB17 nu au primit nici un pretratament. Toți șoarecii au fost sacrificați la 3 zile după primirea ADNmt, iar frecvența și severitatea artritei la nivelul articulațiilor au fost evaluate prin histopatologie. Valorile arătate pentru severitatea artritei sunt mijloacele ± sem. Semnificația statistică a fost determinată folosind testul exact al lui Fisher (frecvența artritei) sau al studenților nepereche t‐Test (severitatea artritei). ns, Nesemnificativ;
- ∗ P
Terapia antisens îndreptată împotriva NF - κB afectează severitatea MDIA. Șoarecii RMN au fost injectați i.p. cu NF - κB antisens sau ODN nepotrivit (n = 12 per grup) cu 2 zile înainte de i.a. injecție în articulația genunchiului cu mușchi ADN mtADN (5 μg). Șoarecii au fost uciși la 3 zile după injectarea ADN, iar articulațiile genunchiului au fost examinate histopatologic pentru a determina scorul severității artritei. Diferențe semnificative statistic (∗, P
Inducerea producției de TNF-α în culturi de splenocite de șoarece prin adăugarea de ADNmt. Nivelurile de TNF-α (pg/ml) au fost măsurate prin ELISA în supernatanții de cultură de 24 de ore de splenocite murine de la patru șoareci individuali, în care celulele au fost netratate (▵) sau stimulate cu 10 μg/ml mtADN (•) sau 10 μg/ml nDNA (().
Efectele i.a. injectare la șoareci de ODN care conțin sau nu au un singur reziduu de 8 - oxodG. Șoarecii RMN au fost injectați i.a. cu 10 nmol GpC-ODN nearritogen (n = 10) sau oxoGpC-ODN (n = 27). Șoarecii au fost uciși 3 zile mai târziu, articulațiile genunchiului au fost examinate histopatologic și s-a determinat incidența artritei. Diferențele de incidență a artritei între cele două grupuri au fost semnificative statistic (∗∗∗, P
MULȚUMIRI
Această lucrare a fost susținută de subvenții de la Asociația suedeză împotriva reumatismului, Rețeaua suedeză de inflamație, Fundația Nanna Svartz, Fundația King Gustaf V, Consiliul suedez de cercetare medicală și Programul de biotehnologie al Comisiei Europene (BIO4CT97-5130). Mulțumim lui Ylva Nyberg, Margareta Attström și Margareta Verdrengh pentru asistență tehnică excelentă, Mary Jo Wick pentru ajutor la șoareci și Kristina Eriksson pentru critici utile.
- Efectul argentum nitricum (AgNO3) atât în sistemele in vivo, cât și in vitro, în jurnale cu acces deschis
- Proiectare, fabricare, caracterizări in vivo și in vitro ale unui nou filet PLGA
- Funcția mitocondrială modificată prin modificări ale dietei pre-andor postpartum în ovine American Journal
- Modificări ale biomarkerilor cu risc de cancer endometrial inflamator la persoanele supuse intervenției chirurgicale
- Efectele mutării rapide față de trepte într-un mediu nou asupra mânzilor; răspunsuri la înțărcare