Abstract
fundal
Dereglarea adipogenezei provoacă boli metabolice, cum ar fi obezitatea și ficatul gras. Păsările migratoare, cum ar fi gâștele, au o toleranță ridicată la aportul masiv de energie și prezintă o dezvoltare patologică redusă. Rase de gâscă domesticite, derivate ale gâștei sălbaticeAnser anser) sau gâscă de lebădă (Anser cygnoides), au o toleranță ridicată la aportul de energie asemănător speciilor strămoșilor lor. Astfel, gâsca este potențial o specie model pentru a studia mecanismele asociate cu adipogeneza.
Rezultate
Concluzii
Cercetările noastre arată că gâsca folosește ficatul ca țesut major pentru a regla o sinteză lipidică distinctă și un flux de degradare, iar analizele din rețeaua de expresie dinamică au arătat numeroase straturi de răspunsuri pozitive atât la aportul masiv de energie, cât și la posibila dezvoltare patologică. Rezultatele noastre oferă informații despre adipogeneza gâscelor și oferă o nouă perspectivă pentru cercetarea disregulării metabolice umane.
fundal
Echilibrul stocării energiei și cheltuielilor de energie este esențial pentru depunerea normală a adiposului și metabolismul lipidelor. Țesutul adipos a fost recunoscut ca un organ endocrin major și acționează ca gazdă pentru adipogeneza la mamifere [1]. Aportul excesiv de energie are ca rezultat o creștere a volumului și a greutății adipocitelor și provoacă dereglarea metabolismului lipidelor în organism [2]. O astfel de dereglare se reflectă prin depunerea variabilă a lipidelor în diferite țesuturi adipoase și este de obicei asociată cu acumularea anormală de lipide hepatice, care poate duce la steatoză și obezitate [3]. Spre deosebire de mamifere, păsările migratoare prezintă modele distincte de depunere a lipidelor și folosesc ficatul în locul țesutului adipos ca principal organ pentru metabolismul lipidelor [4,5,6].
Rezultate
Modificări fenotipice ale ficatului și țesuturilor adipoase după hrana cu aport ridicat
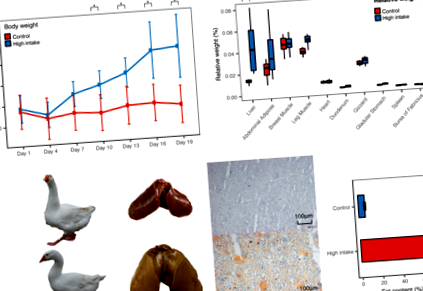
Greutatea corporală a crescut cu 32,3% până la sfârșitul procesului de îngrășare (p-valoare = 8,30 * 10 - 4, fold-change = 1,32) și grupul cu aport ridicat a fost semnificativ mai greu începând cu ziua 10 a perioadei de îngrășare (Fig. 1a, Fișa suplimentară 7). Țesuturile legate de metabolismul lipidelor au fost mai grele după îngrășare, ficatul crescând cel mai mult în greutate relativă de 3,35 ori (p-valoare = 0,0011, Fig. 1b, fișier suplimentar 8), comparativ cu adiposul abdominal crescut de 1,65 ori. Mai mult, după ce am evaluat conținutul de lipide din ficat, am constatat că acesta a crescut drastic de la 6,22 ± 0,83% la 73,56 ± 1,14% (Fig. 1c), ceea ce a contribuit în mare măsură la creșterea greutății ficatului gras. Colorarea cu ulei roșu urmată de densitatea optică integrată (IOD) a confirmat, de asemenea, depunerea substanțială de lipide în ficat (Fig. 1c, fișier suplimentar 1).
Diferențe fenotipice între gâștele hrănite cu aport normal și mare. A Modificări secvențiale în greutate. b Greutatea absolută și greutatea relativă a țesuturilor. Greutate relativă = greutate absolută/greutate corporală. c Fotografii mărite ale ficatului, colorare înghețată corespunzătoare cu ulei roșu și extracție Soxhlet a conținutului de lipide din ficat. Fotografiile cu gâștele și ficatul au fost luate din gâștele utilizate în acest studiu
Diferența transcriptomică a ficatului și a țesuturilor adipoase după hrana cu aport ridicat
Pentru a investiga modificările dinamice ale expresiei induse de hrănirea cu aport ridicat, am generat o medie de
11,50 Gb date de înaltă calitate RNA-seq. Am identificat o medie de 77,44% gene care codifică proteinele cu FPKM ≥0,1 și 1702 lncRNA putative (Majoritatea lncRNA au fost lncRNA intergenice sens (44,6%), urmate de lncRNA divergente și alte 3 categorii, fișier suplimentar 2). Acești lncRNA au prezentat caracteristici de expresie similare cu alte cercetări [13].
Au existat diferențe substanțiale între țesuturi atât în profilurile de ARNm cât și în profilurile de ARNc (varianța medie ponderată = 0,47 și, respectiv, 0,55), urmate fie de interacțiunea dintre tratament și țesut (varianța medie ponderată = 0,16 în profilurile ARNm), fie de tratament (media ponderată Variația proporțională = 0,16 în profilurile lncRNA), indicând principalul factor al diferențelor în expresie este țesutul, iar efectul tratamentului asupra modelelor de expresie a lncRNA este mai mare decât modelele de expresie a ARNm (fișier suplimentar 3).
Gruparea nesupravegheată a recapitulat, de asemenea, tiparul distinct de expresie între ficat și țesuturile adipoase (Fig. 2a). Modelele de grupare dominate de țesuturi și modelele distincte de grupare a ficatului au evidențiat diferențele copleșitoare dintre țesuturi, iar ficatul a fost mai afectat de tratament. Corelația în cadrul grupului dintre țesuturi a confirmat, de asemenea, corelația mai mică dintre adipos și ficat decât între două țesuturi adipos (Fig. 2b). Eșantionul grupului de control C2-SA a arătat o corelație mai mică cu țesuturile adipoase, în general, presupunem că această probă este parțial contaminată cu țesuturi, cum ar fi pielea.
Modificări transcriptomice pentru fiecare țesut și fiecare grup. A Matricea de corelație a lui Pearson pentru profilurile de ARNm și profilurile de ARNc. b Corelația în cadrul grupului pentru fiecare pereche de țesuturi. c Diagrama Venn a numărului de gene exprimate diferențial între gâște hrănite normal și gâște hrănite cu aport ridicat. AA - adipos abdominal, SA - adipos subcutanat. T - grup cu aport ridicat, C - grup control
Gene care codifică proteinele implicate în metabolismul dinamic al lipidelor
Am găsit peste 6000 DEG între ficat și țesuturile adipoase (atât în condiții normale de hrănire, cât și în condiții de consum ridicat), comparativ cu numai
400 DEG între cele două țesuturi adipoase. Am identificat 1930 DEG în ficat (13,97% din 13,815 gene cu FPKM> 0,1), comparativ cu 1045 (6,60% din 15,829 gene cu FPKM> 0,1) și 891 DEG (4,73% din 18,839 gene cu FPKM> 0,1) în adipoza abdominală și adipos subcutanat după hrana cu aport ridicat, respectiv (Fig. 2c). Detectarea a mai mult de două ori numărul de DEG în ficat în comparație cu adipos, și numărul mare de DEG specifice ficatului susține ipoteza că ficatul are un rol în metabolismul lipidic în timpul hrănirii cu aport ridicat.
Așa cum era de așteptat din modificările observate în fenotip, DEG-urile găsite în ficat au fost implicate semnificativ în căile metabolice, cum ar fi metabolismul aminoacizilor, metabolismul carbonului și răspunsul imun. Aceste gene au avut tendința de a fi funcționale în legarea ATP, legarea proteinelor, procesul de reducere a oxidării și gluconeogeneza (Fig. 3a). S-a observat o îmbogățire similară a DEG-urilor găsite în adipoza abdominală și în adipoza subcutanată și majoritatea căilor îmbogățite și a termenilor GO au fost legate de metabolism așa cum era de așteptat. Modificările proceselor metabolice au fost legate de reglarea în sus a expresiei în ficat la aportul excesiv de energie (fișa suplimentară 4). De asemenea, am observat că DEG-urile reglementate în jos erau mai implicate în răspunsul imun, în special căile legate de cancer (fișierul suplimentar 4). Asocierea dintre modificările expresiei și dezvoltarea patologică mică sau deloc la gâscă ar trebui investigată în continuare.
Am găsit expresia a 14 din 20 de mitocondrii de gâscă identificate anterior și a unor gene importante legate de mitocondriile nucleare [14]. Genele mitocondriale nu au prezentat un răspuns substanțial la hrănirea cu aport ridicat și majoritatea nu au prezentat modificări semnificative ale expresiei în cele 3 țesuturi examinate (fișa suplimentară 5). Analiza îmbogățirii genelor a arătat că genele nucleare legate de funcțiile mitocondriale reducerea oxidării (ajustate p-valoare = 3,96 * 10 - 4) și matricea mitocondrială (ajustată p-valoare = 8,54 * 10 - 10) au fost semnificativ reglementate în sus (fișierul suplimentar 6). Gene precum malat dehidrogenaza 2 (MDH2) a fost supra-reglată după ce hrana cu aport ridicat cu ficat a prezentat cea mai mare modificare (fold-change = 2,01, 0,92 și 0,94 la ficat, adipos abdominal și, respectiv, adipos subcutanat). Intensitatea crescută a metabolismului mitocondrial sugerează producția și consumul crescut de energie, așteptat de la schimbările fenotipice și tratament.
ARN-urile lungi necodificate sunt legate de formarea ficatului gras
Predicția funcțiilor lncRNA. A Îmbogățirea ARNm-urilor foarte corelate de diferite tipuri de ARNc. ARNc-urile au fost împărțite în 5 panouri în funcție de tipul lor și au fost desemnate cu o culoare distinctă în diagrama circulară. Diagramele sectoriale arată procentul de gene exprimate diferențial (DEG) dintre genele corelate. b Expoziție a posibilului ARNcc cu acțiune cis XLOC_292762 care se localizează la 5700 bp în aval. Scara de expresie a XLOC_292762 este diferit de FERMT2
Discuţie
Acumularea de lipide, în principal triacilglicerol (TAG), în cadrul hepatocitelor este condiția esențială pentru dezvoltarea bolii hepatice grase nealcoolice (NAFLD) la om. Acizii grași neesterificați serici (NEFA) sunt sursa cea mai dominantă pentru acumularea de lipide în ficat [3]. Sursele majore care contribuie la nivelul NEFA serice includ NEFA derivate din fluxul de acizi grași din țesuturile adipoase și din chilomicroni prin spillover de lipoproteine [18]. Fluxul de acizi grași din țesuturile adipoase folosește calea lipogenezei de novo pentru a sintetiza acizii grași din precursori cu 2 carbon din glucoză alimentară. Cercetările au arătat că pacienții cu boală hepatică grasă nealcoolică au mase crescute de țesuturi adipose viscerale și subcutanate. Strategiile actuale terapeutice pentru pacienții cu NAFLD se concentrează pe reducerea fluxului de acizi grași ai țesutului adipos [19], indicând rolul important al țesuturilor adipoase în reglarea metabolismului lipidic.
Prin investigarea tiparelor de expresie ale genelor care codifică proteinele, diferența fenotipică a fost reflectată și de tiparele la nivelul transcriptomului. Segregarea clară a profilurilor de expresie hepatică în genele care codifică proteinele și lipsa unui model dominant de expresie printre profilele adipose au arătat că a existat o diferență distinctă între ficatul de gâscă, dar nu și țesuturile adipoase, după hrănirea normală și hrana cu aport ridicat (Fig. 2a) . Coeficienții de corelație medii mai mari dintre cele două țesuturi adipoase au arătat, de asemenea, asemănarea mare dintre gâștele din cele două grupuri de hrănire (Fig. 2b). Rezultate similare au fost observate la puii care au prezentat modificări mai mari la nivelul ficatului decât țesuturile adipoase [25].
În timpul procesului de desaturare mediat de SCD, acetil-CoA cu doi carbon intră în ciclul acidului citric pentru a genera ATP. Ultimele câteva reacții ale ciclului acidului citric au loc în mitocondrii, în loc de citoplasmă, iar aceste etape sunt etapele finale pentru beta-oxidarea acizilor grași, de asemenea. Chiar dacă rezultatele noastre au arătat că genele genomului mitocondrial nu au fost exprimate diferențial, genele legate de mitocondriile nucleare au fost reglate în sus. Aceste gene includ MDH2, care codifică malatul dehidrogenază 2 localizat în mitocondrie și joacă un rol central în naveta malat-aspartat [27]. Rezultatele noastre sunt în concordanță cu cercetările anterioare care au identificat cinci gene legate de mitocondriile nucleare care au fost reglate în sus în ficatul gras de gâscă [28] și, din nou, diferențele dintre nivelurile de expresie ale acestor gene în ficat, țesutul adipos abdominal și țesutul adipos subcutanat susțineți observația noastră că ficatul a jucat rolul cheie în procesul de reglementare.
De obicei, NAFLD necontrolat se va transforma în steatohepatită nealcoolică, care este o boală mai severă cu inflamație a celulelor hepatice și leziuni celulare [29]. Steatohepatita nealcoolică este, de asemenea, un precursor al cancerului hepatic. În rezultatele noastre, am găsit o reglare interesantă a unor căi importante de cancer, cum ar fi căile de semnalizare PI3K-Akt și cGMP-PKG. Aceste căi sunt în mare parte implicate în procese precum tumorigeneză [30, 31]. Rezultatele noastre au arătat genele cheie ale acestor căi, cum ar fi PI3K și PKG au fost reglementate în jos. Deși este prea devreme pentru a concluziona semnificația reglării în jos a acestor căi, credem că rezultatele noastre oferă dovezi că gâscă dezvoltă o dezvoltare patologică redusă în ficatul gras.
Relația ortologă a 1519 gene ale obezității mamiferelor. A Relația ortologă a genelor obezității între gâscă și pui sau gâscă și om. b Proporția de DEG-uri în fiecare categorie de relații. Numerele marcate pe bară indică numărul total de familii de gene din acea categorie. Cele mai multe dintre aceste gene au avut o relație 1: 1 ortologă cu omul (74,66%) și mai multe gene au fost 1: 1 ortologice cu genele de pui (80,53%). Unele familii de gene au prezentat fie contracție (7,16 și 5,34% la om și respectiv pui), fie expansiune (1,96 și 8,08% la om și respectiv pui). Genele exprimate diferențial identificate în ficat au arătat, de asemenea, o îmbogățire puternică în rândul acestor gene de obezitate (Chi-pătrat p-valoare = 4,42 * 10 - 4). Majoritatea DEG-urilor au avut o relație ortologică 1: 1 cu omul (sau puiul) și au reprezentat 18% din toate genele obezității 1: 1 gâscă-om (sau 18,49% din genele obezității 1: 1 gâscă-pui)
Având în vedere că am găsit
80% dintre genele obezității erau ortologi 1: 1 la pui și la oameni, iar faptul că gâsca domesticită nu dezvoltă steatoză hepatică patologică la hrana cu aport ridicat, credem că înțelegerea deplină a mecanismului genetic din spatele formării ficatului gras de gâscă va ajuta la desparte efectele obezității și ale ficatului gras non-alcoolic uman.
Concluzii
În acest studiu, am constatat că gâsca folosește ficatul ca țesut major pentru a regla o sinteză lipidică distinctă și un flux de degradare. Pentru a procesa energie suplimentară, reglarea expresiei genelor este mai puternică în ficatul de gâscă decât în țesuturile adipoase. Acest lucru este diferit de profilurile de expresie la mamifere. Am demonstrat prin analiza dinamică a rețelei de expresie că există numeroase straturi de răspunsuri pozitive atât la aportul masiv de energie, cât și la posibila dezvoltare patologică. Capacitatea de a depune cantități mari de acizi grași în ficat în loc de țesuturi adipoase și reglarea ascendentă a multor gene metabolice necesită analize suplimentare pentru a releva mecanismul genetic din spate. Rezultatele noastre oferă informații despre adipogeneza gâscelor și oferă o nouă perspectivă pentru cercetarea disregulării metabolice umane.
Metode
Animalele și tratamentul lor
Colectarea probelor și ARN-seq total
Am colectat ficat, adipos abdominal, adipos subcutanat, inimă, mușchiul sânului, mușchiul picioarelor, duoden, gizzard, stomac glandular, splină și bursă de fabricius de la fiecare gâscă. Greutățile țesuturilor au fost colectate și probele de țesut au fost introduse în azot lichid imediat după ce au fost extrase din corp.
Pentru secvențierea totală a ARN-ului, am selectat aleatoriu 3 indivizi ca replici biologice atât din grupul de hrănire normal, cât și din cel cu aport ridicat. ARN total din ficat, adipos abdominal și adipos subcutanat pentru fiecare individ (în total 18 probe) au fost extrase cu ajutorul RNeasy Mini Kit (QIAGEN, Germania) urmând instrucțiunile producătorului. Integritatea ARN a fost verificată de Agilent Bioanalyzer 2100 (Agilent Technologies, CA, SUA). Eșantioanele cu valoare RIN medie = 7,59 (de la 7 la 8,6) au fost apoi trimise către Novogene (Tianjin, China) pentru a genera biblioteci cu perechi. Toate bibliotecile au fost secvențiate de Illumina Hiseq X 10 urmând protocoalele Illumina de către Novogene cu o lungime de citire de 150 bp. Controlul standard al calității și filtrarea citirilor de calitate scăzută au fost efectuate de Novogene și au fost furnizate citiri curate pentru analize ulterioare.
Aliniere și asamblare a transcriptomului
Citirile curate au fost mapate cu genomul de referință al gâscelor care include genomul mitocondrial (AnsCyg_PRJNA183603_v1.0) folosind Bowtie2 [37] și aliniatul de citire spliced, Tophat2 [38] cu argumente implicite. Tophat2 utilizează informații de îmbinare din fișierul de adnotare de referință (fișier GTF) pentru a ghida maparea citirilor RNA-seq. Fișierele BAM pentru fiecare bibliotecă au fost apoi asamblate de butoni (V2.1.1) [39] folosind –G argument, care invocă asamblarea transcrierilor pe baza adnotărilor de referință, asamblarea de novo a transcrierilor utilizând un model probabilistic și cuantifică expresia transcrierilor asamblate în același timp. Expresia relativă a fost raportată ca fragmente pe kilobază de transcrieri la un milion de citiri cartografiate (FPKM). Butonii au generat transcrieri asamblate în format de fișier GTF pentru toate persoanele și acestea au fost ulterior îmbinate de țesut folosind Cuffmerge. Pentru toate genele adnotate, coeficienții de expresie ai corelației Pearson au fost calculați în cele 18 probe. Analiza componentelor de varianță a principiului (PVCA) a fost efectuată utilizând pachetul R pvca (https://www.bioconductor.org/packages/release/bioc/html/pvca.html).
Identificarea ARN-urilor lungi necodificate
- METODA SECĂ - GREUTATE - RANK PENTRU ANALIZA BOTANICĂ A PASTURII - Mannetje - 1963 - Iarbă și
- Abordarea DIR la hrănirea pediatrică 27-28 septembrie în Greenwood Village, Colorado PCDA
- Efectul variației sezoniere în hrănirea selectivă a midiilor zebră (Dreissena polymorpha) asupra
- Mâncarea ultraprocesată este legată de obezitate și boli - De ce le hrănim copiilor noștri
- De ce mai mulți proprietari de animale de companie își hrănesc câinii ca lupii Chattanooga Times Free Press