Christabel Ndahebwa Muhonja
1 Institutul Universitar Panafrican de Știință, Tehnologie și Inovare, Nairobi, Kenya
Huxley Makonde
2 Departamentul de Științe Pure și Aplicate, Universitatea Tehnică din Mombasa, Mombasa, Kenya
Gabriel Magoma
1 Institutul Universitar Panafrican de Știință, Tehnologie și Inovare, Nairobi, Kenya
Mabel Imbuga
3 Universitatea de Agricultură și Tehnologie Jomo Kenyatta, Nairobi, Kenya
Date asociate
Toate datele relevante se găsesc în lucrare.
Abstract
Introducere
Spectroscopia în infraroșu cu transformată Fourier (FT-IR) este utilizată pentru a indica harta compușilor identificați pe suprafața eșantionului și a documenta prin colectarea spectrelor [4]. Spectrele de foi obținute din patru probe diferite de LDPE prin [15] au arătat introducerea unor noi vârfuri după perioada de biodegradare cu vârfuri de grupări carbonil (1720 cm-1), deformare CH3 (1463 cm-1) și bandă de conjugare C = C (862 cm-1). Pierderea în greutate, procentul de alungire și modificarea rezistenței la tracțiune pot fi aplicate pentru a măsura modificările fizice ale polietilenei. Produsele din degradarea polietilenei sunt, de asemenea, caracterizate folosind tehnici precum cromatografia în gaz-spectrometrie de masă (GC-MS) [4, 16].
Acest studiu a vizat izolarea și identificarea bacteriilor și ciupercilor care au capacitatea de a degrada polietilena cu densitate mică. Dovezile biodegradării s-au bazat pe pierderea în greutate, rezultatele FT-IR și GC-MS care au confirmat că microbii sunt capabili să degradeze LDPE.
Materiale și metode
Locul de studiu
Situl de gunoi Dandora se află la aproximativ 8 km distanță de orașul Nairobi și este adiacent domeniilor cu venituri mici, cu populație puternică: Dandora, Korogocho, Baba Dogo și Huruma. Găzduiește 1 \ 4 un milion de oameni și se așează pe peste 30 de acri solizi. Conține deșeuri mixte care includ deșeuri menajere de la locuințe, bunuri expirate, deșeuri agricole și deșeuri din spitale, dintre care cele mai multe sunt sau vin în purtători de polietilenă. Pungile din polietilenă au constituit 225 de tone din cele 2000 de tone de deșeuri din Nairobi într-o singură zi până în anul 2006. Punctele de prelevare au fost după cum urmează: A: S01 ° 14.633 E036 ° 54.063 Altitudine 1578m, 21,48Km SW, B: S01 ° 14.652 E036 ° 54.031 Altitudine 1589m, 21,55Km SW, C : S01 ° 14.661 E036 ° 53.977 Altitudine 1590m 21,63km SW D: S01 ° 14.688 E036 ° 53.986 Altitudine 1594m 21.65km SW și E: S01 ° 14.710 E036 ° 53.977 Altitudine 1596m 21,69km SW
Colectarea probelor și prepararea mediului pentru bacteriile degradante ale LDPE
A fost utilizat un design aleatoriu al blocului pentru a identifica punctele pentru colectarea probelor. Probele de sol au fost colectate aleatoriu din cele cinci blocuri de eșantionare selectate ale depozitului de gunoi. Probele din fiecare bloc de prelevare au fost colectate în 5 puncte diferite de 1m diametru. A rezultat 25 de probe de sol recoltate. Solul a fost prelevat aseptic din și adiacent materialelor din polietilenă îngropate la 5 cm adâncime sub stratul de așternut. Temperatura la fața locului a fost înregistrată pentru a stabili condițiile de biodegradare in situ. Probele au fost păstrate în pungi Ziploc și transportate la laboratorul Institutului de Cercetare Biotehnologică (IBR) de la JKUAT într-o cutie rece. Odată ajuns în laborator, pH-ul probelor a fost, de asemenea, măsurat și înregistrat.
Pregătirea mediilor artificiale și incubația
S-a adăugat 1 g de probă de sol la 50 ml soluție salină normală autoclavată 0,85% pentru prepararea inoculelor. Inoculul a fost menținut la 37 ° C timp de 2-3 ore într-un incubator cu agitator înainte de inoculare. S-a pregătit suport artificial 0,1% (NH4) 2 SO4, 0,1% NaNO3, 0,1% K2HPO4, 0,1% KCl, 0,02% MgSO4 și 0,001% extract de drojdie în 1000 ml apă distilată [17]. S-a adăugat pulbere LDPE cu o greutate de 2g ca sursă de carbon la fiecare 100 ml mediu de creștere. 1% din inoculurile preparate au fost transferate la 200 ml mediu sintetic pentru a pregăti cultura de creștere pentru microorganismele degradante ale LDPE. Foi de polietilenă (aproximativ 3 cm x 3 cm fiecare), cântărite, dezinfectate în etanol 70% și uscate la aer timp de 15 minute într-un cuptor au fost introduse în mediul sintetic. Baloanele de cultură pentru incubația fungică au fost mărite cu 250 mg/ml ampicilină pentru a inhiba creșterea bacteriană. Toate tratamentele au fost făcute în trei exemplare. Mediile sintetice cu LDPE fără inocul au fost utilizate ca martor negativ. Toate tratamentele au fost incubate într-un agitator de incubator la 150 rpm timp de până la 16 săptămâni.
Determinarea potențialului de degradare a LDPE al izolatelor bacteriene
Foile de LDPE au fost recuperate după diferite intervale de incubație (8 săptămâni, 12 săptămâni și 16 săptămâni). Spălarea foilor a fost făcută folosind SDS 2% pentru a îndepărta biomasa bacteriană, apoi a fost uscată peste noapte înainte de a fi cântărită. La sfârșitul perioadei de incubație, modificările structurale ale suprafeței LDPE au fost investigate folosind spectrometrul EQUINOX 55 FT-IR [4, 18, 19].
Pentru fiecare foaie LDPE, a fost luat un spectru de la 400 la 4000 de numere de undă la o rezoluție de 2 cm-1 și peste 32 de scanări. Controlul nu a fost supus niciunui proces de incubație. Mediul de incubație a fost supus analizei GC-MS. Rezultatele au fost înregistrate și analizate.
Izolarea microorganismelor care degradează LDPE
Pe baza rezultatelor de mai sus, izolarea bacteriană a fost făcută din baloane de cultură la sfârșitul perioadei de incubație. Izolarea a fost efectuată numai din acele baloane de incubație care au prezentat indicații de biodegradare pe baza modificărilor de greutate, a rezultatelor FTIR și GC-MS.
Pentru izolarea bacteriană, o buclă de cultură din mediul sintetic a fost pusă pe o placă de agar cu nutrienți, un împrăștiere a fost folosit pentru ao răspândi până la uscare. Incubația s-a făcut peste noapte la 37 ° C sau până la trei zile pentru bacterii cu creștere lentă. Culturile mixte de bacterii au fost continuu subculturate pentru a obține culturi bacteriene pure. Au fost depozitați la - 20 ° C și la -80 ° C în înclinări de 15% glicerol.
Pentru izolarea fungică, o picătură de inocul a fost pusă și răspândită până la uscare pe plăcile de Agar Dextroză de cartof (PDA) și incubată timp de cinci zile. Diversele ciuperci au fost izolate pe baza morfologiei și subcultivate continuu pentru a obține culturi fungice pure.
Identificarea izolatelor
ADN-ul genomic total pentru amplificarea 16S rADN a fost izolat din celulele bacteriene crescute peste noapte prin intermediul unui protocol standard [20]. Amplificarea capătului 5 'al genei 16D rADN a fost efectuată cu primerul universal primer primer (8-F) 5'-AGAGTTTGATYMTGGCTCAG- 3' și primerul invers (1942R) 5'- GGTTACCTTGTTACGACTT-3 '[21]. Pentru izolatele fungice, a fost utilizată metoda CTAB de extracție a ADN-ului genomic [22]. Exemplu de pereche 566-F: 5 '- CAGCAGCCGCGGTAATTCC - 3' și pentru 1200-R: 5 '- CCCGTGTTG AGTCAAATTAAGC- 3' care au amplificat în medie un fragment lung de 650 bp din regiunile V4 și V5 [23]. Similitudinea secvențelor obținute împotriva secvențelor cunoscute de 16D rADN și 18S rARN de la bacterii strâns legate și respectiv ciuperci a fost testată cu BLASTN 2.2.1 la editarea secvenței cu Chromas Pro versiunea 2.6.2.
Rezultate
Pierderea în greutate a foilor de polietilenă
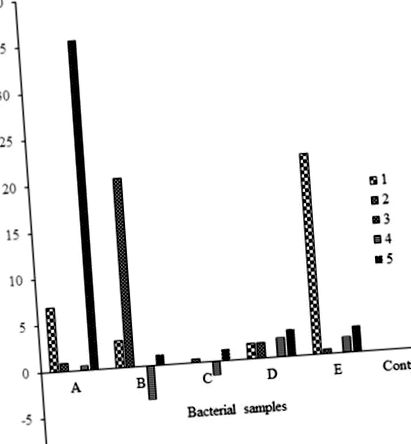
Modificările greutății medii au fost calculate și utilizate pentru a compara eficacitatea biodegradării între ciuperci și bacterii, precum și între cele două seturi de foi de polietilenă (30 și 40 microni) (Tabelele (Tabelele 1 1 și 2). 2). Pentru a obține modificarea% în greutate, formula:
a fost folosit. Analiza% de pierdere în greutate a fost făcută și reprezentată grafic pentru activitatea bacteriană pe polietilenă de 30 microni (Fig. 1), activitatea fungică pe polietilena de 30 microni (Fig. 2), activitatea fungică și bacteriană comparativă pe polietilena de 30 microni (Fig. 3). activitate pe polietilenă de 40 microni (Fig. 4), activitate fungică comparativă pe polietilenă de 30 și 40 microni (Fig. 5) și o activitate bacteriană comparativă pe polietilenă de 30 și 40 microni (Fig. 6).
Fiecare greutate medie reprezintă media a trei replici ± SE.
Fiecare greutate medie reprezintă media a trei replici ± SE.
- Cele mai bune capsule naturale Slim Xtreme Gold pentru slăbit în greutate Pastile pentru dietă 30 capsule Bacterii Health-e Living
- Bacillus Anthracis, Bacillus Cereus și alți endospori aerobi - care formează bacterii - Logan - major
- Poate bacteriile să te îngreuneze Psihologia astăzi Australia
- După o intervenție chirurgicală de slăbire, bacteriile intestinale noi țin obezitatea departe de Reuters
- O gură de germeni 7 moduri în care obțineți bacterii orale