Abstract
Boala hepatică alcoolică (ALD) este de obicei asociată cu deficiența de folat, care este rezultatul aportului redus de folat din dietă, al malabsorbției intestinale, al absorbției și depozitării hepatice reduse și al excreției urinare a folatului. Deficitul de folat favorizează progresia bolilor hepatice prin mecanisme care includ efectele sale asupra metabolismului metioninei cu consecințe pentru sinteza și stabilitatea ADN-ului și reglarea epigenetică a expresiei genice implicate în căile leziunii hepatice. Această lucrare trece în revistă patogeneza bolii hepatice alcoolice, cu accent deosebit pe modificările induse de etanol în metabolismul metioninei, care pot acționa în sinergie cu deficiența de folat pentru a reduce apărarea antioxidantă, precum și stabilitatea ADN, reglând în același timp mecanismele epigenetice ale expresiilor genetice relevante. De asemenea, examinăm dovezile actuale disponibile cu privire la tratamentele potențiale ale bolii alcoolice hepatice pe baza corectării anomaliilor în metabolismul metioninei și a reglării metilării expresiilor genetice relevante.
1. Alcoolismul cronic și bolile hepatice
2. Deficitul de folat în alcoolismul cronic: frecvență, cauze și efect potențial asupra ficatului
Incidența deficitului de folat în alcoolismul cronic
Cauzele deficitului de folat în alcoolismul cronic și ALD
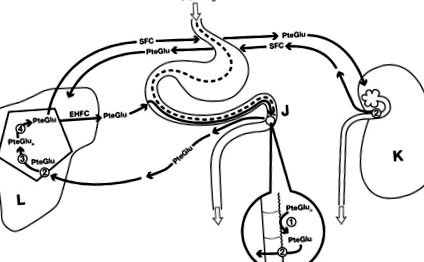
În plus față de deficiența alimentară [15], există cel puțin patru motive stabilite pentru deficitul de folat în alcoolismul cronic, care sunt enumerate și discutate mai jos. Aceste cauze sunt legate de diferitele mecanisme ale homeostaziei folatului, care sunt ilustrate în Figura 1. Acestea includ digestia folatoilor pteroylpolglutamat dietetici (PteGlun) în forma lor monoglutamat (PteGlu) prin glutamat intestinal carboxipeptidaza II (GCPII), urmată de transferul PteGlu prin vena portă în ficat unde este transportat pe membranele bazolaterale ale hepatocitelor re-poliglutamilare intracelulară și depozitare ca PteGlun. După hidroliza intrahepatică ulterioară a stocării PteGlun în PteGlu metilat, folatul intră atât într-un ciclu de folat enterohepatic (EHFC) cu reabsorbție de 99%, cât și în circulația sistemică a folatului (SFC) pentru transport către toate celulele corpului. Rinichiul este un site de reglare ulterior, unde aproximativ 90% din PteGlu metilat este re-absorbit de celulele epiteliale tubulare proximale și restul de 10% excretat în urină în fiecare zi.
Folatul dietetic este predominant sub formă de pteroylpolglutamat (PteGlun) care este apoi hidrolizat pe marginea periei jejunale (J) de o anumită gamă carboxi peptidază (1) pentru a produce pteroymonoglutamyl folate (PteGlu) care este metilat și apoi transportat pe membranele enterocitelor de către purtătorul de folat redus (2) la vena portă. Transportul ulterior prin membranele hepatocitelor din ficat (L) este facilitat de purtătorul de folat redus (2), posibil împreună cu proteina de legare a folatului sau transportorul de folat cuplat cu protoni. În ficat, PteGlu este re-poliglutamat de o folilpoliglutamatesitetază intracelulară (3) în PteGlun pentru depozitare, apoi eliberat înapoi în PteGlu printr-o gamă glutamilhidrolază separată (4) și transportat atât în circulația enterohepatică a folatului (EHFC), fie în circulația sistemică a folatului (SFC) pentru transport la toate celulele corpului. Excreția urinară este reglată în rinichi (K) prin reabsorbție de aproximativ 90% de către purtătorul redus de folat pe celulele tubulare renale (2). În timp ce mai puțin de 1% din folat excretat în scaun din EHFC, aproximativ 10% din fondul de SFC este excretat zilnic de rinichi, necesitând înlocuirea cu folat din dietă.
Reducerea absorbției folatului de către intestinul subțire
Absorbție anormală a ficatului și stocare scăzută a folatului
Creșterea excreției urinare de folat
Pierderea folatului în urină a fost documentată la subiecții alcoolici cronici [36], șobolanii hrăniți cu etanol [37] și la maimuțele hrănite cu etanol cronic [38]. Excreția urinară de folat este guvernată de reabsorbția celulelor tubulare renale atât prin FBP, cât și prin RFC pe membranele frontale ale periei de celule tubulare tubulare [39]. Cu toate acestea, expunerea la etanol pe termen lung într-un model micropig al ALD nu a avut niciun efect asupra transportului acidului folic prin membranele izolate de margine tubulare renale izolate sau asupra expresiei RFC tubulare renală [26]. Un studiu mai recent in vitro al celulelor tubulare renale proximale umane a constatat o scădere a transportului 5-MTHF ca răspuns la expunerea pe termen scurt la etanol, în timp ce expunerea la etanol subcronic la șobolani a crescut expresia FBP și RFC tubular renal [40]. Aceste studii sugerează că excreția crescută de folat de urină este cauzată de expunerea acută la etanol, cu adaptarea ulterioară la alcoolismul cronic.
Efectele expunerii acute la etanol asupra nivelurilor de folat
În plus față de aceste cauze ale deficitului de folat în alcoolismul cronic, ingestia acută de alcool pare să aibă efecte imediate asupra nivelului de folat seric și asupra absorbției folatului tisular. Într-un experiment conceput pentru a măsura efectul acut al alcoolului asupra metabolismului folatului la voluntarii umani, nivelul folicului seric a scăzut în decurs de opt ore după etanolul oral sau intravenos, revenind rapid la normal după încetarea expunerii la alcool [41]. Într-un alt experiment uman, răspunsul hematologic la suplimentarea cu acid folic a fost întrerupt în mod repetat prin ingestia de etanol la un pacient anemic cronic și cu deficit de folat [42]. Mecanismele acestor fenomene rămân inexplicabile, deși ar putea fi legate de efectele etanolului acut asupra redistribuirii folatului circulant la ciclul enterohepatic [35] sau asupra creșterii excreției folatului de urină [40]. Alții au arătat că acetaldehida, metabolitul inițial al alcoolului, provoacă distrugerea oxidativă a 5-MTHF in vitro [43].
3. Metabolizarea metioninei dependentă de vitamine în sănătate, alcoolism și ALD
Consumul de alcool afectează căile metabolice ale metioninei descrise la diferite niveluri, iar deficiența de folat poate promova boala ficatului, limitându-i efectul ca substrat al metabolismului hepatic al metioninei. De exemplu, nivelurile de transcriere ale MS, BHMT, metionină adenozil transferază (MAT1A) și CβS au fost fiecare reduse în biopsiile hepatice de la pacienții cirotici, cu rezultate similare într-un studiu separat al biopsiilor de la pacienții cu steatohepatită alcoolică [50, 51]. În ALD, nivelurile SAM sunt de obicei reduse prin scăderea activităților acestor enzime, crescând astfel activitatea MTHFR pentru a crește 5-MTHF endogen și, în consecință, pentru a garanta nivelurile SAM [45].
Alcoolicii cronici prezintă în mod obișnuit niveluri reduse de vitamina B6, care au fost atribuite deplasării vitaminei din purtătorul de proteine de către acetaldehidă cu degradarea ulterioară de către fosfataze [52]. Deoarece vitamina B6 este cofactorul pentru două enzime de transsulfurare (Figura 2), consecința directă a deficitului de vitamina B6 este calea transsulfurării afectată cu acumularea de homocisteină. Un studiu pe 81 de pacienți cu ALD cu ciroză avansată a arătat niveluri plasmatice crescute de homocisteină și cistationină comparativ cu 55 de subiecți sănătoși, care ar putea fi atribuită unui efect al nivelurilor reduse de vitamina B6 asupra enzimelor lor de reglare (Figura 2) [53]. Studiul nostru ulterior a stabilit semnificația raportului α-aminobutirat/cistationină, care poate fi considerat un marker al activității cistationazei dependente de vitamina B6. Am comparat 40 de alcoolici cu dovezi clinice de boală hepatică, cărora li s-a făcut și o biopsie hepatică, cu 26 de alcoolici fără boală hepatică și 28 de subiecți sănătoși. Raportul α-aminobutirat/cistationină corelat cu severitatea fibrozei și a fost un predictor al prezenței ALD [10], demonstrând astfel rolul central al deficitului de vitamina B6 în progresia ALD.
4. Efectele potențiale ale deficitului de folat în dezvoltarea ALD
5. Efectele deficitului de folat și alcoolismului asupra stabilității ADN în asociere cu progresia ALD și a riscului de cancer
Un studiu din modelul de micropig alimentat cu etanol al ALD a demonstrat rupturi sporite ale ADN-ului hepatocelular și apoptoză în asociere cu niveluri reduse de SAM și scăderea raportului dTMP la dUMP cu proliferare hepatocelulară crescută [61]. Studiul nostru ulterior în micropig alimentat cu etanol cu deficit de folat a asociat dezvoltarea ALD cu folat hepatic și SAM reduse, oxidare crescută a ADN-ului și rupturi de șuvițe, precum și hipometilare globală a ADN-ului, în concordanță cu efectele combinate asupra sintezei ADN și a capacității de metilare [48] . Un alt studiu a raportat niveluri scăzute de SAM la instabilitatea ADN-ului prin găsirea expresiei scăzute a MAT1A și a nivelurilor de SAM, împreună cu rupturi de catene de ADN pe scară largă în modelul de șobolan alimentat cu etanol intragastric al ALD [62].
Rezumând, metabolismul alterat al folatului și al metioninei, care este asociat cu ingestia cronică de alcool, este asociat cu o progresie crescută a ALD și cu riscul de anumite tipuri de cancer, în special cancerul de colon și HCC. Mecanismele acestei observații includ dezechilibrul și stabilitatea nucleotidelor ADN care apar datorită devierii substratului TS 5,10-MTHF către calea MTHFR, care poate fi reglată în sus din cauza deficitului de SAM care apare cu un deficit relativ de folat. Aceste mecanisme sunt în concordanță cu observarea clinică a riscului crescut de cancer la alcoolicii cu deficiență de folat și cu creșterea deteriorării ADN-ului cu rupturi de șuvițe, oxidare și apoptoză care apar în ALD experimentale în asociere cu niveluri scăzute de SAM. După cum sa discutat mai jos, SAM redus oferă un risc suplimentar de HCC prin promovarea hipometilării ADN-ului.
6. Interacțiunile folatului și alcoolului în metilarea ADN-ului și a histonelor și riscurile hipometilării ADN-ului
Reglarea epigenetică a expresiei genice implică remodelarea cromatinei fie prin adăugarea de grupări metil la ADN și/sau prin modificarea posttranslatională a resturilor de aminoacizi histonici. Modificarea reziduurilor de aminoacizi histonici prin metilare și/sau acetilare poate modifica conformația histonei pentru a permite o expresie mai mare a ADN-ului și/sau invers. În ALD, metilarea la H3K4, H3K36 și H3K79 are ca rezultat, în general, activări genetice, dar genele pot fi reduse la tăcere prin metilare la resturile de histone H3K9, H327 și H4K20 [63]. De exemplu, creșterea H3K4 a fost asociată cu activarea crescută a genelor implicate în stresul oxidativ la șobolanii hrăniți cu etanol cronic [64], în timp ce studiile hepatocitelor primare de șobolan expuse la etanol au constatat scăderea metilării H3K9 în asociere cu mai multe gene reglementate în jos și creșterea metilării H3K4 în asociere cu mai multe gene reglementate în sus [65]. Metilarea ADN-ului este reglementată de metiltransferazele specifice DNMT 1, 2, 3A și 3B [63], dintre care una sau mai multe pot fi influențate de metabolitul etanol acetaldehidă [66].
Metilarea ADN-ului și a histonelor sunt strâns legate de metabolismul hepatic al metioninei, deoarece nivelul substratului SAM este critic ca substrat pentru metiltransferazele, în timp ce produsul S-adenosilhomocisteină (SAH) este un puternic inhibitor al acelorși reacții [44]. Condițiile experimentale care conduc la niveluri scăzute de SAM, cum ar fi dietele cu deficiență de metionină și colină sau ștergerea MAT1A, sunt asociate cu hipometilarea ADN-ului și dezvoltarea cirozei cu risc crescut de carcinom hepatocelular (HCC) [62, 67, 68]. O dietă cu deficit de folat și metil a dus la hipometilarea ADN-ului în mai multe țesuturi într-un model de șobolan hrănit cu etanol, împreună cu o activitate îmbunătățită specifică ficatului de DNMT1 [69]. Un studiu ulterior din același grup a asociat o dietă cu deficit de metil cu un raport SAM și SAM/SAH scăzut, împreună cu hipometilarea globală a ADN-ului și focare hepatice pre-maligne ireversibile [70]. În timp ce expresia MAT1A și nivelurile SAM sunt scăzute la pacienții cu ALD [51], șoarecii cu deficit de MAT1A dezvoltă steatohepatită în 8 luni și HCC în 18 luni [71]. Un alt studiu a demonstrat efectul preventiv al SAM asupra dezvoltării HCC la șobolani injectați cu celule hepatice precanceroase [72].
Lucrările noastre recente au evaluat efectul hrănirii cu etanol asupra reglării epigenetice a genelor selectate într-un model de șoarece de ALD care este heterozigot pentru CβS (Figura 2). Deoarece CβS reglează transsulfurarea homocisteinei, se poate aștepta ca deficitul acesteia să ridice homocisteina [73], crescând la rândul său inhibitorul metilazei SAH prin calea inversă a SAHH (Figura 2). Deoarece expunerea la etanol reduce expresia și activitatea MS [51, 74], combinația dintre etanol și heterozigoza CβS ar putea maximiza homocisteina și în mod secundar SAH, concomitent cu reducerea producției de SAM. Rezumând rezultatele noastre, alimentarea cu etanol intragastric a șoarecilor heterozigoți CbS a accelerat histopatologia ALD, reducând în același timp raportul de metilare SAM/SAH. Colorarea imunohistochimică a constatat o scădere a abundenței reziduului de histonă H3K9, în timp ce imunoprecipitarea cromatinei cu anticorp împotriva H3K9 a arătat expresii crescute ale genelor relevante pentru steatoză și apoptoză [75].
Rezumând această secțiune, dovezile emergente leagă alterarea indusă de etanol a metabolismului hepatic al homocisteinei, în special reducerea SAM substratului metiltransferazei sau creșterea inhibitorului său SAH, la expresiile modificate ale genelor relevante pentru ALD. Inducerea hipometilării ADN-ului prin dieta deficitară de metil este legată de riscul HCC, iar alimentarea cu etanol a unui model de șoareci modificat genetic de metabolizare modificată a metioninei a dus la expresii genetice selective legate de metilarea aberantă a histonelor.
7. Efectele suplimentării grupării metil în boala hepatică alcoolică
Studii pe modele animale
Studii clinice
Rezumând această secțiune, există dovezi abundente că atât donatorii de metil SAM, cât și betaina sunt protectori în dezvoltarea ALD experimentală la modelele animale. Cu toate acestea, eficacitatea SAM ca modalitate de tratament a ALD stabilită nu a fost dovedită concludent în studiile clinice. Se pare că eficacitatea SAM necesită reținerea și metabolismul acestuia de către hepatocite intacte, care s-ar aplica în prevenirea bolilor, dar nu în prezența hepatocitelor deteriorate în prezența ALD.
Sumar si CONCLUZII
Această revizuire a descris incidența deficitului de folat în alcoolismul cronic și a documentat dovezile legăturii sale cu metabolizarea hepatică a metioninei hepatice în patogeneza ALD. Pe lângă insuficiența alimentară, mecanismele pentru deficitul de folat în alcoolismul cronic includ malabsorbția intestinală, transportul și depozitarea hepatice reduse și reabsorbția renală redusă. Câteva mecanisme pentru metabolismul modificat al metioninei ca cauză a ALD includ sinteza și stabilitatea ADN-ului defectuos și capacitatea redusă de metilare a expresiilor genelor legate de leziuni hepatice. În plus, atât stabilitatea redusă a ADN-ului, cât și hipometilarea crescută a ADN-ului sunt asociate cu un risc crescut de cancer hepatocelular. În timp ce atât donatorii de metil SAM, cât și betaina s-au dovedit a fi eficienți în prevenirea ALD și a mecanismelor sale patogenetice în modelele animale, nu s-au demonstrat dovezi privind eficacitatea lor în tratamentul ALD stabilit clinic.
Mulțumiri
Autorii sunt susținuți de subvenții din S.U.A. Institutul Național de Sănătate acordă granturi K08 DK084111 către VM și R03AA020577 către CHH
Abrevieri
| ALD | boală hepatică alcoolică |
| BHMT | betaină homocisteină metiltransferază |
| CβS | cistationina-β-sintaza |
| dTMP | deoxitimidină monfosfat |
| dump | deoxiuridină monofosfat |
| EHFC | ciclul de folat enterohepatic |
| FBP | proteine care leagă folatul |
| FPGS | folilpoliglutamat sintetaza |
| GCPII | glutamat carboxipeptidaza II |
| GSH | glutation |
| LPS | lipopolizaharidă |
| MAT1A | metionina adenozil transferaza 1A |
| DOMNIȘOARĂ | metionina sintază |
| 5,10-MTHF | tetrahidrofolat de metilen |
| 5-MTHF | tetrahidrofolat de metil |
| PCFT | transportor de folat cuplat cu protoni |
| PEMT | fosfatidiletanolamină transferază |
| PteGlu | pteroilmonoglutamat |
| PteGlun | pteroylpolglutamates |
| RFC | purtător de folat redus |
| SAH | S-adenosilhomocisteina |
| SAM | S-adenosilmetionina |
| SFC | circulația sistemică a folatului |
| TNFa | factor de necroză tumorală alfa |
| TS | timidinesinteza |
Note de subsol
Conflicte de interes
Autorii nu au niciun conflict de interese de dezvăluit.
- Boli hepatice grase un ucigaș tăcut Narayana Health
- Acizii grași favorizează afecțiunile hepatice grase prin dereglarea 3-mercaptopiruvatului
- Boala ficatului gras în creștere - Divertisment și viață - Stroudsburg, PA
- BOALA FICATULUI GRAS
- Ciocolată neagră bună pentru pacienții cu boli de ficat - The Hindu