Anna Mandinova
Centrul de Cercetare a Biologiei Cutanate, Spitalul General din Massachusetts și Școala de Medicină Harvard, Charlestown, MA 02129 SUA
Broad Institute of MIT și Harvard, Cambridge, MA 02139, SUA
Sam W. Lee
Centrul de Cercetare a Biologiei Cutanate, Spitalul General din Massachusetts și Școala de Medicină Harvard, Charlestown, MA 02129 SUA
Broad Institute of MIT și Harvard, Cambridge, MA 02139, SUA, gro.srentrap@eelws
Abstract
O mare parte din tumorile umane poartă mutații p53, care permit inițierea și progresia tumorii; în plus, este acum clar că restaurarea sau reactivarea funcției p53 de tip sălbatic determină eliminarea rapidă a tumorilor. Descoperirea și proiectarea compușilor care reactivează sau îmbunătățesc calea p53 a dus la identificarea candidaților promițătoare de droguri care au intrat acum în studii clinice pentru strategii anti-cancer. Cu toate acestea, unii dintre acești agenți par să provoace efecte toxice nedorite asupra celulelor și țesuturilor normale și, prin urmare, sunt restricționate în doza care poate fi aplicată în tumori. În această revizuire, discutăm preocupările și promisiunile acestor activatori p53 și propunem modalități de extindere și optimizare a strategiilor de screening pentru a identifica astfel de molecule.
INTRODUCERE
Proteina supresoare tumorale p53 servește ca gardian al genomului și a fost studiată intens de aproape 30 de ani (1, 2). Funcționează în principal ca factor de transcripție prin legarea la secvențe specifice de ADN și prin transactivare sau reprimare a unui grup mare de gene țintă (3-5). Aceste ținte din aval ale p53 reglează căile de oprire a ciclului celular, apoptoză și reparare a ADN-ului pentru a menține un echilibru dinamic între creșterea și arestarea celulelor ca răspuns la factori care includ deteriorarea ADN-ului, hipoxia (lipsa de oxigen) și o deficiență a factorilor de creștere sau a nutrienților (4, 6, 7).
LATIA LUMINOSĂ A P53 ÎN TERAPEUTICA CANCERULUI
Celulele sunt supuse continuu condițiilor și stimulilor care pot duce la stres genotoxic, inclusiv metabolismul oxidativ și iradierea. Astfel, capacitatea de a detecta și repara leziunile ADN care rezultă este o funcție critică a celulelor normale. Nerespectarea eficientă a deteriorării ADN-ului poate duce în cele din urmă la transformarea malignă. Inducerea unui stop al ciclului celular (un bloc tranzitor sau permanent de proliferare celulară) sau activarea căilor de moarte celulară ca răspuns la stresul genotoxic cuprinde principalele brațe ale axei supraviețuire-moarte guvernate de p53. Datorită acestor proprietăți biologice, inactivarea p53 de tip sălbatic este un pas crucial în dezvoltarea și progresia tumorii, reflectată de incidența mare a mutațiilor TP53 într-o varietate de tipuri de cancer uman.
p53 este exprimat în mod normal la niveluri scăzute, astfel încât să nu perturbe ciclul celular sau să provoace moartea prematură a celulei. Astfel de concentrații scăzute sunt realizate prin funcționarea unei bucle de feedback negativ constând din p53 de tip sălbatic și gena MDM2 și produsul acesteia. MDM2 este o țintă transcripțională p53 al cărei produs ubiquitinează p53, marcându-l astfel pentru degradarea mediată de proteozomi (15-17). Cu toate acestea, p53 este stabilizat și se acumulează la stresuri, cum ar fi deteriorarea ADN-ului sau activarea oncogenului, ducând la oprirea ciclului celular, senescență și/sau moarte celulară prin transactivarea genelor sale țintă, inclusiv a celor care codifică p21 (care promovează oprirea ciclului celular) și proteine pro-apoptotice Bax (proteină asociată cu Bcl-2), PUMA (modulator de apoptoză p53 reglat în sus) și Noxa (proteină 1 indusă de forbol-12-miristat-13-acetat) (4, 6) (Fig. 1). Deoarece țintele din aval care au fost identificate joacă un rol critic în răspunsul de suprimare a tumorii p53, aceste ținte ar trebui să fie o cale majoră pentru intervenția terapeutică în activarea p53 în celulele canceroase.
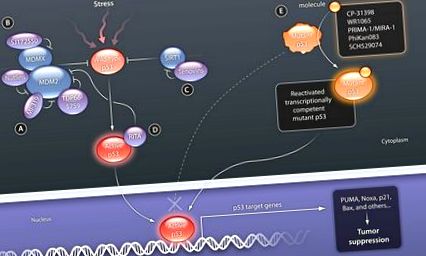
P53 de tip sălbatic este activat de o varietate de factori de stres, incluzând deteriorarea ADN-ului, expresia oncogenă, foametea nutrienților, stresul oxidativ și epuizarea ribonucleotidelor trifosfați (utilizate în sinteza ARN). (A) Moleculele mici care vizează MDM2 și blochează legarea p53 stabilizează p53. (B) SJ172550 vizează buzunarul de legare p53 al MDMX, promovând, de asemenea, stabilizarea p53. (C) Tenovin-6 inhibă activitatea proteinei deacetilază a SIRT. Acetilarea are ca rezultat stabilizarea p53 și interferează cu degradarea mediată de MDM2. (D) RITA se leagă de p53 și interferează cu interacțiunea MDM2 și p53, activând funcția p53. (E) Molecule mici concepute pentru a se lega de proteinele p53 mutante inerte transcripțional stabilizează domeniul de bază, restabilesc starea nativă și permit în cele din urmă legarea la ADN.
CREDIT: C. BICKEL/ȘTIINȚĂ MEDICAMENTĂ TRANSLAȚIONALĂ
De asemenea, s-a demonstrat că într-un procent substanțial de tumori umane, p53 este inactivat prin supraexprimarea și/sau amplificarea MDM2 (18). Mai mult, este bine stabilit că MDMX/MDM4 - un omolog non-redundant al MDM2 - reglează, de asemenea, p53 și este supraexprimat în multe tipuri de cancer (15, 19). Cu toate acestea, spre deosebire de MDM2, expresia MDMX nu este reglementată de p53 și produsul său nu are activitate intrinsecă de ubiquitin ligază; astfel, nu este o parte esențială a buclei de feedback negativ descrisă mai sus. Cu toate acestea, MDMX formează heterodimeri cu MDM2, ceea ce sporește capacitatea MDM2 de a induce degradarea p53 (16, 17). Întreruperea interacțiunilor dintre p53 și regulatorii săi negativi, cum ar fi MDM2 pentru a activa sau stabiliza p53, este o strategie terapeutică promițătoare pentru tratamentul cancerelor care păstrează p53 de tip sălbatic.
Tumorile care poartă mutații în TP53 deseori supraexprimă mutantul p53, rezultând o rezistență crescută la chimioterapie și radioterapie convenționale în comparație cu celulele care nu supraexprimă mutantul p53. Această constatare indică faptul că un astfel de mutant p53 oferă un anumit avantaj selectiv pentru dezvoltarea tumorii - un fenotip oncogen de câștig de funcție. Celulele tumorale care conțin mutantul p53 ar trebui să devină sensibile la chimioterapie după restaurarea căii p53 de tip sălbatic (Fig. 1). Acest lucru face ca p53 mutant să fie o țintă atractivă pentru terapia selectivă a cancerului care nu ar afecta celulele normale, deoarece celulele normale nu conțin p53 mutant.
LATURA INTUNECATĂ A P53 ÎN TERAPEUTICA CANCERULUI
p53 în țesutul normal
Moartea celulară indusă de leziuni ale ADN-ului prin acțiunea medicamentelor chimioterapeutice este cea mai utilizată strategie în terapia cancerului. Cu toate acestea, selectivitatea rămâne o mare preocupare, deoarece majoritatea acestor medicamente ucid atât celulele canceroase, cât și celulele normale din jur, ceea ce este o cauză importantă a efectelor secundare ale chimioterapiei cancerului care limitează sever regimurile actuale de tratament. Deși cheia pentru terapiile anti-cancer de succes este de a viza nodurile critice care sunt necesare pentru supraviețuirea celulelor canceroase, astfel de terapii nu ar trebui să fie dăunătoare celulelor normale.
Ideea de a restabili căile p53 de tip sălbatic (apoptoză și oprirea ciclului celular) prin inhibarea degradării proteozomale a p53 (de exemplu, prin inhibarea MDM2) este o strategie terapeutică promițătoare (20). Până în prezent, identificarea moleculelor mici care (i) inhibă activitatea ligazei E3 a MDM2 sau (ii) pot ocupa buzunarul hidrofob de legare a p53/fanta în MDM2 este destul de fezabilă (20, 21). Acești inhibitori ai MDM2 cauzează regresia tumorii prin moartea celulară la modelele de xenogrefă, deși nu este clar modul în care astfel de molecule ar afecta celulele și țesuturile sănătoase la om.
p53 ca gardian al celulelor canceroase
DEZVOLTAREA ACTIVATORILOR DE P53 CA MEDICAMENTE TERAPEUTICE
Provocări viitoare
Studii genetice recente la modele de șoareci [care implică trei tipuri de tumori (limfom, sarcom și carcinom hepatocelular)] au arătat că reactivarea căii p53 în tumorile cu activitate p53 inhibată este o intervenție excepțional de eficientă (30-32). Un astfel de proces de reactivare pare a fi fezabil deoarece proteina p53 este de obicei foarte exprimată în tumori, deși poate fi funcțional inertă. Cu toate acestea, din punct de vedere al descoperirii convenționale a medicamentelor, p53 este o țintă provocatoare: nu oferă accesibilitatea unei interacțiuni receptor-ligand sau a unui sit activ enzimatic. În schimb, este un factor de transcripție homotetrameric cu interacțiuni complicate proteină-proteină, făcându-l ca o țintă „nedrugerabilă”. Prin urmare, cercetătorii trebuie să depășească această provocare, precum și să identifice mijloacele de manipulare adecvată a acestei ținte în mediul său pentru a atinge eficacitatea terapeutică dorită cu toxicitate minimă. Cu toate acestea, progresele recente în descoperirea medicamentelor și progresele în dezvoltarea tehnologiei completează ultimii 30 de ani de cercetare bazată pe p53 și creează o așteptare realistă că terapiile de restaurare p53 specifice tumorii se apropie de un nivel la care ar putea fi utilizate pentru aplicații clinice.
Direcționarea căii p53 de tip sălbatic
Au fost întreprinse mai multe abordări pentru a restabili funcția p53 de tip sălbatic. Inițial, a fost exploatată terapia tumorală bazată pe expresia exogenă de tip p53 sălbatic prin terapie genetică. Terapia genică bazată pe adenovirus, care implică introducerea unei copii funcționale a TP53 în tumori prin injecție locală la locul tumorii, a ucis un procent ridicat de celule canceroase, dar a dus și la o toxicitate ridicată, parțial din cauza efectelor puternice ale spectatorilor (cum ar fi celulele vecine au fost uciși din cauza semnalelor provenite de la celulele tumorale) (33). În plus, problemele evidente ale acestei abordări sunt incapacitatea de a infecta fiecare celulă din tumoră cu virus, precum și lipsa de stabilitate a proteinei p53 funcționale nou sintetizate.
Mai recent, utilizarea moleculelor mici pentru activarea endogenă a p53, în tumorile care păstrează o genă p53 de tip sălbatic, a fost intens investigată (Fig. 1). Majoritatea acestor eforturi s-au bazat pe presupunerea că variația subtilă a nivelurilor de proteine p53 ar putea afecta pragul toleranței celulelor tumorale pentru semnale apoptotice. Prin urmare, compușii care modulează stabilitatea p53 de tip sălbatic prin inhibarea regulatorilor săi negativi ar fi de așteptat să inducă moartea celulelor canceroase în mod eficient. Cel mai cunoscut inhibitor de p53 natural este propriul său obiectiv din aval MDM2 (17, 34, 35). În ultimii ani, au fost dezvoltate mai multe strategii pentru terapia tumorală pentru a crește activitatea p53 prin neutralizarea funcției MDM2 la diferite niveluri. Vassilev și colegii (20) au identificat un grup de molecule mici care vizează interacțiunea MDM2-p53. Acești derivați de imidazolină, desemnați Nutlins, leagă în mod specific și disociază MDM2 de p53, salvând astfel p53 de degradare și inducând ciclul celular și apoptoza (20). Experimentele in vivo au arătat, de asemenea, un efect antitumoral semnificativ al Nutlins (36).
Benzodiazepenele și compușii pe bază de spiro-oxidol sunt o altă clasă de molecule mici care s-au dovedit a viza interacțiunea p53-MDM2 (37, 38). Aceste experimente au condus la dezvoltarea preclinică a TDP665759 și MI-319, care perturbă legarea MDM2 de p53 in vitro și suprimă creșterea celulelor tumorale atât in vitro, cât și in vivo. Ambii compuși limitează creșterea tumorii fără a provoca toxicitate majoră în țesutul înconjurător, deși induc niveluri scăzute de p53 prin creșterea stabilității sale în celulele normale, ceea ce nu pare a fi suficient pentru activarea cascadei apoptotice (39).
Având în vedere viteza eforturilor actuale de descoperire a medicamentelor, dezvoltarea de analogi optimizați care vizează interacțiunea p53-MDM2 va avea loc probabil în viitorul foarte apropiat. Cu toate acestea, această strategie este, de asemenea, asociată cu mai multe probleme potențiale. Deoarece MDM2 este o genă țintă clasică p53 și face parte dintr-o buclă de feedback inductibilă care inhibă calea p53, compușii care vizează MDM2 vor provoca în cele din urmă inducerea propriei ținte (adică MDM2) și astfel își vor limita propria eficacitate. În plus, utilizarea compușilor care vizează MDM2 poate fi problematică în tumorile care exprimă niveluri ridicate de p53 mutant. Având în vedere impactul pro-oncogen al mai multor mutații ale moleculei p53, eliberarea acestor mutanți din efectele degradării mediate de MDM2 poate promova efectiv tumorogeneza ulterioară (40).
Unul dintre regulatorii cheie ai căii p53 este un alt membru al familiei de proteine MDM2, MDMX. Deși MDM2 și MDMX împărtășesc omologie în domeniul lor de legare la p53, compușii asemănători Nutlin nu reușesc să afecteze eficient MDMX, care va forma un heterodimer cu MDM2 și, prin urmare, va stimula degradarea p53. Prin urmare, apare un consens general că o inducție eficientă a p53 de tip sălbatic în tumori ar putea fi realizată cu succes prin inhibarea simultană a MDM2 și MDMX. Recent, a fost publicată identificarea primului inhibitor MDMX, SJ172550 (41) și, deși mecanismul său molecular de acțiune nu este încă complet clar, datele inițiale indică un succes moderat în combinație cu inhibitorii MDM2 în modelele de cancer de șoarece.
SIRT1 și 2 sunt doi membri ai histonei deacetilaze clasa III dependentă de nicotinamidă adenină dinucleotidă (42). Este bine stabilit că acetilarea p53 la Lys 382 îmbunătățește legarea de ADN a p53. Prin urmare, deacetilarea SIRT1 a Lys 382 în proteina p53 are un efect negativ asupra activității p53, stabilind SIRT1 ca încă o posibilă țintă pentru modularea căii p53 (43). Într-adevăr, un ecran fenotipic bazat pe p53 a identificat o clasă de molecule mici numite tenovine, care sunt inhibitori puternici ai SIRT1 și 2 așa cum se arată mai târziu printr-un ecran genetic de drojdie și analize enzimatice ulterioare (44). Tenovinele au crescut rapid acumularea de p53 acetilat atât in vitro, cât și in vivo și reprezintă o clasă necunoscută anterior de agenți activatori ai p53 care poate fi dezvoltată în continuare pentru uz clinic.
Într-o altă încercare de a activa calea p53 prin stabilizarea proteinei p53 de tip sălbatic, s-a descoperit o moleculă mică denumită RITA (reactivarea p53 și inducerea apoptozei celulelor tumorale) care se leagă direct de p53 la capătul N și previne degradare (45). Dacă acesta este singurul mecanism prin care RITA crește activitatea p53 în celule este încă controversat, deoarece există dovezi că RITA se poate lega de proteine multiple și poate activa calea de răspuns la deteriorarea ADN-ului independent de p53 (46).
CREDIT: C. BICKEL/ȘTIINȚĂ MEDICAMENTĂ TRANSLAȚIONALĂ
Țintirea mutantului p53: reactivarea de către molecule mici
Progresele timpurii au demonstrat fezabilitatea acestei abordări: anticorpii care leagă capătul terminal p53 (pAb421) și o peptidă sintetică (p53C) derivată din domeniul C-terminal au arătat un efect stimulator asupra legării ADN a mai multor proteine cu mutații în zona centrală. Domeniul de legare a ADN-ului (la reziduurile His 175, Ala 143 și Ser 249), precum și inducerea apoptozei în celulele canceroase care exprimă astfel de mutanți de contact (50). Cu toate acestea, provocările asociate cu stabilitatea și transportul peptidelor sau proteinelor în celulele canceroase împiedică testarea clinică a acestei abordări. Prin urmare, în ultimii ani s-au efectuat mai multe încercări de screening pentru compuși reactivi p53 mutanți utilizând fie teste de legare a proteinelor, fie teste pe bază de celule care implică celule tumorale care conțin p53 mutante (Fig. 2). Compușii noi care vizează p53 mutant au fost identificați utilizând ambele tipuri de teste de screening (Fig. 1). CP-31398, identificat de Pfizer printr-un test de stabilizare in vitro p53, a arătat rezultate preclinice inițiale promițătoare în celulele mutante și nule p53 (51). Analiza ulterioară, însă, a relevat că mecanismul de acțiune al acestui compus nu se bazează pe legarea directă cu p53, ci este mediat de o interacțiune cu ADN (52).
Un alt compus identificat, WR1065, este metabolitul activ al amifostinei (un medicament care controlează unele efecte secundare ale radioterapiei și chimioterapiei și a fost raportat că restabilește complet sau parțial activitatea transcripțională a proteinelor mutante p53 printr-un mecanism încă necunoscut (53). În mod similar, un test de screening bazat pe celule - care implică o linie celulară Saos-2 (derivat dintr-un osteosarcom uman care a fost conceput pentru a exprima arg273 acest mutant p53 - a dat PRIMA-1 și MIRA-1 (un analog mai puternic din a doua generație), două mici molecule capabile de inducerea selectivă a apoptozei în celulele care exprimă p53 mutant. S-a demonstrat că acești compuși induc expresia genelor țintă p53 precum cele care codifică p21, MDM2 și/sau PUMA și inhibă creșterea tumorii in vivo la șoareci (54). caracterizarea acestor compuși a dezvăluit că formează aducti cu tioli în domeniul mutant al nucleului p53 (55). Cum această modificare covalentă conduce la echilibrul dintre mutant și conf de tip sălbatic Ormațiile față de conformația nativă, totuși, sunt o întrebare deschisă care necesită un răspuns clar înainte ca dezvoltarea clinică completă să fie posibilă.
O altă abordare a folosit datele structurale și a profitat de tehnicile de calcul. În acest caz, structura cristalină a unei versiuni a proteinei p53 care conținea o mutație Tyr 220 → Cys 220 a fost determinată și a constatat că include un buzunar de legare. Această descoperire a permis un screening in silico al moleculelor care interacționează și a condus la identificarea unei molecule mici, PhiKan083, care se potrivește în buzunar și stabilizează domeniul miezului mutant în conformația de tip sălbatic (56).
Foarte recent, un test de legare a ADN-ului p53 a identificat molecula mică SCH529074, care promovează activitatea de legare a ADN-ului mutantului p53 în sistemele fără celule, induce apoptoza în celulele tumorale și reduce creșterea tumorii într-un model de xenogrefă (57). Datele preclinice foarte timpurii cu acest compus sunt încurajatoare și deschid calea pentru optimizarea farmacologică a acestui compus.
Confirmare
Mulțumim Kiki Chu, Xinbin Chen și colegilor CBRC pentru lecturile critice ale manuscrisului și discuția lor utilă.
- Alimentarea cu tuburi folosind metoda Bolus Memorial Memorial Sloan Kettering Cancer Center
- De ce unele infecții cu HPV dispar și altele devin cancer - ScienceDaily
- Ce înseamnă excesul de greutate pentru riscul de cancer - Resurse pentru pierderea în greutate
- Rămâneți sănătos în timpul tratamentului cancerului CDC
- Discuție directă despre cancer; Nutriție cu Andrew Abraham, MD