Abstract
S-a demonstrat că virusul Herpes simplex 1 (HSV-1) conține catalază, o enzimă capabilă să detoxifieze peroxidul de hidrogen prin transformarea acestuia în apă și oxigen. Studiile cu un inhibitor de catalază au indicat că catalaza asociată cu virusul poate avea un rol în protejarea virusului de inactivarea oxidativă. HSV-1 s-a dovedit a fi mai sensibil la uciderea prin peroxid de hidrogen în prezența unui inhibitor de catalază decât în absența acestuia. Rezultatele sugerează un rol protector pentru catalază în timpul petrecut de HSV-1 în mediul oxidant în afara unei celule gazdă.
Virușii experimentează medii destul de diferite, în funcție de faptul că se reproduc în interiorul unei celule gazdă sau în tranzit de la o gazdă la alta. În cadrul unei celule, virusul și componentele virusului sunt expuse unui mediu de reducere, unde potențialul redox este determinat în primul rând de glutation (18). În schimb, în afara unei celule, virusul este expus la oxigen și la produse toxice derivate din oxigen, cum ar fi peroxidul de hidrogen, superoxidul și radicalul hidroxil, specii reactive care au potențialul de a inactiva virusul. Pentru a face față compușilor extrem de reactivi, plantele și animalele exprimă enzime capabile să le transforme în produse netoxice. Exemple de astfel de enzime sunt catalaza, peroxidazele și superoxidul dismutaza (28). Aici, descriem rezultatele studiilor care demonstrează prezența catalazei în interiorul virionului purificat de herpes simplex. Testele au fost apoi efectuate pentru a determina dacă catalaza internă ar putea proteja virusul de inactivare prin H2O2.
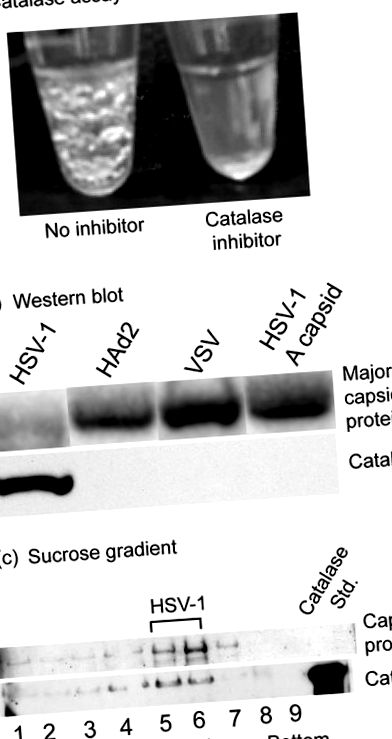
Studiile de catalază au fost efectuate cu virusul herpes simplex 1 (HSV-1) care a fost crescut pe celule Vero în cultură și purificat prin centrifugare în gradient de densitate a zaharozei. Când suspensiile de virus au fost ajustate la 1% H2O2, au început să se formeze prompt bule de oxigen, indicând prezența catalazei (Fig. 1a, tubul stâng). Bulele au devenit evidente vizual după câteva secunde de incubare la temperatura camerei și au continuat să se formeze și să se mărească timp de cel puțin 20 de minute. Nu s-au format bule, totuși, dacă inhibitorul catalazei azidă de sodiu a fost adăugat la suspensia de virus înainte de tratamentul cu H2O2 (Fig. 1a, dreapta). Testele au fost, de asemenea, negative atunci când (i) virusul a fost îndepărtat din soluție prin centrifugare înainte de adăugarea de H2O2 sau (ii) capsidele HSV-1 (capsidele B) au fost înlocuite cu virusul intact. În teste similare, bulele care indică prezența catalazei nu au fost observate cu virusul stomatitei veziculare purificate sau cu adenovirusul 2 uman (datele nu sunt prezentate). Analiza Western blot a confirmat prezența unei catalaze asociate cu virusul HSV-1, dar nu cu adenovirusul, virusul stomatitei veziculare (VSV) sau capsidele HSV-1 A (Fig. 1b).
Au fost efectuate experimente de control pentru a confirma că catalaza a fost asociată cu HSV-1 și nu cu impuritățile prezente în prepararea virusului. HSV-1 purificat a fost centrifugat într-o bandă pe un gradient de densitate zaharoză, gradientul a fost fracționat și analiza Western blot a fost utilizată pentru a testa fracțiile de gradient individuale pentru prezența catalazei. Rezultatele au arătat că catalaza a fost prezentă în fracțiile care conțin virus, dar nu și în cele flancante (Fig. 1c). Rezultatele sunt interpretate pentru a indica faptul că catalaza este asociată cu HSV-1 și nu cu contaminanți, cum ar fi bacteriile care conțin catalază sau materialele celulei gazdă în prepararea virusului. Deoarece genomul HSV-1 nu codifică catalaza (22), enzima asociată cu virusul trebuie derivată din celula gazdă. Studiile timpurii ale virusului vaccinia au demonstrat prezența catalazei în interiorul virionului matur (8). În afară de această observație, nu cunoaștem niciun alt raport al catalazei ca componentă a unei structuri de virus.
O definiție mai precisă pentru localizarea catalazei a fost obținută prin tratarea virusului purificat cu detergentul neionic Triton X-100 (TX-100). Atunci când este efectuat cu virus proaspăt, acest tratament determină pierderea membranei virusului, a glicoproteinelor membranei și a aproape tuturor celor 20 sau mai multe proteine tegumentare (toate cu excepția UL36, UL37 și US3) (13, 21, 27). Cu toate acestea, capsida își păstrează integritatea și niciuna dintre proteinele majore ale capsidei nu se pierde. Virusul ADN este reținut în interiorul capsidei. Experimentele au implicat tratamentul HSV-1 cu 1% TX-100 și izolarea capsidelor rezultate prin centrifugare în gradient de densitate a zaharozei. Analiza Western blot a fost apoi utilizată pentru a testa capsidele pentru prezența catalazei. Rezultatele au demonstrat că glicoproteinele virusului și proteinele tegumentare au fost îndepărtate așa cum era de așteptat și că și catalaza a fost îndepărtată (vezi Fig. 2a, benzile 4 și 5). Acest experiment este interpretat pentru a indica faptul că catalaza este prezentă în tegumentul HSV-1.
Informații precum cele prezentate în Fig. 2 poate fi utilizat pentru a determina numărul de molecule de catalază per virion HSV-1 (15). Această măsurare a fost efectuată începând cu două alicote identice ale virusului purificat. Cele două au fost utilizate pentru a determina (i) numărul de molecule majore de proteină capsidă (UL19) dintr-un gel colorat în albastru Coomassie și (ii) numărul de molecule de catalază 60-kDa dintr-un Western blot calibrat. Într-o determinare reprezentativă, această analiză a dat o valoare de 1: 207,5 pentru raportul molar de catalază la UL19. Deoarece există 955 molecule UL19 per capsidă HSV-1, numărul moleculelor de catalază per capsidă a fost determinat a fi 955/207,5 sau 4,6. O a doua determinare similară a dat o valoare de 7,1 molecule de catalază. Deoarece există patru subunități de 60 kDa într-o moleculă activă de catalază (11, 20), rezultatele indică prezența a 1 până la 2 tetrameri de catalază per virion.
Prezența catalazei în interiorul virionului HSV-1 sugerează posibilitatea ca aceasta să fie implicată în protejarea virusului de daunele oxidative cauzate de H2O2. Alternativ, catalaza poate fi încorporată pasiv în HSV-1 deoarece tegumentul este adăugat în citoplasma celulei gazdă și nu are nicio funcție de protecție. Pentru a face distincția între cele două posibilități, am examinat sensibilitatea HSV-1 purificat la inactivare prin H2O2 in vitro. HSV-1 a fost tratat cu H2O2 în prezența sau absența inhibitorului catalazei azidă de sodiu (NaN3), iar titrul virusului a fost determinat ulterior (în absența inhibitorului catalazei). Rezultatele au arătat că, în timp ce 50 mM H2O2 au produs o scădere modestă a titrului (de 3 până la 4 ori), a fost observat un efect letal de 10 6 ori mai mare dacă a fost prezent NaN3 (Tabelul 1). Experimentele de control au arătat o mică distrugere a HSV-1 numai de NaN3 (Tabelul 1). Rezultatele sunt interpretate pentru a indica faptul că catalaza oferă un nivel semnificativ de protecție împotriva inactivării HSV-1 de către H2O2.
tabelul 1
Titru de virus după tratamentul cu H2O2 cu sau fără un inhibitor al catalazei (NaN3) a
| Nu NaN3 | 28 × 10 10 | 60 × 10 10 | 8 × 10 10 | 28 × 10 10 | 10 × 10 10 | 8 × 10 10 |
| 2 mM NaN3 | 30 × 10 10 | 6 × 10 10 | 4 | 30 × 10 10 | 1 × 10 10 | 4 |
Nu este de așteptat ca HSV-1 să fie protejat de daune oxidative de H2O2 în timp ce este asociat cu o celulă gazdă. Așa cum s-a descris mai sus, un mediu reducător se găsește în celulă și care ar împiedica formarea de H2O2. Cu toate acestea, în afara celulei gazdă, mediul este unul oxidant, capabil să producă H2O2 atât în interiorul virusului, cât și în mediul înconjurător. HSV-1 ar întâlni acest mediu deoarece este transmis de la o gazdă la alta, iar catalaza poate fi implicată în protecția infectivității HSV-1 în timpul tranzitului. Catalaza asociată cu HSV-1 poate oferi, de asemenea, protecție împotriva H2O2 produsă de bacterii comensale sau alte surse. H2O2 produs de lactobacili, de exemplu, s-a demonstrat că protejează tractul genital feminin de boli cauzate de infecția microbiană (4). Datorită ratei catalitice ridicate, catalaza asociată virusului ar putea avea un rol în protecția HSV-1 în ciuda numărului redus de copii (1 până la 2 copii pe virion). Catalaza hepatică, de exemplu, este capabilă să detoxifice zeci de milioane de molecule de H2O2 pe secundă, printre cele mai mari rate catalitice raportate pentru orice enzimă (2).
Toți virușii din familia herpesului au un tegument, un strat de proteine care se află între capsidă și membrană (5, 6, 9, 13). Tegumentul HSV-1 are o grosime de 40 până la 50 nm și este format din aproximativ 20 de specii de proteine distincte, aproape toate fiind codificate în genomul virusului. Proteinele Tegument diferă substanțial prin abundența lor în virion cu 800 de exemplare sau mai multe dintre speciile majore, cum ar fi UL47, UL48 și UL49 (vezi Fig. 2a, banda 3) (5, 16). Multe proteine tegumentare sunt implicate în etapele timpurii ale replicării HSV-1, cum ar fi activarea transcripției genice timpurii și atenuarea sintezei proteinelor celulelor gazdă (13, 24, 25). Tegumentul este asamblat în virionul HSV-1 născut sub formă de muguri de capsidă care conțin ADN într-o veziculă a rețelei trans-Golgi (10). Se sugerează că catalaza este încorporată împreună cu alte proteine tegumentale în timpul procesului de înmugurire.
În celulele neinfectate, cea mai mare parte a catalazei se găsește sechestrată în peroxizomi (26). Pentru ca acesta să fie încorporat în descendenții HSV-1 în timpul tegumentării, așa cum este descris mai sus, catalaza ar trebui să fie eliberată din peroxizomi. Sugerăm că acest lucru poate avea loc ca o consecință a rearanjării la scară largă a membranelor citoplasmatice care însoțește replicarea HSV-1 (1).
Palamara și colab. (19) au demonstrat că o scădere a concentrației de glutation citoplasmatic are loc imediat după ce celulele Vero sunt infectate cu HSV-1. O scădere a concentrației de glutation este de așteptat să provoace o scădere a potențialului de reducere citosolică, iar această scădere pare să potențeze replicarea HSV-1. S-a constatat că glutationul suplimentar furnizat în mediul de creștere antagonizează creșterea HSV-1 (19). La fel ca glutationul adăugat extern, catalaza citosolică poate crește potențialul de reducere a citoplasmei prin eliminarea H2O2. Prin urmare, se sugerează că o consecință a încorporării catalazei în virionii descendenți poate fi potențarea creșterii virusului prin privarea celulelor infectate de catalază.
Numărul mic de molecule de catalază pe virion poate explica de ce nu a fost detectat într-o analiză spectrometrică de masă a virionilor HSV-1 întregi (7). Există mai multe proteine virion HSV-1 cu număr mare de copii care ar putea ascunde semnalul de la catalază (de exemplu, există mii de copii ale moleculelor de glicoproteină și 955 copii ale proteinei majore din capsidă [3]). Abundența catalazei nu îndeplinește standardul informal pentru detectarea prin spectrometrie de masă (vizibilitate pe un gel SDS-PAGE colorat cu Coomassie). Peroxiredoxina, o proteină peroxizomală cu activitate antioxidantă, a fost detectată în analiza spectrometrică de masă a HSV-1 (7, 26).
În viitor, ar putea fi posibilă exploatarea sensibilității HSV-1 la efectele citotoxice ale H2O2. Se așteaptă ca virusul să fie deosebit de vulnerabil atunci când se află într-un mediu oxidant în afara celulei gazdă și când catalaza este inhibată.
MULȚUMIRI
Mulțumim lui Tom Crowell, Dean Kedes, Lisa Jones și Nick Sherman pentru ajutor la interpretarea rezultatelor, Djamila Harouaka pentru un dar al virusului stomatitei veziculare și Oneida Mason pentru ajutor la proiectarea experimentală.
Această lucrare a fost susținută de premiul NIH AI041644 .
- Informații despre virusul Herpes simplex Muntele Sinai - New York
- Virusul herpes ucide nervii colonici - Revista Cosmos
- Peroxidul de hidrogen și puterea oxigenării
- Infecția cu virusul herpesului - o prezentare generală Subiecte ScienceDirect
- Dieta ketogenică protejează împotriva revistei nutriționale a infecției cu virusul gripal A