Jia Wei 1, Teresa Moran 2, Zhengyun Zou 1, Xiaoping Qian 1, Lifeng Wang 1, Carlos Camps 3, Wenjing Hu 1, Imane Chaib 2, Belén Sanchez 2, Lixia Xu 1, Niki Karachaliou 4, María Sanchez-Ronco 5, Baorui Liu 1, Rafael Rosell 2.4
Cuvinte cheie: Cancerul pulmonar cu celule mici; chimioterapie personalizată; Expresia BRCA1 și RAP80 personalizată (BREC); BRCA1; RAP80; RING proteina degetului 8 (RNF8)
Trimis la 18 ianuarie 2013. Acceptat pentru publicare la 19 februarie 2013.
Introducere
Nivelurile de ARNm RAP80 și BRCA1 în personalizarea chimioterapiei în BREC
Studiile BREC au fost construite pe baza unui studiu personalizat de fază II al grupului spaniol al cancerului pulmonar (SLGC) (NCT00883480) și a informațiilor care au fost descoperite în 2007 cu privire la complexul BRCA1-A (BRCA1, RAP80, ABRAXAS). După cum s-a comentat, informațiile care au fost raportate de atunci, în timpul acumulării BREC, oferă justificarea explorării nivelurilor de ARNm ale altor gene la pacienții cu BREC - mai presus de toate, RNF8 ar putea juca un rol decisiv, deoarece, când BRCA1 și RAP80 sunt scăzut, dacă RNF8 este încă exprimat, acest lucru va neutraliza modelul predictiv. Alte gene și asociații interesante sunt explicate mai jos.
Pauzele dublu-catenare (DSB) induse de chimioterapie duc la răspuns la deteriorarea ADN-ului (DDR): legate de ATM sau de tirozin kinază
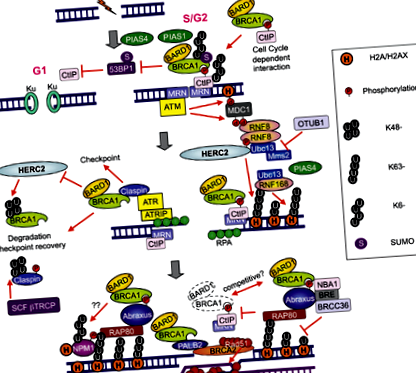
ADN-urile DSB cauzate de chimioterapie sunt reparate prin două sisteme majore: îmbinarea finală neomologă (NHEJ) și recombinarea omologă (HR). La introducerea ADN DSB, au loc următoarele procese: histona H2AX este fosforilată de ataxia telangiectazie mutată (ATM); mediatorul punctului de control al deteriorării ADN-ului 1 (MDC1) se leagă de H2AX fosforilat (H2AX); ATM fosforilează MDC1 în regiunea din jurul DSB. E3 ubiquitin ligase RING protein finger 8 (RNF8) se leagă de MDC1 fosforilat la siturile DSB și promovează recrutarea altei E3 ubiquitin ligase RNF168; RNF8 și RNF168 conjugă lanțuri de ubiquitină legate de Lys 63 pe histonă H2A cu enzima lor conjugată E2 ubiquitină conjugată UBC13 și induc remodelarea cromatinei. Ubiquitinarea dependentă de UBC13-RNF8/RNF168 promovează recrutarea proteinei de legare BRCA1 și p53 1 (53BP1) la DSB (5) (Figura 2). Important, o proporție mare de BRCA1 care se localizează pe site-urile DSB este o componentă a complexului BRCA1-A, constând dintr-un heterodimer BRCA1/BARD1, un motiv de interacțiune ubiquitin (UIM) care conține proteina RAP80 și proteina adaptor ABRAXAS (6-9).
Pe baza acestor informații, am efectuat o analiză exploratorie a nivelurilor de ARNm RAP80 și ABRAXAS în studiul anterior personalizat de faza II. Deși informațiile furnizate de ABRAXAS au fost similare cu cele furnizate de RAP80, RAP80 a fost mai semnificativă (10). Din punct de vedere mecanic, pierderea RAP80 suprimă recrutarea complexului BRCA1 către siturile de deteriorare a ADN-ului și abrogă procesul de reparare a daunelor ADN la DSB (11). De atunci s-a descoperit că complexul BRCA1-A include și enzima deubiquitinantă BRCC36, precum și BRCC45/BRE și MERIT40/NBA1 (5). Alte grupuri au demonstrat, de asemenea, că BRCA1 formează complexe biochimic distincte cu anumite alte proteine de răspuns la deteriorarea ADN-ului [complexe BRCA1-B și BRCA1-C; Figura 3 (6)] ca răspuns la DSB-uri. Prezența simultană a mai multor complexe BRCA1 distincte la DSB sugerează o diafragmă între complexe și crește nivelul de complexitate; de exemplu, complexul BRCA1/RAP80 poate atenua rezecția excesivă prin CtIP (12). Deși o mare parte din BRCA1 nu reușește să fie reținută la DSB-uri după pierderea RAP80, este posibil ca relocarea unei cantități mici de BRCA1 la DSB-uri prin asocierea cu alte complexe proteice să poată avea loc.
În plus, BRCA1 poate fi recrutat în DSB-uri prin legare directă la CtIP fosforilat, formând complexul BRCA1-C (6) [Figura 3 (6)]. Foarte important, CtIP este capabil să genereze rezecție limitată DSB fără BRCA1 pentru a promova modificarea NHEJ, o reparație predispusă la erori în faza G1 a ciclului celular [Figura 2 (5)]. Interesant este că rezecția finală DSB promovată de CtIP este inhibată de 53BP1, iar BRCA1 îl copleșește pe 53BP1 pentru a executa rezecția (13,14). În plus, 53BP1 blochează HR și susține oprirea creșterii indusă de epuizarea BRCA1. O funcție majoră a complexului BRCA1 și BRCA1-C este suprimarea 53BP1 și prelungirea activității CtIP pentru rezecția finală DSB pentru a genera lungimea ssDNA suficient de lungă pentru HR [Figura 2 (5)].
RAP80 interacționează cu lanțul legat de Lys63 generat de UBC13-RNF8/RNF168 și aduce BRCA1 pe site-urile DSB. Supraexprimarea domeniului OUT al enzimei deubiquitinante, legarea 1 a aldehidei ubiquitin (OTUB1) suprimă ubiquitinarea cromatinei dependente de deteriorarea ADN prin inhibarea activității UBC13, suprimând astfel HR (15) [Figura 2 (5)].
Una dintre dificultățile majore din studiul BREC este că celulele tumorale au mai multe sisteme de reparare a ADN, altele decât HR. Aceste sisteme funcționează redundant, fiecare funcționând pentru repararea ADN-ului în cazul în care alte sisteme de reparații sunt ineficiente. Recent, s-a demonstrat că inhibarea activității RNF8 sau RNF168 poate suprima BRCA1 independent de HR în celulele tumorale cu 53BP1 scăzut. RNF8 este necesar pentru rezistența atât la iradiere, cât și la medicamentele citotoxice (16). RNF8 poate promova asamblarea RAD51 la site-urile DSB în celulele epuizate BRCA1/53BP1 (17). Modelul arată că în celulele normale, un lanț de ubiquitină de RAP80, BRCA1, 53BP1 și RAD51 se asamblează pe site-urile DSB. În celulele epuizate cu BRCA1, RAP80 și 53BP1, dar nu RAD51, se asamblează pe site-urile DSB. În celulele epuizate cu RAP80, un mic subset de proteină BRCA1, 53BP1 și RAD51 se asamblează la siturile DSB. Cu toate acestea, în celulele epuizate RNF8/BRCA1 sau în celulele epuizate RNF8/BRCA1/53BP1, RAD51 și RAP80 nu se asamblează pe site-urile DSB (17) (Figura 4).
RNF8 afișează activități duale non-catalitice și catalitice responsabile pentru decondensarea cromatinei și, respectiv, pentru omniprezentarea histonelor. Un dimer RNF8 este recrutat într-un DSB prin legarea la MDC1 fosforilat. Dimerul RNF8 recrutat se leagă de proteina de legare a ADN-ului helicazei 4 a cromodomainului (CHD4) într-o manieră independentă de fosfo, rezultând decondensarea cromatinei locale, care permite conjugarea îmbunătățită a ubiquitinei la DSB și asocierea RNF168 și BRCA1 (18). În plus, proteina care conține valosină selectivă pentru ubiquitină (VCP) este recrutată de RNF8 și joacă un rol critic în medierea recrutării factorilor de reparare din aval. VCP stimulează recrutarea 53BP1 (18).
Funcția RNF8 ar putea fi vitală pentru chimiorezistență. Ligaza HECT de tip E3 (HERC2), o proteină mare de 4834-aminoacizi, interacționează cu domeniul FHA al RNF8 într-o manieră dependentă de fosforilare, facilitând asamblarea complexului RNF8/UBC13 (19) [Figura 2 (5)]. Prin urmare, analiza HERC2 și RNF8 ar putea avea o potențială relevanță în interpretarea rezultatelor BREC. Interesant este că HERC2 poate degrada BRCA1 (19). De asemenea, nucleofosminul (NPM1) este recrutat în DSB-uri într-o manieră dependentă de conjugatele de ubiquitină mediate de RNF8/RNF168 (20).
PIAS1 și PIAS4 sunt recrutați către DSB-uri. Epuizarea PIAS1 sau PIAS4 reduce proporția celulelor care prezintă acumularea BRCA1 și crește intensitatea colorării BRCA1 la DSB, crescând sensibilitatea la iradiere sau cisplatină (21,22). Recrutarea RNF168 este afectată numai în PIAS4-, dar nu și în celulele epuizate cu PIAS1. Recrutarea 53BP1 nu necesită BRCA1 sau PIAS1, dar necesită PIAS4 (21,22) [Figura 2 (5)]. Această constatare importantă indică importanța examinării nivelurilor BRCA1 împreună cu cele ale PIAS1, precum și 53BP1 împreună cu nivelurile PIAS4. Nivelurile ridicate de PIAS4, PP2A/C și BRCA1mRNA au fost toți markeri independenți ai SFP mai scurți la pacienții cu cancer pulmonar non-cu celule mici mutante EGFR (NSCLC) tratați cu erlotinib (23). Pe aceeași linie, nivelurile scăzute de BRCA1, PIAS1 și PIAS4 au fost markeri independenți ai supraviețuirii slabe la pacienții cu cancer gastric care au primit docetaxel ca tratament de linia a doua (24). BRCA1 s-a dovedit a fi un modulator diferențial al chimiosensibilității, inducând o creștere de 10-1000 de ori a rezistenței la mai mulți agenți care dăunează ADN-ului, în special la cei care dau naștere DSB-urilor. În schimb, BRCA1 a indus o creștere de peste 1000 de ori a sensibilității la paclitaxel, docetaxel și vinorelbină (25,26).
PPP2R2A este, de asemenea, un efector critic al HR prin modularea fosforilării ATM. Celulele epuizate cu PPP2R2A cresc dramatic sensibilitatea la inhibitorii PARP. Interesant este că mPNA PPP2R2A este de regulă reglat în NSCLC (33). Am observat anterior că la pacienții NSCLC cu mutare EGFR tratați cu erlotinib, niveluri ridicate de ARNm PP2A/C au crescut semnificativ raportul de risc pentru SFP într-un model multivariat (23).
Semnalizarea punctului de control al deteriorării ADN (DDC) la replicarea ADN-ului
Pe lângă recombinarea omologă și NHEJ, stresul genotoxic indus de chimioterapie provoacă, de asemenea, stres de replicare (38). Această cale DDC este mai puțin cunoscută. Proteinele de schelă de reparare a ADN-ului Slx4 și Rtt107 previn activarea aberantă a semnalizării DDC prin leziuni generate în timpul replicării ADN-ului. La stresul de replicare, celulele Saccharomyces cerevisiae lipsite de Slx4 și Rtt107 prezintă hiperactivare a kinazei DDC din aval Rad53. Complexul Slx4 sau Rtt107 contracarează adaptorul de punct de control Rad9 prin interacțiunea fizică cu Dpb11 și histona fosforilată H2A (39). Se presupune că modularea activării Rad53 are loc printr-un DAMP (amortizează semnalizarea fosforului mediată de adaptorul punctului de control) (39).
Recent s-a descris că RNF126 este extrem de exprimat într-un subset de linii celulare de cancer mamar și se corelează negativ cu nivelurile de expresie p21. RNF126 țintește p21 pentru degradarea mediată de ubiquitină (40).
Răspunsul la deteriorarea ADN-ului (DDR) independent de ATM
Analiza fosfoproteomică a constatat că mai multe kinaze pot fi implicate în DDR, cu o diafragmă extinsă între ele. Unul dintre cele mai importante ar putea fi c-ABL. c-ABL este o tirozin kinază fără receptor care este reglată în sus după iradiere, cisplatină și alte medicamente. c-ABL interacționează cu ATM și ADN-PK. c-ABL activat prin iradiere mediază fosforilarea PI3K și mTOR, ducând la inhibarea activității kinazei (41).
c-ABL este un traductor în procesul de apoptoză ca răspuns la deteriorarea ADN-ului. Este membru al familiei Src a tirozin kinazelor fără receptor. În condiții normale, c-ABL este inactiv și sechestrat în citoplasmă prin legarea la proteina 14-3-3. La deteriorarea ADN-ului, c-Jun N-terminal kinaza (JNK) este activată, fosforilând 14-3-3 la locul de legare la c-ABL, care eliberează c-ABL, care este localizat în nucleu și este activat prin fosforilare prin ATM. De mare interes este că YAP1 este un substrat direct al c-ABL, iar deteriorarea ADN-ului stabilizează YAP1 într-un mod dependent de kinază c-ABL. Apoi, YAP1 fosforilat se leagă de p73 și este recrutat selectiv pe promotorul Bax pentru a induce apoptoza (42). Calea de semnalizare Hippo este o cale nouă de supresie a tumorii, iar efectul din aval al cascadei de semnalizare Hippo este de a fosforila și dezactiva YAP1 și paralogul său TAZ. S-a observat supraexpresia YAP1 și TAZ în NSCLC, conferind prognostic slab (43,44). Este interesant faptul că YAP1 poate induce apoptoza (Bax) prin c-ABL.
În mod curios, consolidând rolul c-ABL, sa raportat recent că supraexprimarea AXL provoacă rezistență la cisplatină prin inhibarea semnalului c-ABL/p73 (45). Acest lucru ne permite să considerăm că, deoarece AXL este un efector al căii YAP-TAZ (când HIPPO este oprit) și poate induce abrogarea c-ABL, perturbând asocierea cu p73β (45). Cu toate acestea, lucrările anterioare au demonstrat că c-ABL îmbunătățește apoptoza prin activarea YAP1 (42). Această contradicție aparentă poate fi explicată doar prin necesitatea activării căii Wnt, deoarece beta-catenina este apoi legată de YAP1 și poate împiedica programul transcripțional al YAP, inclusiv activarea AXL. Din aceste motive, de asemenea, recent, s-a observat că YAP1 și TAZ sunt cuplate cu beta-catenină, iar degradarea YAP1 și TAZ este evitată atunci când calea Wnt este activă, care abrogă complexul de distrugere a beta-cateninei (AXIN1, GSK3, APC) (46.47). Legarea Wnts de receptorii lor inactivează acest complex, ducând la acumularea și translocarea nucleară a beta-cateninei (48). De asemenea, în mod paradoxal, în melanoamele cu BRAF V600E, eficacitatea inhibitorului BRAF PLX4720 este crescută atunci când este prezentă beta-catenina, iar acest lucru se realizează prin eliminarea AXIN1 (49).
Căi de semnalizare independente de beta-catenină
În plus față de receptorii FZD, receptorii Wnt ROR1 și ROR2 contribuie, de asemenea, la proliferarea cancerului (48). Wnt5A este ligandul pentru ROR1 (50). Represia ROR1 inhibă adenocarcinomul pulmonar indiferent de statutul EGFR. ROR1 abrogă ASK1, ceea ce poate duce la abrogarea BIM (51). În studiul EURTAC, nivelurile mai ridicate de ARNm ROR1 s-au corelat semnificativ cu supraviețuirea slabă.
Mulțumiri
Dezvăluire: Autorii declară că nu există conflicte de interese.
- Consumând mai mult iaurt, fibrele alimentare pot reduce riscul de cancer pulmonar
- Compușii dietetici galangin și myricetin suprimă angiogeneza celulelor cancerului ovarian
- Radioterapia cancerului de col uterin Tratamentul de radiație a cancerului de col uterin
- Consumul unei diete cu restricții calorice nu numai că arde grăsimile, dar poate reduce și daunele celulare, sugerează studiul
- DIETĂ, NUTRIȚIE ȘI CANCER DE PROSTATĂ Revista anuală a nutriției