1 Laborator de fiziologie și biochimie a exercițiilor, Departamentul de științe ale educației fizice și sportului la Serres, Universitatea Aristotel din Salonic, Agios Ioannis, 62110 Serres, Grecia
2 Departamentul de Medicină Sportivă și Biologia Exercițiului, Facultatea de Educație Fizică și Știința Sportului, Universitatea din Atena, 17237 Daphne, Grecia
Abstract
Răspunsurile hemodinamice la exerciții au fost studiate într-o mare măsură în ultimele decenii, iar un răspuns exagerat al tensiunii arteriale în timpul unui atac acut de exerciții fizice a fost considerat un indicator al riscului cardiovascular. Obezitatea este un factor major care influențează răspunsul tensiunii arteriale la exerciții, deoarece dovezile indică faptul că răspunsul la presiunea arterială la exercițiu este exacerbat la obezi în comparație cu adulții slabi. Semnele răspunsurilor crescute (cum ar fi un răspuns exagerat al tensiunii arteriale) la efort fizic apar la începutul vieții (din anii prepubertali) la indivizii obezi. Înțelegerea mecanismelor care determină răspunsurile hemodinamice modificate în timpul exercițiului fizic la persoanele obeze și care previn progresia la hipertensiune este de o importanță vitală. Această lucrare se concentrează pe dovezile care leagă obezitatea de alterările sistemului nervos autonom și discută despre mecanismele potențiale și consecințele comportamentului modificat al sistemului nervos simpatic la persoanele obeze în repaus și în timpul efortului. Mai mult, această lucrare prezintă modificările mecanismelor de reglare reflexă (exercițiul presor reflex și baroreflexul) la copii și adulți obezi și abordează efectele antrenamentului asupra tulburărilor legate de obezitate.
1. Introducere
Prezenta lucrare se va concentra pe dovezile care leagă obezitatea de alterările sistemului nervos autonom și vor discuta despre mecanismele potențiale și consecințele comportamentului modificat al sistemului nervos simpatic (SNS) la persoanele obeze în repaus și în timpul exercițiului. În primul rând, vor fi introduse mecanismele și reflexele care mediază răspunsurile tensiunii arteriale la exerciții. În continuare, vor fi prezentate comportamentul SNS la persoanele obeze în repaus și consecințele modificărilor comportamentului SNS la răspunsul tensiunii arteriale în timpul exercițiului. De asemenea, vor fi abordate modificări ale mecanismelor de reglare a reflexelor (cum ar fi „reflexul presor al exercițiului” și baroreflexul) la copiii și adulții obezi. În cele din urmă, vom încheia cu studii care examinează efectele antrenamentului asupra acestor tulburări legate de obezitate și recomandări de cercetare viitoare.
2. Mecanisme care mediază răspunsurile tensiunii arteriale la exerciții
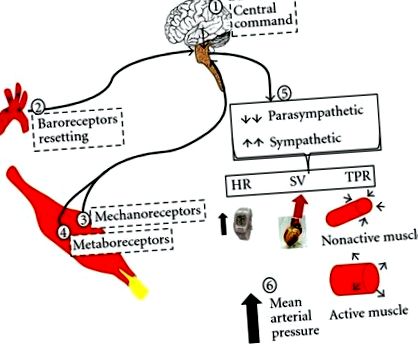
Controlul neuronal al circulației în timpul exercițiului este un fenomen multifactorial care implică centre cerebrale superioare și reflexe periferice (Figura 1). În timpul exercițiului, semnalele descendente dintr-o rețea de regiuni cerebrale superioare, de la diencefalul caudal la mezencefalul rostral, inclusiv zona tegmentală ventrală [16, 17] (denumită „comandă centrală”), duc la ajustări parasimpatice și simpatice [18] . În plus, semnalele neuronale de la aferențele periferice provenite de la baroreceptorii arteriali (denumiți „baroreflex arterial”) [19] și de la mușchiul scheletic [20, 21], duc la modificări ale fluxului autonom. Acest sistem mediază ajustările caracteristice exercițiului prin controlul ritmului cardiac, al volumului accident vascular cerebral, al rezistenței vasculare și, prin urmare, menținerea tensiunii arteriale [22, 23].
Comanda centrală a fost definită ca un mecanism „feedforward” capabil să activeze simultan două rețele separate, motor si cardiovascular centrul de Control. Comanda centrală este foarte importantă la debutul exercițiului pentru inițierea unui nivel bazal de activitate autonomă și poate fi dictată, cel puțin parțial, de percepția individului despre efort [24, 25]. Comanda centrală joacă un rol important în resetarea baroreflexului arterial în timpul exercițiului [26]. Acest efect pare a fi mediat prin retragerea vagală cuplată cu creșterea intensității exercițiului.
Pe de altă parte, mecanismele de „feedback”, constând din receptori din mușchiul care exercită, activează nervii aferenți și induc ajustări circulatorii și respiratorii pentru a asigura un flux sanguin suficient și pentru a elimina subprodusele metabolice ale mușchiului care lucrează. Acest mecanism neuronal care rezultă din receptorii mecanici și chimici din mușchi este denumit „reflexul presor de exercițiu” [18, 21, 27]. Receptorii mecanici sunt compuși în principal din aferențele grupului III care se descarcă devreme la debutul contracției (mecanoreflex), în timp ce receptorii metabolici sunt compuși în principal din aferențele grupului IV care se descarcă mai târziu (cu o latență de 5-60 secunde) cu acumularea de metaboliți.
Bradichinina, K +, acidul arahidonic, analogii ATP, fosfatul diprotonat și prostaglandinele sunt unele dintre substanțele despre care s-a raportat că activează terminațiile nervoase ale mușchilor scheletici și ale vaselor de sânge [20, 21, 28]. Acidul lactic a fost, de asemenea, considerat ca un stimul metabolic pentru grupul IV aferent muscular [29, 30]. S-a demonstrat că injectarea acidului lactic în artera musculară scheletică evocă creșteri reflexe ale presiunii arteriale care imită pe cele care apar în timpul exercițiilor statice, în timp ce injectarea lactatului de sodiu la un pH neutru nu a reușit să evoce un efect similar [31]. Cu toate acestea, demonstrația că acidul lactic provoacă un reflex presor la exerciții a fost dificilă, deoarece receptorul său pe aferenți subțiri (grupul II și IV) nu a fost identificat în mod clar. Recent, s-a sugerat un efect direct al protonilor (H +) asupra receptorului muscular [32] și s-a demonstrat că canalul ionic de detectare a acidului (ASIC) joacă un rol în evocarea componentei metabolice a reflexului presor de efort [33] ]. Consecința hemodinamică a activării mecanometaboreflexului este creșterea tensiunii arteriale medii [21].
Modificări ale mecanismelor de reglare reflexă ale presiunii arteriale și ale tulburărilor sistemului simpatic au fost raportate la persoanele obeze și au fost asociate cu prevalența crescută a hipertensiunii și a tulburărilor cardiovasculare la obezitate. Mecanismele care stau la baza răspunsurilor modificate ale tensiunii arteriale la ambii indivizi nu au fost complet identificate. Rafinările metodologice în evaluarea impulsului autonom simpatic de-a lungul anilor au permis o mai bună înțelegere a rolului sistemului nervos simpatic în dezvoltarea hipertensiunii induse de obezitate.
3. Metode de evaluare a comportamentului sistemului nervos autonom
4. Comportamentul sistemului nervos simpatic la indivizii obezi în repaus: subactivitate simpatică versus supraactivitate simpatică
Până de curând, relația dintre obezitate și comportamentul SNS a fost controversată, deoarece o serie de studii au sugerat că SNS scăzut a fost cauzal în dezvoltarea obezității [38, 39], în timp ce alții au susținut că obezitatea a fost asociată cu un comportament SNS ridicat [ 40]. Motivele acestor discrepanțe includ metode de evaluare a SNS, precum și, organul țintă examinat, deoarece activitatea SNS demonstrează specificitatea regională și, astfel, fluxul de SNS către un organ poate să nu fie similar cu fluxul de SNS care vizează alte organe.
La persoanele cu obezitate, rata de deversare a norepinefrinei din întregul corp (o indicație a unei activități simpatice generale) a fost raportată similară cu cea a persoanelor slabe [41, 42]. Cu toate acestea, studiile care evaluează activitatea SNS cardiacă prin rata de deversare a norepinefrinei cardiace au raportat o rată de revărsare mai mică (cu aproximativ 50%) la nivelul inimii la adulții obezi comparativ cu adulții nonobezi normotensivi, în timp ce activitatea SNS renală a fost raportată norepinefrina) la obezi în comparație cu omologii lor normotensivi neobezi [41, 42]. De asemenea, s-a sugerat o scădere redusă a norepinefrinei în țesutul adipos alb al persoanelor obeze [43].
Înregistrările directe ale traficului nervos simpatic al mușchilor postganglionari eferenți prin microneurografie (mușchiul MSNA) au documentat în mod concludent că indivizii obezi prezintă o creștere notabilă (cu o creștere de două ori) a MSNA comparativ cu adulții non-obezi în timpul odihnei [44]. Grăsimea viscerală, independent de grăsimea corporală totală, a fost corelată cu creșterea MSNA bazală, corelând răspunsul SNS modificat cu distribuția grăsimii corporale [45, 46]. Creșterea grăsimii viscerale și creșterea MSNA au fost, de asemenea, implicate în dezvoltarea apneei obstructive de somn la adulții obezi [47-51].
Mecanismele potențiale pentru creșterea activității SNS la indivizii obezi includ hiperinsulinemia [52, 53], hiperleptinemia [34], activarea sistemului renină-angiotensină-aldosteron [54-56] și disfuncția mitocondrială [57, 58]. Semnalele neurohumorale modificate care apar din axa suprarenală hipotalamică hipofizară, precum și creșterea adipokinelor (adiponectină, grelină) [49] și dislipidemie [59], pot fi, de asemenea, factori care contribuie la tulburările SNS observate [34, 60, 61]. Ipoteza „neurogenă” a obezității a fost revizuită anterior [42, 59, 62]. Prin urmare, în această scurtă revizuire vom discuta în continuare concluziile recente privind modificările reflexelor care controlează răspunsul la tensiunea arterială în timpul exercițiului la oamenii obezi.
5. Comportamentul sistemului nervos simpatic la persoanele obeze în timpul exercițiului
Mecanismele care stau la baza controlului metaboreflex bont la persoanele obeze nu sunt complet clare. Eventual, conținutul crescut de grăsime din mușchiul scheletic la persoanele obeze duce la o desensibilizare a metaboreceptorilor. Reducerea absorbției de glucoză a mușchilor scheletici observată la obezitate [67] poate duce, de asemenea, la un nivel atenuat de acidoză în mușchi în timpul exercițiului și, astfel, la o activare mai mică a metaboreceptorilor. O afectare baroreflexă poate fi, de asemenea, implicată în această disfuncție.
Modificările în baroreflexul arterial sunt legate de hiperactivitatea SNS și de distensibilitatea arterială tocită [68, 69]. Reducerea sensibilității baroreceptorilor postexerciți și afectarea reglării autonome au fost asociate cu o recuperare atenuată a ritmului cardiac și rezistență periferică totală după mersul rapid la femeile obeze de vârstă mijlocie [10]. Într-un studiu recent, Fardin și colab. [70] a arătat că disfuncția baroreceptorului la șobolanii obezi (expuși la o dietă bogată în grăsimi) a fost asociată cu hiperactivitate renală SNS. Rămâne de investigat dacă această descoperire se extinde la oamenii obezi.
Fluxul de sânge conservat (evaluat de Doppler) în timpul exercițiului dinamic al brațului (20 contracții/min la 4, 8 și 12 kg) și la picior (40 lovituri/min la 7 și 14 W) a fost găsit la nivelul membrului de exercițiu la obezi adulți tineri sănătoși, indicând faptul că nivelurile de echilibru ale fluxului pot fi menținute prin intermediul mecanismelor compensatorii [71]. Cu toate acestea, într-un alt studiu [72], o afectare marcată a vasodilatației rapide a fost evidentă în perioada imediată de exercițiu la adulții obezi și a fost mai mare odată cu creșterea volumului de muncă (de la 20-50% din MVC). Diferențele în rezultatele raportate cu privire la fluxul de sânge în timpul exercițiului fizic la indivizii obezi ar putea fi atribuite intensității exercițiului aplicat (sarcină de lucru similară comparativ cu sarcina relativă similară) [72], modul de exercițiu (dinamic versus izometric) și profilul hormonal și metabolic participanții (sănătoși versus hiperinsulinemici). Mecanismul exact pentru vasodilatația post-exercițiu redusă și scăderea întârziată a tensiunii arteriale la oamenii obezi nu este clar. Cu toate acestea, vasodilatația mediată de canalul de potasiu afectată a fost raportată la mușchiul scheletic al șobolanilor sau hamsterilor obezi Zucker [73, 74] și ar putea fi parțial implicată la om.
În multe studii care au examinat efectul pierderii în greutate asupra reflexelor implicate în controlul tensiunii arteriale și implicarea antrenamentului la exerciții fizice, a fost dificil să se izoleze efectul activității fizice, independent de modificările masei corporale ca urmare a intervenției. În plus, diferențele în definiția supraponderalității/obezității între studii, în special la populația pediatrică (pe baza indicelui de masă corporală ≥ 30 kg/m2 față de indicele de masă corporală> percentila 95 pentru vârstă și sex) [105], precum și diferențele în evaluarea copilăriei sau adolescenței (pe baza vârstei versus starea de maturare folosind stadiul Tanner sau vârsta la viteza maximă a înălțimii - adică, timpul de creștere maximă a staturii în timpul adolescenței) au creat controverse între studii.
8. Rezumat general și recomandări pentru cercetări viitoare
Conflict de interese
Autorii nu susțin niciun conflict de interese în lucrarea trimisă.
Referințe
- Inițierea alopurinolului și modificarea tensiunii arteriale la adulții mai în vârstă cu hipertensiune arterială
- Ritmicitatea tensiunii arteriale și grăsimea viscerală la copiii cu hipertensiune arterială
- Asociația aportului de magneziu cu tensiune arterială crescută la adulții coreeni Coreea de sănătate națională și
- O simplă modificare dietetică poate ajuta la reducerea bolilor hepatice la copiii obezi
- 10 milioane de copii africani sunt acum obezi sau supraponderali The World de la PRX