Dolomitul se formează și în mediul de raft în timpul oxidării materiei organice (așa-numita dolomitizare organogenă) legată de rata reducerii sulfatului microbian și a producției de DIC.
Termeni asociați:
- Magneziu
- Liming
- Apa de mare
- Gresie
- Cuarţ
- Gips
- Calcit
- Calcar
Descărcați în format PDF
Despre această pagină
Carbonat de calciu
2.2.8 Dolomită și zaharoză
Dolomita (CaMg (CO 3) 2) poate fi utilizată pentru a prepara CaCO3 precipitat prin separarea componentelor de Ca și Mg. Una dintre dificultățile în separarea componentelor de Ca și Mg în dolomită este solubilitatea redusă a ambelor materiale [92]. Cu toate acestea, utilizarea unei soluții de zaharoză pentru a separa aceste componente de dolomită s-a dovedit a fi o metodă de succes excepțională [93]. Când dolomita calcinată (CaO⋅MgO) este dizolvată într-o soluție de zaharoză, CaO va fi transformat în sucrat de calciu solubil [94], în timp ce MgO rămâne nereacționat și se prezintă sub forma precipitată [93]. Subprodusul purificat de MgO oferă o valoare suplimentară dolomitei în multe aplicații, în timp ce soluția de sucrat de calciu poate fi utilizată pentru a prepara CaCO3 precipitat.
Magneziu
1 CARBONAT DE MAGNEZIU
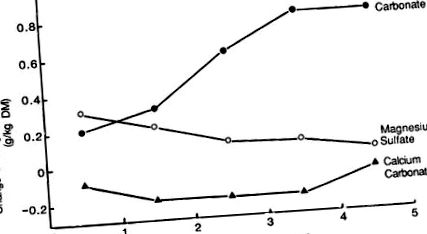
Dolomitul a fost primul îngrășământ utilizat pentru prevenirea hipomagneziemiei (Cunningham, 1936). Atunci când se aplică la o rată cuprinsă între 100 și 540 kg Mg/ha, concentrația de Mg a furajelor temperate este crescută cu 0,2-1,2 g/kg DM (Tabelul 9.13). Aceste creșteri ale concentrației de Mg în furaje au fost asociate cu o creștere a nivelului de Mg schimbabil în sol (Jones, 1963b; Simpson, 1964). Dolomitul are o solubilitate scăzută și creșterea maximă a Mg a avut loc la 3 ani după aplicarea îngrășământului (Fig. 9.8).
TABELUL 9.13. Efectul diferitelor forme și rate ale îngrășământului magneziu asupra concentrației de magneziu în furajele temperate
| Carbonat de magneziu | 100 | 0,2 | Cunningham (1936) |
| 230 | 0,3 | Simpson (1964) | |
| 460 | 0,4 | ||
| 496 | 0,8 | Jones (1963b) | |
| 540 | 1.2 | Stewart și Reith (1956) | |
| Oxid de magneziu | 330 | 1.3 | Griffiths (1959) |
| 670 | 0,9 | Birch și Wolton (1961) | |
| 670 | 1.2 | Parr și Allcroft (1957) | |
| 1600 | 1.6 | Bartlett și colab. (1954) | |
| 1660 | 2.0 | Griffiths (1959) | |
| Sulfat de magneziu | 38 | 0,4 | Griffiths (1959) |
| 48 | 0,6 | Walshe și Conway (1960) | |
| 60 | 0,2 | Birch și Wolton (1961) | |
| 62 | 0,3 | Jones (1963b) | |
| 120 | 1.2 | Walshe și Conway (1960) | |
| 390 | 0,8 | Reid și colab. (1984) |
FIG. 9.8. Efectul inițial și rezidual al diferitelor surse de magneziu.
Dislocări în minerale
2.4 Carbonati
Calcita și dolomita reprezintă o parte semnificativă a rocilor sedimentare. Calcita CaCO3 are o simetrie trigonală, deși este de obicei descrisă în axe hexagonale. 1 3 〈02 2 ¯ 1〉 < 1 1 ¯ 04 >este sistemul de alunecare preferat în calcit într-un interval larg de temperatură (Wenk și colab. 1983). Peste 500 ° C, calcitul poate fi, de asemenea, deformat prin 1 3 〈11 2 ¯ 0) (0001) alunecare și 1 3 〈01 1 ¯ 0〉 < 1 1 ¯ 02 >(De Bresser și Spires 1997). La temperatură scăzută 1 3 〈02 2 ¯ 1〉 luxații alunecă nu numai pe < 1 1 ¯ 04 >, dar și pe < 1 1 ¯ 02 >(deși ultimul sistem de alunecare are o tensiune de forfecare critică rezolvată (CRSS) mai mare; De Bresser și Spires 1997). Înfrățirea mecanică este un important mecanism de deformare în calcit. Cea mai comună lege a înfrățirii deformării este activată < 01 1 ¯ 8 >, pentru care deplasarea la forfecare este în sens pozitiv, în direcția 〈0 2 ¯ 21〉 (Barber și Wenk 1979). Înfrățirea minoră a deformării pe < 1 1 ¯ 04 >și < 1 1 ¯ 02 >au fost raportate și avioane.
Figura 6. Dolomita deformată prin alunecare < 1 1 ¯ 02 >la 480 ° C. Câmpul prezintă perechi de superpărți de tip muchie (de exemplu, la S, S ′), superdislocări nedisociate (de exemplu, la U, U ′) și segmente mai lungi de tip șurub. Defecțiuni în < 1 1 ¯ 02 >sunt slab vizibile datorită împrăștierii între benzi. Micrografie TEM pe câmp întunecat, g: 0006 (prin amabilitatea lui D. J. Barber).
Materiale de construcție: piatră de dimensiune
2.3 Grup de marmură
Marmura adevărată se formează prin recristalizarea calcarului sau dolomitei datorită creșterii căldurii și presiunii (metamorfism regional) sau a căldurii crescute care însoțește evenimentele magne (metamorfism termic). Cu toate acestea, rocile din grupul de marmură includ roci formate în alte moduri și variază în compoziție, de la roci carbonatate pure la roci care conțin doar un procent mic de minerale carbonatice. De exemplu, marmura serpentină este o piatră formată în principal sau în întregime din serpentină verde până la negru-verzuie, în mod obișnuit venată cu calcit, dolomit sau magnezit. Travertinul și unele calcare, în special calcarul dens, microcristalin, sunt adesea grupate cu marmură. Toate aceste roci trebuie să fie capabile să ia o ojă pentru a fi incluse în grupul de marmură.
Adevărata marmură apare în Munții Appalachi din estul SUA și în statele vestice, inclusiv Munții Stâncoși și zonele din vest. Unele calcaruri din regiunea continentului mijlociu sunt clasificate ca marmură. Cea mai notabilă este marmura Tennessee situată în provincia Valley și Ridge, pe flancul de vest al Munților Appalachian.
Clasificare, nomenclatură și formare ☆
Roci carbonatate
Figura 11. Asamblări minerale posibile în metacarbonate cu grad metamorfic în creștere.
Hidropedologie în solurile Caliche, degradate din calcarul Glen Rose din epoca Cretacicului inferior din Texas
Larry P. Wilding,. Henry Lin, în Hidropedologie, 2012
4.1.5 Echivalent carbonat de calciu (CCE)
FIGURA 8. Parcelați cutii cu (a) echivalent carbonat de calciu (CCE), (b) conținut de fragment gros (CF), (c) conținut de argilă și (d) capacitate de schimb cationic (CEC). Numărul de observații pentru fiecare diagramă de cutie este dat în Tabelul 3 .
CCE-urile ridicate promovează potențiale scăzute de contracție/umflare în solurile caliche, cu valori ale coeficientului de extensibilitate liniară (COLE) variind de la zero la Wilding, 2007). Un motiv pentru valori atât de scăzute ale COLE în solurile caliche este faptul că 10-50% (medie de 25%) din fracția totală de argilă este argila carbonatată (West, 1986). Acest lucru reduce potențialul de contracție/umflare a argilelor noncarbonate. Calciul și Mg sunt cationii interschimbabili dominanți care ajută la menținerea structurii solului într-o stare floculată cu rapoarte scăzute de adsorbție a sodiului. Reacția solului în toate orizonturile este tamponată în domeniul pH-ului de 7,0-8,5 de CCE-uri ridicate. Peisajele sunt stabile din punct de vedere fizic și prezintă un pericol mic de mișcare a masei sau de scădere, chiar și pe ascensori abrupți cu panta de până la 45%. Ratele de infiltrare moderat ridicate sunt menținute în solurile caliche independente de textura solului datorită sistemelor de sol floculate care au o capacitate de contractare/umflare neglijabilă.
CALCIU ȘI MAGNEZIU ÎN SOLURI
Intrarea în soluri
Calciul din soluri se găsește în principal în minerale precum feldspat, calcit, dolomit, apatit și hornblendă. Sulfatul de calciu (gips) și carbonatul de calciu (calcitul), care apar în solurile aride și, respectiv, calcaroase, controlează concentrația de Ca în aceste soluri. Solurile dezvoltate din calcit au, în general, reacții alcaline. Un pH ridicat și prezența de Ca favorizează formarea complexelor de humat de Ca, care explică culoarea închisă a acestor soluri. Conținutul de Ca al solurilor depinde de tipul de materiale părinte și de gradul de intemperii. Deși majoritatea solurilor conțin 1,0-50 g kg -1 Ca, unele dintre solurile calcaroase conțin mai mult de 200 g kg -1 Ca.
Magneziul este o componentă normală atât a rocilor magmatice, cât și a celor sedimentare, precum și a solurilor dezvoltate din astfel de roci. Solurile dezvoltate din roci de bază (diabază, bazalt, calcar și serpentină) conțin în general niveluri ridicate de Mg (2,7-28,6 g kg -1) iar cele dezvoltate pe nisip și granit de coastă și gresii conțin niveluri scăzute de Mg (0,1-3,4 g kg −1). În majoritatea solurilor, Mg este prezent în mineralele primare, cum ar fi biotitul, serpentina, olivina, augita și hornblenda, și în mineralele de argilă silicat secundare, cloritul, vermiculitul, ilita și montmorillonitul (Tabelul 1), în materia organică ca cation schimbabil, și, de asemenea, în soluție de sol. Cu toate acestea, majoritatea Mg din sol este prezentă în forme care nu sunt ușor accesibile plantei.
Tabelul 1. Minerale de calciu și magneziu din soluri
| Actinolit | Ca (Mg, Fe) 3Si4O12 | 40-70 | 100–160 |
| Augite | CaMg (SiO3) 2 | 90–120 | 45–100 |
| Diopsid | CaMg (SiO3) 2 | 75–185 | 20–140 |
| Hornblende | CaMg metasilicat | 50–80 | 10-90 |
| Gips | CaSO4 · 2H2O | 200–250 | - |
| Calcit | CaCO3 | 300–500 | - |
| Fosterit | Mg2SiO4 | - | 320–350 |
| Pirop | 3MgO · Al2O3 · 3SiO2 | - | 60–130 |
| Iolite | H2 (Mg, Fe) 4Al8Si10O37 | - | 50–80 |
| Enstatit | MgSiO3 | - | 180–220 |
| Serpentină | H4Mg3Si2O9 | - | 19–26 |
| Talc | H2Mg3Si4O12 | - | 160–200 |
| Phlogopite | H3Mg3Al (SiO4) 3 | - | 130-180 |
| Biotit | (H, K) 2 (Mg, Fe) 2Al2Si3O12 | - | 10–160 |
| Clinoclor | H8 (Mg, Fe) 5Al2Si3O18 | - | 100–120 |
Deficitul de calciu din soluri poate fi depășit prin adăugarea de compuși care conțin Ca. În mod tradițional, superfosfații (superfosfat unic, SSP; superfosfatul triplu, TSP) au fost folosiți ca sursă majoră de fosfor, dar furnizează și Ca. Ca din superfosfați este prezent în forme ușor solubile de gips (CaSO4 · 2H2O în SSP) și fosfat monocalcic (Ca (H2PO4) 2 în SSP și TSP). Ceilalți doi compuși de Ca utilizați cel mai frecvent sunt varul și gipsul. Varul este adăugat în principal pentru a depăși problemele asociate acidificării solului; gipsul este utilizat atât ca sursă de sulf (S), cât și ca amendament pentru îmbunătățirea condițiilor fizice ale solurilor.
O gamă de materiale calcaroase, care variază prin capacitatea lor de a neutraliza aciditatea, pot furniza sol și Ca și Mg. Acestea includ calcit (CaCO3), var ars (CaO), var stins (Ca (OH) 2), dolomit (CaMg (CO3) 2) și zgură (CaSiO3). Valoarea neutralizantă a acidului a materialelor calcaroase este exprimată în termeni de echivalent carbonat de calciu (CCE), definit ca fiind capacitatea de neutralizare acidă a unui material calciar exprimată ca procentaj în greutate de CaCO3 pur. O valoare de neutralizare mai mare de 100 indică o eficiență mai mare a materialului față de CaCO3 pur. Cantitatea de material de calciu necesară pentru rectificarea acidității solului depinde de valoarea neutralizantă a materialului de calciu și de capacitatea de tamponare a pH-ului solului. Recent, a fost evaluată valoarea potențială a altor compuși care conțin Ca în depășirea problemelor asociate acidificării solului. Unele dintre aceste materiale includ roci fosfatice, gips de desulfurare a gazelor arse (FGD), cenușă a cazanului cu pat fluidizat, cenușă zburătoare și composturi organice stabilizate cu var.
Deficiența de magneziu din soluri poate fi depășită prin adăugarea de îngrășăminte Mg, cum ar fi superfosfatul serpentin, sare epsom, kieserită, dolomită și magnezită calcinată (magnezie) (Tabelul 2). Sarea Epsom și kieserita sunt surse de Mg cu eliberare rapidă, utilizate atât pentru soluri, cât și pentru aplicații foliare. Celelalte îngrășăminte insolubile în apă sunt utilizate ca surse cu eliberare lentă. Dolomitul, care conține atât Ca cât și Mg, este mai eficient în solurile acide, deoarece Mg este adus în soluție de solul acid. Dolomita este cea mai utilizată sursă de Mg, atât ca ingredient al îngrășămintelor mixte, cât și ca amendament separat pentru calciu. Rareori va fi nevoie de Ca și Mg suplimentare pentru orice cultură în care acidificarea continuă a solurilor (de exemplu, pășunile pe bază de leguminoase) necesită un program regulat de calcare, în care dolomita este principalul material de calcare.
Masa 2. Îngrășăminte cu calciu și magneziu
- Gelatina - o prezentare generală Subiecte ScienceDirect
- Gălbenuș de ou - o prezentare generală Subiecte ScienceDirect
- Germaniul - o prezentare generală Subiecte ScienceDirect
- Fungus - o prezentare generală Subiecte ScienceDirect
- Centrifuga - o prezentare generală Subiecte ScienceDirect