Corespondență cu: Roberto Berni Canani, MD, dr., Departamentul de Pediatrie, Universitatea din Napoli „Federico II”, Via S Pansini 5, Napoli 80131, Italia. ti.aninu@inreb
Telefon: + 39-81-746286 Fax: + 39-81-51278
Abstract
Efectele benefice multiple asupra sănătății umane a butiratului de acizi grași cu lanț scurt, sintetizat din carbohidrați neabsorbiți de microbiota colonică, sunt bine documentate. La nivel intestinal, butiratul joacă un rol reglator asupra transportului lichidului transepitelial, ameliorează inflamația mucoasei și starea oxidativă, întărește bariera de apărare epitelială și modulează sensibilitatea viscerală și motilitatea intestinală. În plus, un număr tot mai mare de studii au subliniat rolul butiratului în prevenirea și inhibarea cancerului colorectal. La nivel extraintestinal, butiratul exercită efecte potențial benefice asupra multor afecțiuni, inclusiv hemoglobinopatii, boli metabolice genetice, hipercolesterolemie, rezistență la insulină și accident vascular cerebral ischemic. Mecanismele de acțiune ale butiratului sunt diferite; multe dintre acestea sunt legate de efectele sale de reglare puternice asupra expresiei genelor. Aceste date sugerează un spectru larg de efecte pozitive exercitate de butirat, cu un potențial ridicat pentru o utilizare terapeutică în medicina umană.
INTRODUCERE
tabelul 1
Principalele efecte de butirat potențial utile în medicina umană
| Nivelul intestinal | Nivel extraintestinal |
| Absorbția ionilor | Sensibilitate la insulină |
| Proliferarea celulelor | Sinteza colesterolului |
| Diferențierea celulară | Consum de energie |
| Funcția de barieră intestinală | Eliminator de amoniac |
| Reglarea imunitară | Stimularea β-oxidării acizilor grași cu lanț foarte lung și proliferarea peroxizomilor |
| Stresul oxidativ | Funcția CFTR |
| Motilitatea intestinală | Neurogeneza |
| Percepția viscerală și complianța rectală | Producția de HbF |
CFTR: Regulator al conductanței transmembranare a fibrozei chistice; HbF: Butirat pentru creșterea hemoglobinei fetale.
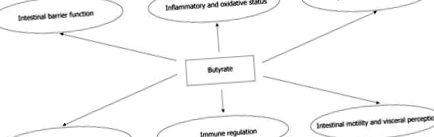
Efectele multiple ale butiratului la nivel intestinal.
EFECTELE BUTIRATULUI LA NIVELUL INTESTINAL
Efecte asupra transportului de ioni transepithelial
Efecte asupra creșterii și diferențierii celulare
Efecte asupra stării inflamatorii și oxidative
Majoritatea studiilor clinice care analizează efectele butiratului asupra stării inflamatorii s-au concentrat pe pacienții cu UC. Hallert și colab. [60] au instruit 22 de pacienți cu UC în repaus să adauge 60 g tărâțe de ovăz (corespunzătoare a 20 g fibre dietetice) la dieta lor zilnică. Patru săptămâni din acest tratament au dus la o creștere semnificativă a concentrației de butirat fecal și la o îmbunătățire semnificativă a simptomelor abdominale. Într-un studiu multicentric dublu orb, controlat cu placebo, Vernia și colab. [61] au tratat 51 de pacienți cu UC distală activă cu clisme rectale care conțin fie acid 5-aminosalicilic (5-ASA), fie 5-ASA plus butirat de sodiu (80 mmol/L, de doua ori pe zi). Tratamentul combinat cu 5-ASA topic plus butirat de sodiu a îmbunătățit semnificativ scorul activității bolii mai mult decât 5-ASA singur. Aceste și alte studii de intervenție [62-64] au sugerat că administrarea luminală de butirat sau stimularea producției de butirat luminal prin ingestia de fibre dietetice are ca rezultat o ameliorare a inflamației și simptomelor la pacienții cu UC.
Numeroase studii au raportat că metabolismul butiratului este afectat în mucoasa inflamată intestinală a pacienților cu IBD. Datele recente arată că deficitul de butirat rezultă din reducerea absorbției butiratului de către mucoasa inflamată prin reglarea descendentă a MCT1. Inducerea concomitentă a transportorului de glucoză GLUT1 sugerează că inflamația ar putea induce o trecere metabolică de la butirat la oxidarea glucozei. Se așteaptă ca deficitul de transport al butiratului să aibă consecințe clinice. În special, reducerea disponibilității intracelulare a butiratului în colonocite poate reduce efectele sale protectoare împotriva cancerului la pacienții cu IBD [65].
Dovezi limitate din studiile preclinice arată că stresul oxidativ din mucoasa colonică poate fi modulat de butirat. Stresul oxidativ este implicat atât în inflamație [66], cât și în procesul de inițiere și progresie a carcinogenezei [67]. În timpul stresului oxidativ există un dezechilibru între generarea speciilor reactive de oxigen (ROS) și mecanismele de apărare antioxidante, ducând la o cascadă de reacții în care lipidele, proteinele și/sau ADN-ul se pot deteriora. La omul sănătos, s-a demonstrat că butiratul administrat local în concentrații fiziologice a crescut GSH-ul antioxidant și, eventual, a scăzut producția de ROS, după cum se indică printr-o scădere a producției de acid uric [68]. Deoarece colonul uman este expus continuu la o varietate de stimuli toxici, producția sporită de butirat în colon ar putea duce la o rezistență sporită împotriva stimulilor toxici, îmbunătățind astfel funcția de barieră. Acest lucru ar putea fi relevant pentru tratamentul tulburărilor gastro-intestinale, cum ar fi sindromul de colon iritabil post-infecțios (IBS), colita microscopică, IBD și colita de deviere.
Efecte asupra mecanismelor de apărare intestinale nespecifice
Componentele principale ale mecanismelor nespecifice de apărare a barierei intestinale sunt stratul mucos care acoperă epiteliul, producția de peptide antimicrobiene și joncțiunile strânse, care protejează mucoasa gastro-intestinală împotriva agenților patogeni. Dovezile sugerează un rol pentru butirat în întărirea barierei de apărare a colonului. Butiratul stimulează producția de mucină MUC2 într-o linie celulară de colonocite umane (LS174T). Expresia crescută a genei MUC2 și inducerea sintezei mucinei pot afecta stratul mucos ducând la o protecție sporită împotriva agenților luminali [69,70].
Combinate cu alte componente ale sistemului imunitar înnăscut, peptidele antimicrobiene (AMP) formează prima linie de apărare împotriva infecțiilor. Cele două clase majore de AMP găsite la om sunt defensinele și catelicidinele. În timp ce intestinul exprimă numeroase defensine, LL-37 este singura peptidă derivată din catelicidină exprimată la om. Mai multe studii au demonstrat un efect al butiratului asupra expresiei genei LL-37 și au sugerat că mecanismul molecular poate fi legat de o creștere a acetilării histonei și a semnalizării proteinelor activate mitogen (MAP) kinază [71-75]. Utilizarea inhibitorilor HDAC, cum ar fi butiratul, pentru a spori expresia genei LL-37 poate deveni o abordare nouă pentru întărirea imunității înnăscute pentru tratarea sau prevenirea infecțiilor intestinale.
Butiratul reglează, de asemenea, bariera de apărare a colonului prin efectele sale asupra permeabilității intestinale, care depinde de concentrația sa. La concentrații scăzute, butiratul induce o scădere reversibilă dependentă de concentrație a permeabilității la modelele de linie celulară intestinală [76,77]. Efectul butiratului asupra permeabilității epiteliale intestinale implică asamblarea joncțiunilor strânse prin proteina kinază activată AMP (AMPK) [78].
Efecte asupra percepției viscerale și motilității intestinale
Se știe puțin despre reglarea de mediu și nutrițională a sistemului nervos enteric (ENS), care controlează motilitatea gastro-intestinală. Butiratul reglează homeostazia mucoasei colonice și poate modula excitabilitatea neuronală. Soret și colab. [79] au investigat efectele butiratului asupra ENS și asupra motilității colonului și au arătat, in vivo și in vitro, că butiratul a crescut semnificativ proporția colinei acetiltransferazei (ChAT), dar nu a oxigenului azotic sintază (nNOS) imentoreactiv myenteric neuroni. Butiratul crește răspunsul contractil al mușchilor circulari colonici mediați colinergic ex vivo. Autorii sugerează că butiratul ar putea fi utilizat, împreună cu abordările nutriționale, pentru a trata diverse tulburări de motilitate gastro-intestinală asociate cu inhibarea tranzitului colonic.
EFECTE LA NIVELUL EXTRAINTESTINAL
Hemoglobinopatii
Studiile clinice efectuate la pacienții cu boală falciformă și β-talasemie au confirmat capacitatea butiratului de a crește producția de hemoglobină fetală (HbF) [86-89]. Butiratul este un inductor al HbF printr-o reglare epigenetică a expresiei genei globinei fetale prin inhibarea HDAC, rezultând hiperacetilarea globală a histonelor, inclusiv nucleozomi la promotorii γ-globinei [90]. Alte experimente au arătat că butiratul poate determina o creștere rapidă a asocierii ARN-y-globină cu ribozomi [91]. Alți autori au demonstrat activarea proteinelor kinaze p38 activate cu mitogen (MAPK) și a căilor de semnalizare a nucleotidelor ciclice în asociere cu inducerea butiratului de HbF [92]. Luate împreună, aceste studii sugerează că hiperacetilarea globală a histonelor indusă de inhibarea HDAC nu este mecanismul unic care stă la baza stimulării butiratului HbF.
Boli metabolice genetice
Fenilbutiratul de sodiu 4 (4-PBA) a fost aprobat de Food and Drug Administration (FDA) pentru utilizare la pacienții cu deficit de enzime ale ciclului ureei, în care acționează ca un agent de eliminare a amoniacului. Într-adevăr, 4-PBA este oxidat la fenilacetat, care se leagă de glutamină și determină excreția urinară. La pacienții cu deficit de ornitină transcarbamilază, utilizarea 4-PBA permite un control metabolic mai bun și un aport crescut de proteine naturale în dietă [93].
De asemenea, a fost studiată posibila utilizare a butiratului în tratamentul adrenoleucodistrofiei legate de X (X-ALD), o tulburare a peroxizomilor caracterizată prin alterarea metabolismului și acumularea de acizi grași cu lanț foarte lung. Fenilbutiratul de sodiu 4 induce, in vitro pe fibroblaste de la pacienții cu X-ALD și in vivo la șoareci knock-out X-ALD, o creștere a β-oxidării acizilor grași cu lanț foarte lung și proliferarea peroxizomilor [94].
Hipercolesterolemie
În condiții lipidemice normale, ficatul este cel mai important loc de biosinteză a colesterolului, urmat de intestin. Biosinteza ficatului și a intestinului reprezintă aproximativ 15% și, respectiv, 10% din cantitatea totală de biosinteză a colesterolului în fiecare zi [95,96]. În hipercolesterolemie, când biosinteza colesterolului este suprimată în majoritatea organelor prin post, intestinul devine locul principal al biosintezei colesterolului, iar contribuția acestuia poate crește până la 50%. Important, dovezile recente arată că efectul global al butiratului este de a regla în jos expresia a nouă gene cheie implicate în biosinteza colesterolului intestinal, inhibând potențial această cale [97].
Obezitatea și rezistența la insulină
Suplimentarea dietetică cu butirat poate preveni și trata obezitatea indusă de dietă și rezistența la insulină la modelele de șoareci. După un tratament de 5 săptămâni cu butirat, șoarecii obezi au pierdut 10,2% din greutatea corporală inițială. În concordanță cu modificarea greutății corporale, conținutul de grăsime a fost redus cu 10%. Mai mult, glucoza de post a fost redusă cu 30%, rezistența la insulină a fost redusă cu 50%, iar toleranța la insulină intraperitoneală a fost îmbunătățită semnificativ de butirat. Mecanismul acțiunii butiratului este legat de promovarea cheltuielilor de energie și inducerea funcției mitocondriale. Stimularea activității coactivatorului (PGC-1α) al receptorului activat al proliferatorului peroxizomului (PPAR) a fost sugerată ca mecanism molecular al butiratului. Activarea AMPK și inhibarea histonei deacetilaze pot contribui la reglarea PGC-1α. Aceste date sugerează că butiratul poate avea o aplicare potențială în prevenirea și tratamentul sindromului metabolic la om [98].
Accident vascular cerebral ischemic
PROBLEME LEGATE DE UTILIZAREA CLINICĂ A BUTIRATULUI
masa 2
Posibile indicații terapeutice ale butiratului în gastroenterologie
- Efectele PLOS ONE ale blocadei directe a reninei asupra renale; Hemodinamica sistemică și activitatea RAAS, în
- Suplimentul caloric neproteic îmbunătățește aderența la dieta cu conținut scăzut de proteine și exercită beneficii
- Boli pleurale Centrul medical din Boston
- Sarea în pâine în Europa potențialele beneficii ale reducerii - Quilez - 2012 - Nutrition Reviews - Wiley
- Boli netransmisibile Hipertensiune arterială