Abstract
procesul natural de îmbătrânire este legat de o modificare progresivă și, în cele din urmă, de o pierdere a funcției organelor. Aceste modificări sunt comune tuturor speciilor. În general, există o corelație între schimbările structurale și funcționale asociate cu îmbătrânirea. La mamifere, procesele degenerative, cum ar fi arterioscleroza, dezvoltarea plăcilor senile în creier și înlocuirea parenchimului funcțional cu țesut fibroconectiv într-o varietate de organe sunt considerate manifestări ale îmbătrânirii (19, 41).
Ultrastructural, o reducere a numărului de organite celulare, cum ar fi mitocondriile, este frecventă în procesul de îmbătrânire (13, 21, 36). Producția de radicali liberi pe tot parcursul vieții ar putea juca un rol major în reducerea numărului și în modificările mitocondriilor structurale și funcționale (6, 20, 38). S-a postulat pe scară largă că speciile reactive de oxigen (ROS) sunt implicate cauzal în procesul de îmbătrânire (19, 20). În acest sens, datele anterioare (4, 17) au confirmat că activitatea oxidului nitric sintază (NOS) în producția de aortă și oxid nitric (NO) scade odată cu înaintarea în vârstă, în timp ce administrarea cronică pe termen lung a inhibitorilor de angiotensină II (ANG II) menține activitate endotelială NOS la animale vechi. Mai mult, mitocondriile din inimile șobolanilor în vârstă tratați cronic cu inhibitori ANG II s-au dovedit a avea o activitate NOS crescută și a scăzut formarea de peroxid de hidrogen în comparație cu martorii (10).
Sistemul renină-angiotensină (RAS) prin agentul său activ ANG II are o mare varietate de acțiuni fiziologice care includ reglarea tensiunii arteriale, homeostazia sodiului și a apei și stimularea altor sisteme endocrine. Unele dintre acțiuni sunt exercitate ca un sistem endocrin. În ultimele decenii, o cantitate vastă de informații a descoperit o multitudine de efecte cardiovasculare și renale dăunătoare atribuite excesului de ANG II. Această peptidă este acum cunoscută ca acționând ca un factor paracrin, autocrin și intracrin, ale cărui mecanisme de acțiune variază de la excitație sau leziuni ale organelor întregi pentru a influența creșterea și funcția celulară, modificări ale căilor de semnalizare intracelulară și promovarea modificărilor matricei extracelulare. Recent, efectele dăunătoare ale ANG II în inimă au fost legate de activarea proteinei adaptor p66 Shc (18).
În ultimii ani am investigat efectele dăunătoare datorate îmbătrânirii asupra organelor țintă la șobolanul mascul normal Wistar. În același timp, am analizat efectul protector al inhibiției cronice a ANG II fie cu un CEI (enalapril), fie cu un AT1RB (losartan), administrat de la înțărcare, asupra acestor modificări. Rezultatele prezente descriu modificările cardiovasculare cauzate de îmbătrânirea la șobolanul normal și efectul protector observat în acest sistem datorită inhibării pe termen lung a ANG II cu fiecare dintre acești agenți farmacologici. Mai mult, am determinat și influența fiecărui tratament asupra duratei de viață la șobolanul normal.
Șobolani și design experimental pentru tratamente medicamentoase
Șobolanii masculi Wistar au fost folosiți și au primit îngrijire în conformitate cu și sub o licență acordată de Comitetul nostru instituțional de îngrijire și utilizare a animalelor și în conformitate cu Ghid pentru îngrijirea și utilizarea animalelor de laborator (National Institutes of Health, revizuit în 1996). Animale (n = 120) au fost împărțite la întâmplare în trei grupe egale după înțărcare: 1) control (apă de la robinet pentru a bea), 2) losartan (30 mg · kg −1 · zi −1 în apa potabilă) și 3) enalapril (10 mg · kg -1 -1 zi -1) (ambele medicamente de la Merck, Rahway, NJ). Șobolanii au fost adăpostiți în grupuri de câte cinci pe cușcă, cu un ciclu de lumină-întuneric de 12: 12 ore și un interval de temperatură de 20-22 ° C. Chow-ul de șobolan și materialul de băut erau disponibile gratuit.
Măsurarea tensiunii arteriale sistolice și greutatea cardiacă și aortică
Tensiunea arterială sistolică (SBP) a fost măsurată o dată pe lună pe întreaga perioadă experimentală la șobolanii conștienți la 30 ° C prin pletismografie cu coș-manșetă folosind un traductor de presiune (Narco Biosystems, Houston, TX) conectat la un osciloscop. Aportul de apă și greutatea corporală au fost determinate de două ori pe săptămână pentru a ajusta administrarea medicamentului. După 6 luni de tratament, 10 animale din fiecare grup au fost ucise sub anestezie pentobarbitală (40 mg/kg). În mod similar, după 18 luni, 10 șobolani din fiecare grup au fost uciși. Inima, aorta și artera mezenterică au fost excizate, curățate și cântărite. După îndepărtarea atriilor, ventriculul drept a fost separat și cântărit.
Lungimea cozii
Lungimea cozii ca măsură a creșterii (14) a fost măsurată cu o riglă metrică standard de la anusul animalului până la vârful cozii de către același experimentator pentru a asigura uniformitatea.
Evaluarea histologică
Ventriculul stâng și aceeași porțiune a aortei toracice au fost izolate, păstrate în 10% formaldehidă și încorporate în parafină pentru determinări histologice. Secțiunile histologice au fost colorate cu hematoxilină-eozină și tricromul lui Masson. Colagenul de tip III a fost, de asemenea, evaluat prin imunohistochimie (IHC) în ventriculul stâng. A fost cuantificat cu anticorpi monoclonali anti-colagen de tip III (Biogenex, San Ramon, CA), la o diluție de 1: 100. Lățimea aortică a fost evaluată prin IHC folosind anticorpi monoclonali α-actinici (Sigma, St. Louis, MO).
Analizele morfometrice au fost efectuate în ambele țesuturi; acestea au inclus diametrul transvers al cardiomiocitului și lățimea vasului. Au fost realizate douăzeci de secțiuni histologice din fiecare organ și s-au analizat 10 structuri vasculare pe secțiune histologică.
Secțiunile histologice au fost analizate cu un microscop cu lumină Nikon E400 (Nikon Instrument Group, Melville, NY). Pentru evaluare a fost utilizat software-ul Image-Pro Plus 4.5.1.29 (Media Cybernetics, Silver Spring, MD) 1) lățimea aortică și zona aortică, 2) diametrul miocardiocitelor și aria secțiunii transversale și 3) fibroza subendocardică și subpericardică.
Un singur investigator orbit de grupurile experimentale a efectuat analizele.
Tehnici morfometrice
Lățimea aortică.
Secțiunea transversală a navei a fost măsurată cu o linie perpendiculară care merge de la perimetrul extern la interior. Datele obținute sunt exprimate în micrometri.
Zona aortică.
Au fost măsurate patru zone opuse ale aortei pe navă, excluzând adventitia. Datele obținute sunt exprimate în milimetri pătrați.
Diametrul miocardiocitelor și aria secțiunii transversale.
Cinci imagini ale miocardului au fost achiziționate aleatoriu. Au fost studiate zece celule consecutive ale fiecărei imagini, pentru un total de 50 de miocardiocite pe animal. Diametrul și aria miocardiocitelor au fost evaluate la × 400.
DIAMETRU MIOCARDIOCIT.
Au fost obținute și mediate diametre longitudinale și transversale ale fiecărei celule. Rezultatele sunt exprimate în micrometri.
ZONA SECȚIUNII TRANSVERSALE MIOCARDIOCITE.
Software-ul a evaluat suprafața fiecărei celule. Rezultatele sunt exprimate în micrometri pătrați.
Evaluarea fibrozei cardiace.
Tricromul Masson și colagenul III au fost utilizate pentru a determina fibroza cardiacă (× 100). Severitatea fibrozei cardiace a fost evaluată în 10 zone ale miocardului, 5 din subendocard și 5 din regiunea subepicardică. Intensitatea procesului fibrotic a fost exprimată ca procent din suprafața totală a țesutului ocupată de țesutul colorat.
Durată de viață
Șobolanii rămași în fiecare grup au fost folosiți pentru a determina timpul de supraviețuire. Toate animalele au fost ulterior urmărite până la moarte. Starea tuturor animalelor a fost monitorizată zilnic de către un medic veterinar. În timpul studiului, șobolanii individuali au fost eutanasiați în conformitate cu criteriile medicului veterinar: tumori care au afectat mișcarea, sângerarea ulcerului abdominal sau al piciorului, infecții respiratorii sau atingerea unei stări moribunde (incapacitatea de a mânca sau de a bea sau de respirație dificilă). În toate cazurile în care s-a solicitat eutanasierea, data eutanasiei a fost considerată ca fiind data morții.
Statistici
Toate datele sunt prezentate ca mijloace ± SE; A P valoare −1 · zi −1).
tabelul 1. Modificări ale greutății corporale pe întreaga perioadă experimentală la șobolanii martori și tratați la șobolani normali
Datele (în g) sunt exprimate ca mijloace ± SE pentru n = 20 șobolani/grup.
* P −1 · zi −1 la 1 lună) și stabilizare la vârsta de ∼6 luni (10 ml · 100 g −1 · zi −1). A fost crescut prin administrarea de enalapril pe toată perioada experimentală, 31 ± 2% la 6 luni și 28 ± 3% la 18 luni.
Greutatea inimii, a ventriculului stâng și aortică a fost mai mică la ambele grupuri de animale tratate comparativ cu șobolanii martori normali la 6 (Tabelul 2) și 18 (Tabelul 3) mo. Când greutatea organelor a fost normalizată de greutatea corporală, diferențele au dispărut la șobolanii tratați cu enalapril din cauza greutății corporale mai mici, ceea ce arată că această relație nu a fost adecvată în acest caz.
masa 2. Greutatea corpului și a organelor la șobolanii martori vechi de 6 luni și tratați la șobolani normali
Datele sunt exprimate ca mijloace ± SE pentru n = 10 șobolani/grup. BW, greutate corporală; HW, greutatea inimii; LVW, greutatea ventriculului stâng; RVW, greutatea ventriculară dreaptă; AoW, greutatea aortică; MAW, greutatea arterei mezenterice.
Tabelul 3. Greutatea corpului și a organelor la șobolanii martori de 18 luni și tratați la șobolani normali
Datele sunt exprimate ca mijloace ± SE pentru n = 10 șobolani/grup.
Tabelul 4. Presiunea arterială sistolică pe întreaga perioadă experimentală la șobolani martori și tratați
Datele (în mmHg) sunt exprimate ca mijloace ± SE pentru n = 20 șobolani/grup.
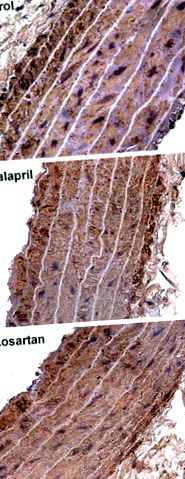
FIG. 1.Fotomicrografii histologice aortice la 18 luni. Imunomarcare a actinei musculare anti-α-netede, mărire × 400. Fotomicrografiile reprezentative arată diferențe în ceea ce privește lățimea aortică în grupurile de control, enalapril și losartan.
Tabelul 5. Lățimea și zona aortică și diametrul miocitelor și aria secțiunii transversale la șobolani normali cu control de 6 și 18 luni și tratați
Datele sunt exprimate ca mijloace ± SE pentru n = 10 șobolani/grup. D, diametru; CSA, secțiune transversală.
* P
FIG. 2.Fotomicrografii miocardice histologice la 18 luni. Tricromul lui Masson, mărire × 400. Fotomicrografiile reprezentative arată diferențe în ceea ce privește secțiunile transversale ale miocitelor în grupurile de control, enalapril și losartan.
FIG. 3.Fotomicrografii miocardice histologice la 18 luni. Imunomarcare anti-colagen III, mărire × 400. Fotomicrografiile reprezentative arată diferențe în ceea ce privește zonele secțiunii transversale ale miocitelor și fibroza în grupurile de control, enalapril și losartan.
Tabelul 6. Modificări ale procentului de fibroză subpericardică și subendocardică și colagen III în inimile martorului de 18 luni și șobolanii normali tratați
Datele (în%) sunt exprimate ca mijloace ± SE pentru n = 10 șobolani/grup. Spe, subpericardic; Sen, subendocardic.
* P Shc genă. În același timp, acesta din urmă conferă rezistență la stres oxidativ (34). S-a sugerat că receptorul AT1 transactivează o semnalizare intracelulară controlată de factorii de creștere și de receptorii lor de tirozin kinază; acest mecanism din aval cuprinde p66 Shc proteină adaptor care poate juca un rol în senescența celulară. Un raport recent în p66 Shc -șoarecii knockout propun un rol fundamental al acestei gene în remodelarea cardiacă mediată de ANG II (18). Alte descoperiri sugerează că activarea RAS poate fi importantă pentru modificările fiziologice la inimile în vârstă (23); datele anterioare au arătat că ICE atenuează creșterea celulelor apoptotice ale țesutului cardiac asociată cu îmbătrânirea (22).
Relația dintre ANG II și leziunile vasculare pare a fi, de asemenea, legată de stresul oxidativ. Datele experimentale demonstrează că generarea crescută de ROS prin activarea NAD (P) H oxidazei este o etapă obligatorie în efectele ANG II (7, 35, 46). Dovezi în creștere indică faptul că ROS funcționează ca mesageri secundari intra și intercelulari importanți pentru a modula cascadele de semnalizare care duc la deteriorarea vasculară în bolile cardiovasculare (43); un alt raport recent a afirmat că ANG II promovează inflamația vasculară prin inducerea senescenței premature a celulelor musculare netede vasculare in vivo și in vitro (27).
O constatare importantă a acestui studiu este durata de viață prelungită a ambelor grupuri de șobolani tratați, susținând rezultatele anterioare la șoareci (12). Nici o diferență clară în cauza morții nu a putut fi detectată nici la animalele de control, nici la cele tratate. Singurele dovezi ale deteriorării corpului în toate cazurile au fost pierderea în greutate care a început mai târziu la animalele tratate. Astfel, protecția cardiovasculară nu poate fi direct legată de extinderea duratei maxime de viață. Cu toate acestea, s-a postulat că p66 Shc face parte dintr-o cale de transducție a semnalului care reglează răspunsurile apoptotice de stres și durata de viață la mamifere, iar nivelurile acestei expresii genetice se corelează cu durata de viață a șoarecilor (44). Stresul oxidativ este implicat în această cale; astfel se poate presupune că inhibarea RAS are efecte antioxidante și antiinflamatorii (37) și, prin aceste acțiuni, ar putea prelungi durata maximă de viață la șobolani. În acest sens, rezistența la deteriorarea oxidativă a fost postulată ca un factor în expansiunea vieții murine.
În concluzie, aceste studii au demonstrat că inhibarea cronică pe termen lung a RAS fie cu un CEI, fie cu un AT1RB induce un efect protector identic și semnificativ asupra procesului dăunător al îmbătrânirii sistemului cardiovascular și o extindere substanțială a duratei de viață în Wistar normal şobolan. Protecția a fost determinată prin analize funcționale și structurale. Activitatea crescută a NOS în endoteliul aortic și în mitocondriile cardiace ar putea indica o reducere a mecanismelor stresului oxidativ chiar la nivel mitocondrial. Sarcina oxidativă redusă susținută poate explica efectul protector. ANG II induce eliberarea excesivă a radicalului superoxid vascular generat de stimularea NADPH oxidazei, care inactivează NO. Inhibarea ANG II ar atenua stresul oxidativ și ar îmbunătăți vasodilatația. Rata scăzută a stresului oxidativ ar putea fi o cheie pentru reducerea proceselor inflamatorii și a producției de citokine și a factorilor de creștere. Această cale ar diminua fibroza și ar păstra funcția și structura în organele țintă analizate și ar putea fi implicată în durata de viață prelungită.
Aceste studii au fost susținute de Grant PIP 02363/04 de la Consiliul Național de Cercetare din Argentina (CONICET). N. Basso și N. A. Terragno sunt membri ai CONICET.
NOTĂ DE PICIOASĂ
Costurile de publicare a acestui articol au fost suportate parțial prin plata taxelor de pagină. Prin urmare, articolul trebuie marcat prin prezenta „publicitate”În conformitate cu 18 U.S.C. Secțiunea 1734 doar pentru a indica acest fapt.
Autorii recunosc asistența profesională a Nora Paglia ca medic veterinar și a Dr. Inés Stella în evaluarea histologică a țesuturilor.
Adrese actuale: N. A. Terragno, Departamentul 2 de farmacologie, Facultatea de Medicină, Universitatea din Buenos Aires, Paraguay 2155, Po 16, Sector M, C1121ABG Buenos Aires, Argentina; L. Ferder, Departamentul de Fiziologie și Farmacologie. Școala de medicină Ponce, Dr. Ana Perez Marchand St., PO Box 7004, Ponce, Puerto Rico 00732-7004.
- Acizi fenolici ai cerealelor moderne și antice Efect asupra modelului de celule in vitro - Truzzi - 2020 - Jurnal
- Studiul efectului antiobezității prin inhibarea activității lipazei pancreatice a Diospyros kaki
- Corelate ontogenetice ale dietei la lemurii malgași - Godfrey - 2004 - American Journal of Physical
- Efectul protector al alăptării împotriva infecției tractului urinar
- Obesity Takes Center Stage Journal of Ethics American Medical Association