Abstract
fundal
Tratamentele medicale actuale pentru endometrioză sunt foarte limitate. Modulatorii selectivi ai receptorilor de progesteron și progesteron (SPRM) au fost dezvoltați, dar eficacitatea, siguranța, mecanismul și recurența lor în endometrioză nu sunt studiate pe deplin.
Metode
Pentru a compara efectele terapeutice, efectele secundare și acțiunile terapeutice ale Esmya, Duphaston și Dienogest în endometrioză. Endometrioza experimentală a fost indusă fie prin transplant intraperitoneal, fie subcutanat de endometru de șoarece. Mărimea leziunii, greutatea și histologia la sfârșitul intervenției au fost comparate. Au fost examinate expresia markerilor înrudiți în leziunile endometriotice. Au fost măsurate greutățile corpului, uterului și ovarului, glandelor și grosimilor endometriale (ETI), precum și numărul foliculilor. Pentru studiu recurent, creșterea leziunii înainte și după intervenție a fost monitorizată.
Rezultate
După Esmya, Duphaston, tratamentul cu Dienogest, dimensiunea și greutatea leziunii au fost semnificativ reduse. Proliferarea expresiei Pcna a fost semnificativ redusă în toate grupurile, dar celulele de proliferare au fost reduse semnificativ doar în grupul Duphaston. Expresia Mapop1 a apoptozei și celulele pozitive TUNEL au fost crescute semnificativ în grupul Duphaston. Adeziunea expresiei Mmp2 și Itgavβ3 a fost semnificativ crescută în grupul Esmya. Expresia Plau, Hif1α și Vegfa, nivelurile de PGE2 ale fluidului peritoneal și expresia ERα și ERβ nu au fost afectate; în timp ce expresia PR a fost semnificativ mai mică în toate grupurile. Numărul de glande endometriale în uter a fost semnificativ crescut în grupul Dienogest, ETI a scăzut semnificativ în grupul Duphaston, iar AFC au fost semnificativ crescute în grupul Esmya. La încetarea tratamentului, creșterea leziunii revine rapid în grupurile Dienogest și Duphaston, dar încet în grupul Esmya.
Concluzie
Esmya, Duphaston și Dienogest sunt medicamente anti-endometrioză eficiente care vizează proliferarea, apoptoza și aderența. Esmya, Duphaston și Dienogest sunt bine tolerate, deși hiperplazia glandulară endometrială a fost găsită în Dienogest, atrofia endometrială în Duphaston, acumularea foliculului în Esmya.
fundal
Endometrioza este o afecțiune ginecologică benignă și cronică, caracterizată prin prezența țesuturilor de tip endometrial în afara cavității uterine. Afectează aproximativ 10% dintre femeile reproductive și până la 24-50% dintre femeile infertile [1, 2]. Deși endometrioza este o boală dependentă de estrogen, studiile etiologice au arătat că patogeneza endometriozei este complexă și multifactorială [3,4,5,6]. Cea mai larg acceptată și susținută științific teorie pentru apariția endometriozei este menstruația retrogradă, deoarece locațiile anatomice și caracteristicile histochimice ale leziunilor endometriotice [4, 7]. Simptomele clinice ale endometriozei includ, dar nu se limitează la dureri pelvine, dismenoree, dispareunie și infertilitate [8], care au impact semnificativ atât asupra sănătății generale, cât și a celor psihice ale persoanelor afectate [9, 10]. Tratamentul actual disponibil al endometriozei, inclusiv intervenția chirurgicală de îndepărtare și medicația hormonală [11], nu sunt încă ideale pentru femeile reproductive care ar dori să-și păstreze fecunditatea fără niciun efect secundar și recurență.
În prezentul studiu, ne-am propus să comparăm efectele anti-endometriotice, efectele secundare asupra reproducerii, mecanismul terapeutic și recurența Esmya, Duphaston și Dienogest într-un model experimental de șoarece de endometrioză.
Metode
Substanțe chimice și reactivi
17-β-estradiolul a fost achiziționat de la Sigma Chemical Co. (St. Louis, SUA). Ketamina, xilazina și acepromazina au fost achiziționate de la Alfasan (Olanda, Olanda); Anticorpul monoclonal de iepure pentru Ki67 a fost achiziționat de la tehnologia de semnalizare celulară (D3B5, Danvers, SUA). Trusa de detectare a apoptozei in situ a fost achiziționată de la Merck Millipore (SUA). Reactivi pentru RT-PCR și PCR cantitativ au fost cumpărați de la TaKaRa (TaKaRa Bio, Shiga, Japonia). Kituri ELISA de estradiol și progesteron au fost obținute de la Cayman Chemical, SUA. Kitul ELISA Prostaglandin E2 a fost achiziționat de la Abcam (Abcam, Anglia).
Modelul de animale și endometrioză
Șoareci femele C57BL/6 de șase până la șapte săptămâni au fost adăpostite în camere pentru animale fără patogeni, cu un ciclu fix de 12 ore de lumină și 12 ore de întuneric. Au fost furnizate chow-uri de laborator standard și apă curată și toți șoarecii au fost lăsați să se aclimatizeze cu cel puțin 1 săptămână înainte de experimentele. Un amestec de ketamină la 100 mg/kg, xilazină la 10 mg/kg și acepromazină la 3 mg/kg a fost injectat intraperitoneal pentru anestezierea șoarecilor înainte de intervenția chirurgicală invazivă. Pe baza diferitelor obiective ale experimentelor din acest studiu, au fost stabilite două modele diferite de endometrioză la șoareci, după cum urmează. Ciclul estru al animalelor a fost sincronizat prin transferarea așternuturilor masculine îmbibate cu urină la fiecare 5 zile, atât pentru modelul de șoarece de endometrioză IP, cât și pentru cel SC. [27]. Toate experimentele pe animale au fost aprobate de Comitetul de etică pentru experimentarea animalelor, Universitatea chineză din Hong Kong.
Model de șoarece de endometrioză intraperitoneală (IP) pentru siguranță terapeutică și studiu mecanic
Modelul de endometrioză IP a fost stabilit cu modificări minore, așa cum s-a descris anterior [27, 28]. Pe scurt, șoarecii au fost împărțiți în mod aleatoriu în două grupuri, fie donatori, fie beneficiari. În ziua 0, uterul a fost disecat de la fiecare șoarece donator după sacrificare și spălat în PBS de 3 ori. Țesuturile endometriale au fost preparate din fiecare corn uterin cu o lovitură de biopsie de 2 mm. După ce s-au pregătit țesuturi endometriale, șoarecele receptor a fost anesteziat și s-a făcut o incizie de 0,5 până la 1 cm pe linia mediană a peretelui abdomenului șirului și peritoneului. Colonul a fost scos cu grijă și păstrat hidratarea cu PBS steril. Trei bucăți de țesuturi endometriale au fost suturate pe vasele mezenterului cu 6-0 fir chirurgical la fiecare șoarece primitor. Colonul a fost repus cu ușurință în cavitatea peritoneală; peretele și pielea abdomenului au fost închise individual cu 5-0 fire chirurgicale. Șoarecii au fost apoi așezați pe un tampon cald până la recuperarea completă a anesteziei după operație.
Model de șoarece de endometrioză subcutanată (SC) pentru studiul recurenței
Am stabilit un alt model de endometrioză de șoarece prin transplant SC pentru a monitoriza schimbarea dinamică a creșterii leziunii în timpul și după intervențiile medicale. S-a raportat că atât modelul IP, cât și modelul SC prezintă o dezvoltare similară a endometriozei în ceea ce privește creșterea asemănătoare chistului și structurile glandulare și epiteliale ale leziunilor [27, 29]. Aceiași șoareci de tulpină C57BL/6 au fost folosiți pentru a stabili modelul de șoarece endometrioză SC așa cum s-a descris mai înainte [30, 31]. Pe scurt, uterul a fost disecat de la șoareci donatori și țesuturile endometriale au fost preparate ca modelul IP menționat mai sus. Sub anestezie, pielea abdominală a fost rasă și apoi s-a făcut o incizie cutanată de 3 mm pe linia mediană a abdomenului fiecărui șoarece primitor și au fost create cu atenție buzunare bilaterale SC, fără a deteriora peretele abdominal. O bucată de țesut endometrial a fost plasată în fiecare buzunar și apoi incizia cutanată a fost închisă cu 5-0 fire chirurgicale.
Studiați medicamentele
La o săptămână după operație, șoarecii au fost împărțiți în mod aleatoriu în patru grupuri. Fie vehicul (șoarecii au fost tratați cu apă distilată dublă), acetat de Ulipristal (Esmya ™, 1 mg/kg, po, PregLem, Anglia), Dydrogesterone (Duphaston ™, 5 mg/kg, po, Abbott, SUA) sau Progestin Dienogest ™, 0,3 mg/kg, po, Bayer, Germania) au fost administrate pe cale orală în fiecare zi. Doza zilnică orală sugerată pentru om din instrucțiunile producătorului de Esmya, Duphaston și Dienogest a fost de 5 mg, 20-30 mg și respectiv 2 mg. Dozajul fiecărui medicament pentru șoareci s-a bazat pe doza clinică aprobată de FDA pentru om și apoi convertită în doză pentru animale în conformitate cu liniile directoare ale calculatorului FDA pe baza suprafeței umane și a animalelor experimentale [32]. Toate medicamentele au fost dizolvate în volumul adecvat de apă distilată dublă în 100ul.
Pentru modelul IP, medicamentul a durat 28 de zile. Pentru modelul SC, medicamentul a durat 21 de zile. Creșterea leziunilor endometriotice a fost determinată prin măsurarea celei mai lungi lungimi și lățimi perpendiculare a leziunilor la fiecare 3 zile în modelul SC și la sfârșitul intervenției în modelul IP folosind etrierul descris anterior [31]. Apoi toți șoarecii au fost sacrificați și leziunile au fost îndepărtate și spălate în PBS sterilizat, apoi cântărite la balanță. Pentru toate leziunile de la fiecare șoarece, o leziune a fost fixată cu 10% formalină (Sigma) și încorporată în parafină pentru analiză histologică; celelalte leziuni au fost fie scufundate în soluție de ARN ulterior (Ambion () pentru analiza qPCR, fie congelate rapid în azot lichid pentru analiza proteinelor.
Mărimea uterului a fost estimată prin măsurarea și medierea celui mai lung diametru cu etrierul în mijlocul fiecărui corn uterin. Ovarele au fost considerate ca elipsoide, iar dimensiunea ovarului a fost măsurată și calculată conform formulei [33]: 1/6 π × lungime × lățime × grosime (mm 3). Uterul a fost disecat și cântărit înainte de a fi separat în 3 bucăți și depozitat în același mod ca leziunile. Ovarele au fost disecate și apoi fie fixate în 10% formalină pentru analiza histologică, fie depozitate în soluția ARN ulterioară pentru analiza qPCR.
Colorarea hematoxilinei și eozinei
După încorporare, secțiuni de parafină seriale 4um ale leziunilor, uterului și ovarului au fost preparate pe lamele acoperite. Colorarea hematoxilinei și a eozinei va fi efectuată în fiecare a 10-a secțiune pentru a confirma structurile microscopice din leziuni, uter și ovar [34]. A fost măsurată suprafața secțiunilor la microscop.
Imunohistochimie și testul TUNEL
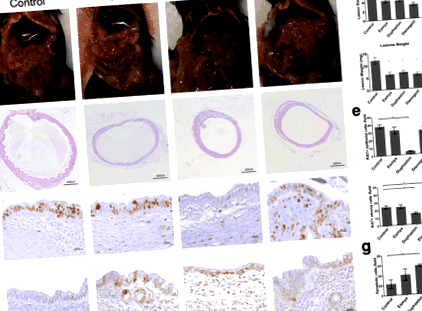
Proliferarea leziunii a fost evaluată prin colorare imunohistochimică folosind anticorp Ki-67 de șoarece anti iepure (D3B5, tehnologie de semnalizare celulară). După dez parafină și rehidratare, antigenele au fost preluate cu tampon de citrat de sodiu în cuptorul cu microunde timp de 20 de minute. Secțiunile au fost incubate cu 1% BSA în PBS la temperatura camerei timp de 1 oră, urmate de incubarea cu anticorp Ki-67 la 4 ° C timp de 15 ore. După incubarea cu anticorpul primar, secțiunile au fost incubate cu anticorpul secundar Donkey anti-Rabbit IgG-HRP (sc2313, Santa Cruz) timp de 1 oră la temperatura camerei și apoi cu culoarea a fost dezvoltată folosind kitul DAB (k3468, Dako). În cele din urmă, secțiunile au fost contracolorate cu hematoxilină și deshidratate în etanol cu concentrație în serie și montate cu lamele de acoperire. Toate secțiunile au fost examinate la microscop. Celulele cu colorare maro puternică sau moderată în nucleare au fost numărate.
Celulele apoptotice din leziune au fost examinate folosind un kit de detectare a apoptozei in situ (ApopTAG®, S7100, Millipore, SUA) conform instrucțiunilor producătorului.
Analiza PCR cantitativă
Numărul glandei uterine și indicele grosimii endometrului
După colorare cu hematoxilină și eozină și examinate la microscop, 6 secțiuni uterine în serie au fost scanate cu un microscop Leica în mărire de 100 ×. Pentru numărul de glande uterine, toate glandele din stratul endometrial au fost numărate și calculate în medie pentru analize statistice. Indicele grosimii endometrului (ETI) a fost evaluat ca metodă descrisă anterior cu unele modificări [43]. Pe scurt, zona endometrului (Ae) și a cavității uterine (Auc) a fost măsurată folosind imaginea J [44]. ETI a fost apoi calculat folosind formula \ (ETI = \ sqrt _ >>> - \ sqrt >> \)
Numărul de foliculi
După colorare cu hematoxilină și eozină și examinate la microscop, 3 secțiuni ovariene seriale au fost scanate cu un microscop Leica în mărire de 40 ×. Clasificarea foliculilor s-a bazat pe criterii morfologice: foliculii primari au fost definiți ca foliculi care conțin ovocite înconjurate de un singur strat de celule granuloase; foliculii secundari au fost definiți ca foliculi care conțin ovocite cu 2 sau mai multe straturi de celule granuloase, iar foliculii antrali au fost definiți ca foliculi care conțin ovocite înconjurate de mai multe straturi de celule granuloase și conțin un antr vizibil [45, 46]. Numărul foliculilor din fiecare clasificare din fiecare probă a fost măsurat și comparat.
Test legat de imuno absorbția enzimelor
Serul și lichidul peritoneal au fost colectate pentru teste imunosorbente legate de enzime. Sângele întreg a fost colectat cu o seringă de 1 ml cu ac de 25G din inima șoarecelui și apoi a fost centrifugat la 4 ° C cu 1000 × g timp de 10 min. Serul a fost colectat după centrifugă și depozitat la -80 ° C. Lichidul peritoneal a fost colectat ca metodă descrisă anterior cu unele modificări [47]. Șoarecii au fost sacrificați prin supradozaj de anestezic; pielea a fost deschisă pentru a expune abdomenul. S-au injectat 3 ml PBS sterilizat și 2 ml aer în peritoneu folosind o seringă de 5 ml și un ac de 21G. Apoi recuperarea peritoneală a fost îndepărtată și centrifugată la 4 ° C, 1000 × g timp de 10 min, supernatantul a fost menținut la -80 ° C înainte de analiză. Concentrațiile de estradiol (E2) și progesteron (P4) în ser și concentrația de prostaglandină E2 (PGE2) în lichidul peritoneal au fost măsurate prin kituri ELISA (Abcam, Anglia) conform instrucțiunilor producătorului.
analize statistice
Analiza statistică a fost efectuată cu Software Graphpad Prism 5, diferențele dintre grupurile de tratament și grupul de control au fost evaluate de One Way ANOVA dacă distribuția de date este normală sau testul Kruskal - Wallis dacă distribuția datelor este înclinată, urmată de multiplele comparații post-hoc ale lui Dunnett. Datele au fost exprimate ca medie ± SEM. p
Rezultate
Creșterea leziunilor endometriotice ectopice
După transplantul IP, leziunile endometriotice s-au dezvoltat în mezenter (Fig. 1a). Comparativ cu controlul vehiculului (dimensiune: 6,744 ± 0,444 mm 2; greutate: 12,1 ± 1,383 mg, n = 9), dimensiunea și greutatea leziunii au fost semnificativ reduse după tratamentul cu Esmya (dimensiune: 4,171 ± 0,442 mm 2, p 2, p 2, p FIG. 1
Acțiuni terapeutice
Profiluri de siguranță
Recidiva retrasă
După transplantul SC, Duphaston a scăzut semnificativ dimensiunea leziunii din ziua 9 (3,609 ± 0,176 mm 2, n = 10, p = 0,0418) de tratament, apoi Dienogest din ziua 12 (3,397 ± 0,157 mm 2, n = 10, p = 0.0024) și Esmya din ziua 15 (3.585 ± 0.160 mm 2, n = 10, p = 0,0223) în comparație cu grupul de control (4,689 ± 0,328 mm 2 sau 4,843 ± 0,199 mm 2 sau 4,844 ± 0,200 mm 2, ziua 9, ziua 12, respectiv ziua 15) (Fig. 4). Când tratamentul a fost întrerupt în ziua 21, dimensiunea leziunii grupului Dienogest a rămas semnificativ mai mică doar până în ziua 36 (4.686 ± 0.377 mm 2 vs 6.028 ± 0.394 mm 2, n = 10, p = 0,0168), la 14 zile după retragere. Dimensiunea leziunii grupurilor Duphaston și Esmya a rămas semnificativ mai mică până în ziua 39 (Duphaston față de control: 4,588 ± 0,324 mm 2 față de 6,001 ± 0,233 mm 2, n = 10, p = 0,0255) și ziua 48 (Esmya vs control: 4,962 ± 0,555 mm 2 vs 6,577 ± 0,379 mm 2, n = 10, p = 0,0352), la 18 zile și, respectiv, la 27 de zile după retragere.
Discuţie
Acesta este primul studiu care compară anti-endometrioza, mecanismul terapeutic, profilul de siguranță și recurența retrasă a Esmya, Duphaston și Dienogest într-un model experimental de endometrioză la șoareci. Rezultatele au arătat că Esmya, Duphaston și Dienogest pot limita în mod eficient creșterea și dezvoltarea leziunii endometriotice (Tabelul 1). Efectele terapeutice sunt în principal prin inhibarea receptorilor de progesteron și proliferarea celulară și activarea mecanismelor de apoptoză. În special, Duphaston a inhibat în mod semnificativ proliferarea atât a celulelor epiteliale, cât și a celulelor stroma și a activat apoptoza în leziunile endometriotice. Deși marja largă de siguranță, Duphaston a indus atrofia endometrială, Dienogest a îmbunătățit hiperplazia glandulară endometrială, Esmya a crescut aderența leziunii și acumularea foliculului antral și recurența la scurt timp după retragerea Dienogest și Duphaston.
Concluzie
Toate Esmya, Duphaston și Dienogest pot suprima creșterea endometriotică pe modelul de șoarece, iar Dienogest are cel mai bun efect de supresie. Esmya are un efect semnificativ de supresie a ovulației și Duphaston poate suprima creșterea endometrului, în timp ce nu s-a constatat niciun efect secundar semnificativ al Dienogest asupra ovarului sau endometrului. Detalierea efectului supresiv al leziunilor endometriotice și a efectelor secundare asupra ovarului sau endometrului nu sunt încă clare și trebuie efectuate studii suplimentare.
- FSPCA Preventive Controls for Human Food Safety Preventive Controls Alliance (FSPCA) Institute
- Profil de siguranță cardiovasculară și experiență clinică cu terapie cu doză mare de domperidonă pentru greață
- Determinarea conținutului de umiditate - calitatea alimentelor; Siguranță
- CBD pentru cercetarea acneei, eficacitate, precauții și multe altele
- Eficacitatea și siguranța anticoagulantelor orale directe versus warfarină la pacienții obezi cu acută