Abstract
Esofagita eozinofilă (EoE) este o afecțiune atopică a esofagului care a devenit din ce în ce mai recunoscută în ultimul deceniu. Diagnosticul tulburării depinde de manifestările clinice ale pacientului și de constatările histologice ale biopsiilor mucoasei esofagiene. Pacienții cu esofagită eozinofilă trebuie direcționați atât la un alergolog, cât și la un gastroenterolog pentru o gestionare optimă, care poate include modificări dietetice, agenți farmacologici precum corticosteroizi, modificatori de leucotrieni și produse biologice, precum și dilatarea mecanică a esofagului. Epidemiologia, fiziopatologia, diagnosticul, tratamentul și prognosticul EoE sunt discutate în această revizuire.
Introducere
Esofagita eozinofilă (EoE) este o boală inflamatorie atopică a esofagului care a devenit din ce în ce mai recunoscută la copii și adulți în ultimul deceniu. Tulburarea este uneori denumită „astm al esofagului”, având în vedere că împărtășește multe caracteristici clinice și fiziopatologice cu astmul [1].
Eozinofilele sunt de obicei prezente pe tot tractul gastro-intestinal, deoarece sunt expuse continuu la alimente, alergeni de mediu, toxine și agenți patogeni. Interesant este faptul că la persoanele sănătoase esofagul este unic prin faptul că eozinofilele sunt în general absente. Cu toate acestea, în EoE, eozinofilele se infiltrează în esofag, contribuind la deteriorarea țesuturilor și la inflamația cronică. EoE este definită ca o tulburare clinicopatologică caracterizată prin> 15 eozinofile pe câmp de putere mare [HPF] la unul sau mai multe specimene de biopsie esofagiană și absența bolii de reflux gastrointestinal patologic (GERD) (după cum se dovedește printr-un studiu normal de monitorizare a pH-ului sau lipsa răspunsului la o terapie adecvată de supresie a acidului) [2].
Numărul tot mai mare de cazuri recunoscute de EoE a dus la o extindere dramatică a literaturii medicale din jurul bolii. Acest articol oferă o prezentare practică a literaturii recente referitoare la epidemiologie, fiziopatologie, diagnostic, tratament și prognostic al EoE.
Epidemiologie
Având în vedere slaba conștientizare și recunoaștere a bolii în trecut, epidemiologia EoE este încă neclară. La copii/adolescenți cu vârsta de până la 19 ani, estimările actuale ale prevalenței variază de la 1 la 4 la 10.000 de persoane [3]. Literatura recentă sugerează că prevalența EoE este în creștere [4]. Cu toate acestea, există dezbateri dacă noile cazuri de EoE diagnosticate reprezintă o creștere reală a prevalenței sau, mai degrabă, o recunoaștere crescută a bolii latente. Mai mult, biopsiile endoscopice esofagiene sunt necesare în prezent pentru a stabili diagnosticul EoE și, prin urmare, variațiile practicilor de endoscopie pot influența rezultatele studiilor epidemiologice. De exemplu, unele studii sugerează că atunci când se corectează numărul de endoscopii/biopsii efectuate, creșterea percepută a prevalenței EoE poate să nu fie atât de dramatică pe cât se postulează inițial [5].
Dovezile sugerează, de asemenea, că există atât variații etnice, cât și de gen în prevalența EoE, majoritatea cazurilor raportate la bărbații caucazieni. Cu toate acestea, această constatare este, de asemenea, incertă, deoarece aceasta este populația de pacienți care a fost studiată cel mai mult [6, 7]. Sunt necesare studii epidemiologice suplimentare pe bază de populație pentru a investiga adevărata prevalență a EoE, în special la populația adultă.
Fiziopatologie
Deși patogeneza EoE rămâne neclară, dovezile sugerează că boala este asociată cu răspunsuri imune de tip celulă ajutătoare T (Th) -2, care sunt tipice altor afecțiuni atopice. În special, nivelurile crescute ale citokinelor Th2 interleukină (IL) -4, IL-5 și IL-13, precum și celulele mastocitare, au fost găsite în esofagul pacienților cu EoE [8-10]. Aceste citokine par să joace un rol important în activarea și recrutarea eozinofilelor în esofag. Mai mult, există dovezi care sugerează o predispoziție genetică pentru boală, deoarece gena pentru eotaxină-3 - o chemokină implicată în promovarea acumulării și aderenței eozinofilelor - s-a dovedit a fi supraexprimată la pacienții cu EoE [9].
Se crede, de asemenea, că EoE este un răspuns alergic mediat la imunoglobulină (Ig) E și non-IgE la alergeni alimentari și de mediu [11, 12]. Reacțiile mediate de IgE sunt răspunsuri imediate de hipersensibilitate care apar de obicei în câteva minute după expunerea la un alergen. Tulburările alergice non-mediate de IgE sunt caracterizate printr-un debut întârziat (ore sau zile după expunerea la antigen) și simptome potențial mai cronice. Majoritatea pacienților cu EoE s-au dovedit a avea teste pozitive de înțepare a pielii (care detectează reacții mediate de IgE) și teste de patch-uri de atopie (care pot identifica reacții care nu sunt mediate de IgE) la alimente și/sau aeroalergeni. Cu toate acestea, rămâne neclar dacă sensibilizarea (testarea pozitivă) la acești alergeni stabilește sau nu un rol cauzal în EoE.
Diagnostic și investigații
Deoarece examinarea fizică a pacienților cu EoE este adesea nerealizabilă, diagnosticul EoE depinde de manifestările clinice ale pacientului, de evaluarea endoscopică a esofagului și de constatările histologice ale biopsiilor mucoasei esofagiene.
Manifestari clinice
Deși debutul tipic al EoE este în copilărie, boala poate fi găsită la toate grupele de vârstă și simptomele tind să varieze în funcție de vârsta de prezentare [13]. Manifestările clinice la sugari și copii mici includ, în general, vărsături, refuzul alimentelor, sufocarea la mese și, mai puțin frecvent, eșecul de a prospera. Simptomele predominante la copiii și adolescenții de vârstă școlară includ disfagie (dificultăți la înghițire), impacturi alimentare și sufocare/bâlbâială la mese, în special atunci când sunt alcătuite din alimente cu texturi grosiere. Alte simptome la această populație de pacienți includ dureri abdominale/toracice, vărsături și insuficiență. O istorie atentă la copii și adolescenți cu EoE relevă faptul că au învățat să compenseze aceste simptome mâncând încet, mestecând excesiv sau luând mușcături mici, consumând excesiv la mese, lubrifiant mesele în mod excesiv cu sosuri și evitând consistențe alimentare specifice, cum ar fi carnea sau alte alimente cu texturi grosiere) [14, 15].
Simptomul predominant la adulți este disfagia; cu toate acestea, arsurile la stomac și evitarea alimentelor pot fi de asemenea prezente. Datorită inflamației de lungă durată și a posibilelor cicatrici care nu au fost recunoscute, adulții care prezintă EoE au tendința de a avea mai multe impacturi alimentare esofagiene, precum și alte anomalii esofagiene, cum ar fi inelul Schatzki (un inel îngust de țesut situat chiar deasupra joncțiunii esofag și stomac), pânze esofagiene (creșteri mici și subțiri ale țesutului care blochează parțial esofagul) și, în unele cazuri, acalazie (o tulburare de motilitate esofagiană caracterizată prin dificultăți la înghițire și regurgitare). Cu toate acestea, este important să rețineți că unii pacienți cu EoE sunt asimptomatici, iar suspiciunea bolii se bazează pe constatări accidentale la endoscopie care se efectuează pentru alte indicații sau pe dovezi ale impactului alimentar în absența altor simptome.
Deși multe dintre aceste simptome se suprapun cu refluxul gastroesofagian, majoritatea pacienților cu EoE prezintă un răspuns slab la terapia de supresie a acidului (de exemplu, inhibitori ai pompei de protoni [IPP]) și până la 75% au un istoric personal sau familial de boală atopică (de exemplu, astm, eczeme, rinită) și alergii la mediu și/sau la alimente [13]. Tabelul 1 oferă un scurt rezumat al manifestărilor clinice ale EoE.
Endoscopie
Pentru a ajuta la excluderea GERD, se recomandă un studiu empiric de 6 până la 8 săptămâni de terapie cu doze mari de supresie a acidului înainte de efectuarea endoscopiei la pacienții cu suspiciune de EoE. De asemenea, trebuie luată în considerare o rândunică de bariu pentru a exclude esofagul sever de calibru mic.
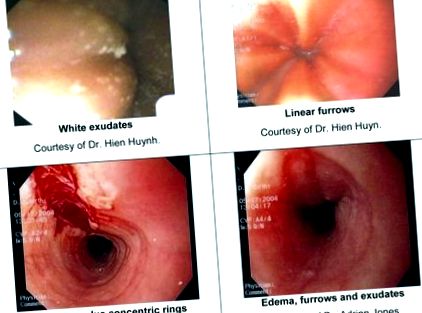
Deși examinarea endoscopică nu poate fi remarcabilă, caracteristicile endoscopice ale EoE au fost bine caracterizate și includ: brazdare liniară (creste sau brazde în peretele esofagian), inele concentrice, exudate albe cu pete (abcese eozinofile), inel Schatzki, esofag de calibru mic, și rupturi liniare de mucoasă superficială care apar după introducerea endoscopului [13]. Tabelul 2 oferă o descriere mai detaliată a fiecăreia dintre aceste caracteristici. Imaginile exsudatelor, brazdelor liniare și lacrimilor sunt furnizate în Figura 1.
Imagini ale caracteristicilor endoscopice ale EoE. A. Exsudații albi Amabilitatea Dr. Hien Huynh. B. brazde liniare Amabilitatea Dr. Hien Huyn. C. Lacrimă liniară plus inele concentrice Amabilitatea Dr. Adrian Jones. D. Edem, brazde și exudate Amabilitatea Dr. Adrian Jones.
Deși descoperirile endoscopice sunt utile în identificarea pacienților cu EoE [16], acestea nu sunt diagnostice ale bolii. În plus, este important să se excludă candidoză esofagiană atunci când sunt identificate exsudatele albe. Ca atare, toți pacienții cu suspiciune de EoE trebuie să fie supuși biopsiilor esofagiene ale mucoasei pentru a confirma diagnosticul.
Biopsii ale mucoasei esofagiene
În prezent, biopsia mucoasă endoscopică rămâne cel mai important test de diagnostic pentru EoE. Eșantioanele de biopsie trebuie obținute indiferent de aspectul gros al mucoasei, iar eșantioanele trebuie obținute atât din esofagul proximal și distal, cât și din zonele care dezvăluie anomalii endoscopice [2]. Pentru a obține o sensibilitate ridicată pentru detectarea EoE sunt necesare cel puțin patru biopsii (în general se recomandă 5-6 biopsii) [13].
După cum sa discutat mai devreme, un diagnostic definitiv al EoE se bazează pe prezența a cel puțin 15 eozinofile/HPF în biopsiile esofagiene ale pacienților care au studii de pH normale sau sunt refractare la terapia de supresie a acidului (adică pentru a exclude GERD). GERD poate crește infiltrarea eozinofilă în esofagul distal, cu toate acestea, eozinofilele asociate cu GERD apar în general la o densitate mai mică (adică.,
Tratament
Strategiile de tratament disponibile pentru EoE se încadrează în trei categorii: (1) evitarea factorilor declanșatori prin modificarea dietei, (2) terapia farmacologică (corticosteroizi, modificatori de leucotriene și biologici) și (3) dilatarea mecanică a esofagului. Este important de reținut, totuși, că majoritatea studiilor publicate care examinează aceste terapii sunt serii de cazuri și a existat o testare limitată a acestor regimuri în studiile controlate randomizate.
Managementul dietei
Trei abordări dietetice pentru gestionarea EoE au apărut în ultimul deceniu: (1) dieta elementară, (2) restricții empirice dietetice (denumită și dieta empirică de eliminare cu șase alimente) și (3) restricții dietetice vizate. Dieta elementară implică eliminarea tuturor surselor de proteine potențial alergenice din dieta pacientului prin utilizarea unei formule pe bază de aminoacizi pentru sprijin nutrițional. Presupunând că există un răspuns clinic și histologic favorabil, un nou aliment pe săptămână este reintrodus în mod secvențial, începând cu cele mai puțin alergenice alimente (fructe și legume) la cele mai puternic alergenice (de exemplu, lactate, soia, ou, grâu și arahide). O evaluare endoscopică repetată se efectuează după reintroducerea fiecărui 3-5 alimente pentru a se asigura că inflamația nu a recidivat.
Deși dieta elementară este asociată cu rate ridicate de îmbunătățire clinică și histologică atât la adulți, cât și la copiii cu EoE (adică, 90%), simptomele se repetă adesea după normalizarea dietei pacientului [12, 18]. Mai mult, având în vedere gustul neplăcut al formulei, majoritatea pacienților necesită hrănire prin sonda nazogastrică, ceea ce poate duce la probleme de aderență și la calitatea vieții afectată, în special la adolescenți și adulți.
Restricțiile dietetice vizate și empirice sunt adesea folosite înainte de a lua în considerare o dietă elementară. Restricțiile dietetice vizate implică eliminarea alimentelor pe baza rezultatelor testării înțepăturilor pielii și a patch-urilor atopice. Deși ratele de răspuns observate cu această abordare sunt mai mici decât cele observate în dieta elementară, restricțiile dietetice vizate s-au dovedit a fi eficiente la aproximativ 70-80% dintre pacienți și pot duce la o mai bună aderență a pacientului [12]. Cu toate acestea, rezultatele pozitive clinic irelevante și rezultatele false negative complică această abordare dietetică și, prin urmare, sunt necesare studii suplimentare care examinează atât valoarea predictivă pozitivă, cât și cea negativă a restricțiilor dietetice vizate în EoE.
Mai degrabă decât bazarea eliminării dietetice pe testarea înțepăturilor pielii și testarea patch-urilor atopice, restricțiile dietetice empirice implică eliminarea celor șase cele mai frecvente alimente alergice (indiferent de rezultatele testelor alergice): lactate, ouă, grâu, soia, arahide și pește/crustacee. La fel ca restricțiile dietetice vizate, dieta empirică de eliminare a alimentelor sa dovedit a fi eficientă la aproximativ 75% dintre pacienții cu EoE și poate fi, de asemenea, asociată cu o mai bună aderență a pacienților decât dieta elementară [19].
Cu toate abordările dietetice, rămâne neclar cât timp trebuie evitate anumite alimente și dacă dieta pacientului poate fi sau nu normalizată în timp. În mod clar, sunt necesare mai multe studii cu privire la această abordare, inclusiv o încercare de a evalua calitatea vieții pacientului, având în vedere restricțiile dietetice extinse necesare adesea, inclusiv o mulțime de alimente „de bază”. Mai mult, dacă mai multe alimente vor fi eliminate simultan, solicitarea asistenței unui dietetician poate fi benefică, în special în populația pediatrică. Acest lucru poate contribui la asigurarea continuării îndeplinirii cerințelor nutriționale pentru a facilita creșterea și dezvoltarea adecvată.
Managementul farmacologic
Terapiile medicale pentru EoE includ corticosteroizi, modificatori de leucotriene și agenți biologici. Corticosteroizii sistemici (orali) au fost una dintre primele opțiuni de tratament care s-au dovedit eficiente la pacienții cu EoE. Ameliorarea clinică și histologică a fost observată la aproximativ 95% dintre pacienții cu EoE care utilizează corticosteroizi sistemici; cu toate acestea, la întreruperea tratamentului, 90% dintre pacienți prezintă o reapariție a simptomelor [20]. Mai mult, având în vedere că utilizarea prelungită a corticosteroizilor sistemici este asociată cu efecte adverse bine cunoscute și potențial grave, nu se recomandă utilizarea lor pe termen lung. Corticosteroizii sistemici trebuie rezervați pentru cazuri emergente, cum ar fi pacienții cu disfagie care necesită spitalizare sau pacienții care suferă o pierdere semnificativă în greutate sau deshidratare din cauza dificultăților de înghițire [2].
Având în vedere profilul lor de siguranță substanțial mai bun, corticosteroizii topici eliberați la esofag au devenit pilonul principal al farmacoterapiei pentru pacienții cu EoE. S-a dovedit că atât propionatul de fluticazonă înghițit (500-1000 μg/zi), cât și budesonida vâscoasă (groasă) orală (500-1000 μg/zi) sunt eficiente în gestionarea EoE. Propionatul de fluticazonă este administrat printr-un inhalator de doză măsurată sub presiune (pMDI) care este activat în gură (fără inhalare și fără un dispozitiv distanțier) și înghițit. Budesonida se administrează pe cale orală după ce conținutul unui flacon utilizat pentru nebulizare este amestecat cu un îndulcitor artificial pentru a crește vâscozitatea (grosimea) soluției care, teoretic, încetinește tranzitul acesteia peste căptușeala esofagiană [13].
Studiile clinice randomizate ale terapiei topice cu propionat de fluticazonă au arătat atât îmbunătățiri histologice, cât și simptomatice la 50-80% dintre pacienții cu EoE [21, 22]. Cele mai frecvente complicații observate cu propionat de fluticazonă topică sunt candidozele orofaringiene și esofagiene superficiale. Deși nu este la fel de bine studiată ca propionatul de fluticazonă topică, budesonida vâscoasă orală pare să conducă la rate de răspuns clinice și histologice similare la pacienții pediatrici cu EoE [23, 24]. Budesonida orală a fost asociată cu un risc mai mic de a dezvolta candidoză esofagiană și, având în vedere vâscozitatea soluției, poate oferi o livrare mai bună la suprafața esofagiană decât fluticazonă înghițită. Cu toate acestea, budesonida are o biodisponibilitate sistemică puțin mai mare decât propionatul de fluticazonă orală și, prin urmare, poate fi asociată cu efecte mai sistemice.
Pacienții care utilizează corticosteroizi topici pentru EoE trebuie sfătuiți să nu mănânce, să bea sau să nu se clătească gura timp de 20 până la 30 de minute după utilizarea medicamentului [13]. După 6-8 săptămâni de terapie topică, pacienții trebuie să fie supuși unei evaluări endoscopice repetate pentru a asigura răspunsul histologic la terapie. Dacă se confirmă un răspuns terapeutic, tratamentul trebuie redus la cea mai mică doză eficientă, cu urmărire adecvată. Este important de reținut că simptomele și modificările patologice se repetă adesea după întreruperea tratamentului cu corticosteroizi topici. Prin urmare, mulți pacienți cu EoE vor necesita tratament pe termen lung.
Deoarece mediatorii inflamatori, cum ar fi leucotrienii, au fost teorizați pentru a juca un rol în inflamația esofagiană observată la pacienții cu EoE, modificatorii leucotrienelor pot fi de valoare pentru gestionarea EoE [2]. Un mic studiu efectuat pe 8 pacienți cu EoE a examinat eficacitatea antagonistului receptorului leucotriene, montelukast, și a constatat o îmbunătățire semnificativă a simptomelor la majoritatea subiecților, dar nici o îmbunătățire a histologiei [25]. Având în vedere că montelukastul este în general bine tolerat și potențial util pentru gestionarea altor boli atopice, cum ar fi astmul, poate fi o opțiune terapeutică de luat în considerare la pacienții cu EoE și afecțiuni atopice concomitente.
Având în vedere că atât IL-5, cât și IgE par să joace un rol în patogeneza EoE, anticorpii monoclonali umanizați împotriva IL-5 (reslizumab, mepolizumab) și IgE (omalizumab) pot fi, de asemenea, opțiuni terapeutice potențiale pentru boală. Rezultatele dintr-o serie mică de cazuri care utilizează anticorpi anti-IL-5 la pacienții cu EoE sugerează că aceste substanțe biologice sunt bine tolerate și pot îmbunătăți simptomele clinice, histologia și calitatea vieții [26]. Două mari studii pediatrice sunt în curs de desfășurare pentru a examina în continuare eficacitatea și siguranța anticorpilor anti-IL-5 în gestionarea EoE.
Anticorpul anti-IgE omalizumab este utilizat pentru gestionarea astmului atopic sever și a rinitei alergice. Deoarece s-a demonstrat că omalizumab scade numărul de eozinofile din sânge și plămâni la subiecții astmatici [27], poate fi o abordare terapeutică potențială pentru EoE. Deși nu au fost efectuate studii clinice cu omalizumab la pacienții cu EoE, rapoartele anecdotice sugerează că aceasta poate fi o opțiune de tratament promițătoare.
Dilatarea endoscopică
Dilatarea endoscopică esofagiană este o modalitate de tratament utilizată cel mai frecvent la adulții cu stricturi esofagiene stabilite. Deși dilatarea este eficientă pentru ameliorarea disfagiei, nu abordează inflamația subiacentă și, prin urmare, majoritatea pacienților supuși acestei proceduri dezvoltă simptome recurente în termen de 3-8 luni [4, 28-30]. Mai mult, la pacienții cu EoE, dilatarea endoscopică a fost asociată cu ruptură și perforare extinsă a mucoasei. Prin urmare, dilatarea este în general rezervată pacienților cu stricturi simptomatice care persistă după un studiu de terapie farmacologică sau dietetică [2, 7, 13].
Un algoritm propus pentru diagnosticarea și gestionarea EoE este prezentat în Figura 2.
Algoritm propus pentru diagnosticarea și gestionarea EoE. EoE: esofagită eozinofilă; PPI: inhibitor al pompei de protoni; GERD: boala de reflux gastro-intestinal; HPF: câmp de putere mare; IgE: imunoglobulină E; IL5: interleukină 5
- Efectul unui supliment alimentar medical la pacienții spitalizați care se recuperează după operație - Text integral
- Eficacitatea educației pentru diabetul zaharat de tip 1 pe terapia cu pompă de insulină - Vizualizare text complet
- Text integral Un studiu epidemiologic asupra prolapsului simptomatic al organelor pelvine la C DMSO obez
- Efectul obezității asupra inflamației căilor respiratorii induse de ozon - Vizualizare text complet
- Transplant de microbiote fecale pentru tratamentul obezității - Vizualizare text complet