Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Institutul de Microbiologie, Heinrich-Heine-Universität, Universitätsstr. 1, Geb. 26.12.01, D-40225 Düsseldorf, Germania
Abstract
Familia transportoare de hexoză a Saccharomyces cerevisiae cuprinde 18 proteine (Hxt1-17, Gal2). Aici, demonstrăm că toate aceste proteine, cu excepția Hxt12, și în plus trei membri ai familiei de transportoare de maltoză (Agt1, Ydl247, Yjr160) sunt capabili să transporte hexoze. Într-o tulpină de drojdie ștearsă pentru HXT1–17, GAL2, AGT1, YDL247w și YJR160c, consumul de glucoză și activitatea de transport au fost complet desființate. Cu toate acestea, ca o ștergere suplimentară a genei senzorului de glucoză SNF3 creșterea parțial restabilită pe hexoze, datele noastre indică existența a și mai multe proteine capabile să transporte hexoze în drojdie.
1. Introducere
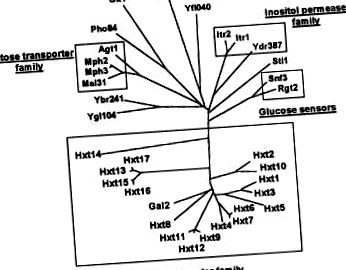
Sursele de carbon preferate pentru majoritatea celulelor procariote și eucariote sunt glucidele, mai presus de toate glucozele monozaharidice. Această biomoleculă alcătuiește cea mai mare parte a materiei organice de pe pământ. Un pas obligatoriu și esențial în utilizarea glucozei este transportul acesteia prin membrana plasmatică în celule, un proces care este realizat de proteinele transportoare. Diferite mecanisme au evoluat în diferite organisme care mediază transportul glucozei, adică sisteme de simport de protoni, cotransportori de Na + -glucoză, sisteme dependente de proteine de legare, sisteme de fosfotransferază și sisteme de difuzare facilitate [1-3]. Unul dintre cele mai proeminente organisme care utilizează glucoza este drojdia Saccharomyces cerevisiae. Familia de permeaze de zahăr de drojdie este formată din 34 de proteine, dintre care 18 cuprind subfamilia transportor de hexoză [4-6] (Fig. 1). Deoarece transportul peste membrana plasmatică este un pas important în controlul ratei metabolismului glucozei, elucidarea funcțiilor acestei multitudini de proteine legate de transportorul de glucoză este o întrebare fundamental importantă. Mai mult, ar putea oferi informații despre principiile generale ale transportului glucozei și în alte organisme.
2. Materiale și metode
2.1 Tulpini de drojdie și condiții de creștere
Tulpinile de drojdie au fost descrise în Tabelul 1. Mediul și condițiile de creștere au fost cele descrise în [7]. Proprietățile de creștere au fost determinate pe mediu sintetic (sursă de carbon YNB + (NH4) 2SO4 +) suplimentată numai pentru cerințele auxotrofice.
| Încordare | Genotip | Sursă |
| CEN.PK2‐1C (= VW1A) | MATα leu2‐3,112 ura3‐52 trp1‐289 his3 - Δ1 MAL2‐8 c SUC2 hxt17Δ | K.-D. Entian |
| EBY.VW367 + | CEN.PK2‐1C hxt13Δ: loxP hxt15Δ: loxP hxt16Δ: loxP hxt14Δ: loxP hxt12Δ: loxP hxt9Δ: loxP hxt11Δ: loxP hxt10Δ: loxP hxt8Δ: loxP hxt514Δ: loxP hxt2Δ: loxP | Acest studiu |
| EBY.VW1000 | EBY.VW367 + hxt367Δ: loxP gal2Δ | Acest studiu |
| EBY.VW2000 | EBY.VW1000 snf3Δ: loxP | Acest studiu |
| EBY.VW4000 | EBY.VW1000 stl1Δ: loxP agt1Δ: loxP ydl247wΔ: loxP yjr160cΔ: loxP | Acest studiu |
| EBY.VW5000 | EBY.VW4000 snf3Δ: loxP rgt2Δ: loxP | Acest studiu |
| EBY.FY100B | MATα ura3‐52 trp1Δ63 his3Δ200 (derivat din FY1679) | Acest studiu |
| EBY.FY367 + | EBY.FY100B hxt13Δ: loxP hxt15Δ: loxP hxt16Δ: loxP hxt17Δ: loxP hxt14Δ: loxP hxt12Δ: loxP hxt9Δ: loxP hxt11Δ: loxP hxt10Δ: loxP hxt8Δ: loxP hxt514Δ: loxP hxt2Δ: lox | Acest studiu |
2.2 Construcția mai multor mutanți de deleție
| Xthxt13/Δhxt17 | 5′‐ CGCACCACCCGTGGAAAAAGAGTGGTCAGATGGATTTGATGACAA CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ TTGAGAACTTCAAAAATTTCTTCCAATCCTTCTTCTCGGTCTTAC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt15/Δhxt16 | 5′‐ ATGGCAAGCGAACAGTCCTCACCAGAAATTAATGCAGATAATCTAA CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ AGCATGTTTATCAAGCGCGCATATTGATCAATTAAAACTCTTTGGGAA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt14 | 5′‐ GGCAGGGGAAGGGATTATAATGTAACCATTAAGTATCTAGATGAT CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ TCCTAGTTTGAAATCAATTTTGGATACAATCATTGGTGTTAAAAG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt12 | 5′‐ ATCTTTGGTTGGGATACCGGTACCATTTCTGGTTTTGTTAACCTTTC CAGCTGAAGCTTCGTACGC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt11 | 5′‐ ATGTCAGGTGTTAATAATACATCCGCAAATGAGTTATCTACTACCATG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt10 | 5′‐ ATGGTTAGTTCAAGTGTTTCCATTTTGGGGACTAGCGCCAAGGCATCC TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ AATTATTTACTATCAACAATAACTAATGGTGTACTGCTTGTTGGTTGTGG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt9 | 5′‐ GTAGCAAATGCACCATCTGTAAAAACTGAGCATAATGACTCTAAAAAC TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGACAAAGAAAAAGACATAAAAGTATGCAAAAACCAGACAGCCTAAGA GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt8 | 5′‐ ATGACTGATCGTAAAACCAACTTGCCAGAAGAACCGATTTTCGAAGAG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGTCTAAAACATTCTTTTGTAGAAGGGTTTCTCGTCATGCTGTAATTT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt5 - hxt1 - hxt4 | 5′‐ ATGTCGGAACTTGAAAACGCTCATCAAGGCCCCTTGGAAGGGTCTGCTACT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TTAGATCATCAGCGTTGTAGTCAGTACCTCTCTTGTTTGGTGGAACCAAG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Xthxt2 | 5′‐ ATGTCTGAATTCGCTACTAGCCGCGTTGAAAGTGGCTCTCAACAAACT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TATTCCTCGGAAACTCTTTTTTCTTTTGGATCCAGCTACCAGAT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δhxt3 - hxt6 - hxt7 | 5′‐ ATGAATTCAACTCCAGATTTAATATCTCCACAAAAGTCAAGTGAGAATTCG TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ AAGTTTCTTTGTCTCCGTCCCACTCAACTTTCTGAGAACAAATGATC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δstl1 | 5′‐ ATGAAGGATTTAAAATTATCGAATTTCAAAGGCAAATTTATAAGCAGA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ ACCCTCAAAATTTGCTTTATCGTTCACTGTATCTTCATTTTTGATGTT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δagt1/Δagt1: lacZ | 5′‐ ATGAAAAATATCATTTCATTGGTAAGCAAGAAGAAGGCTGCCTCAAAA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TAATTCTCGCTGTTTTATGCTTGAGGACTGACTGATACTCTCATCAGC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δydl247w/Δyjr160c | 5′‐ ATGAAAAACTTATCTTTTCTCATAAACAGAAGAAAGGAAAATACAAGT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TTCCTCTGCAATGGAAGCTTCGATATCTCCCTTGGGGTCGTTATG GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Δsnf3 | 5′‐ ATGGATCCTAATAGTAACAGTTCTAGCGAAACATTACGCCAAGAGAAA TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ TATTTCAAATCATTATTTTCATTTACAGGTTGATTAGTGGCGTTTTC GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| 2rgt2 | 5′‐ ATGAACGATAGCCAAAACTGCCTACGACAGAGGGAAGAAAATAGTCAT TTCGTACGCTGCAGGTCGAC ‐3 ′ |
| 5′‐ GGGGGAAGTGTATTGGCTGTGCTTACTAGCGAGGTCACTCGTCCAATT GCATAGGCCACTAGTGGATCTG ‐3 ′ | |
| Omologie pentru genele transportoare de zahăr, îndrăznețe; omologie la kanMX casetă, italic. | |
2.3 Construcția plasmidelor de supraexprimare a transportorului de zahăr
2.4 Alte tehnici de biologie moleculară
Înlocuirea genomică a AGT1 regiuni de codificare printr-un PCR - amplificat lacZ - kanMX caseta reporter a fost utilizată pentru a contopi promotorul și primele 48 de nucleotide ale trunchiatului AGT1 ORF către E. coli lacZ gene [12]. Pentru amplificarea PCR a lacZ - kanMX au fost utilizate caseta reporter, plasmida pUG6lacZ [12] și primerii enumerați în tabelul 2. ADN-ul și ARN-ul au fost preparate și manipulate conform procedurilor publicate [13, 14] .
2.5 Analize de absorbție a zahărului și studii de fermentare
Testele de absorbție a zahărului și studiile de fermentare au fost cele descrise [15]. Studiile de fermentare s-au făcut în tampon fosfat de potasiu 50 mM, pH 6,3, suplimentat cu glucoză 1%. Transportul glucozei a fost măsurat ca absorbție a glucozei D - [U‐ 14 C] (Amersham). Activitatea de absorbție a glucozei în tip sălbatic și în hxt celulele mutante au fost determinate la concentrații de glucoză de 10 sau 50 mM timp de 15 sau 60 s.
3. Rezultate
3.1 Ștergerea tuturor genelor transportoare de hexoză
Pe măsură ce secvența genomului drojdiei era completă, în total 18 gene diferite, HXT1 - HXT17 și GAL2, au fost identificate care codifică proteinele aparținând familiei transportorului de hexoză de drojdie (Fig. 1) [5, 16]. Doar șapte dintre proteinele transportoare de hexoză, Hxt1-4, 6, 7 și Gal2, au fost caracterizate funcțional până acum (revizuite în [16]). Cu toate acestea, nu se știe nimic despre funcțiile reale ale Hxt5 și Hxt8 - Hxt17.
Pentru a diseca funcția familiei complete de transportoare de hexoză a S. cerevisiae, am șters toți cei 18 membri ai familiei din tulpina de drojdie CEN.PK2-1 (Tabelul 1) prin succesiunea de deleții genetice într-un singur pas folosind o loxP - kanMX - loxP marker de rezistență conceput pentru utilizare repetată [8]. În plus, unele ștergeri au fost făcute în tulpina EBY.FY100B derivată din FY1679 [17]. Analiza sudică a arătat că, spre deosebire de tulpina FY1679, tulpina de tip sălbatic CEN.PK2‐1C nu conține HXT17 genă (datele nu sunt prezentate). Genele transportoare de hexoză au fost șterse succesiv începând cu HXT17/16. Ștergerea tuturor genelor din HXT17/16 la HXT8 la care se adauga HXT5, HXT4, HXT2 și HXT1 la tulpinile EBY.FY100B și CEN.PK2‐1C au obținut tulpinile mutante EBY.FY367 + și respectiv EBY.VW367 +. Aceste tulpini, care încă conțineau HXT3, HXT6 și HXT7, nu a prezentat defecte de creștere a mediilor care conțin glucoză, fructoză sau manoză în comparație cu tulpinile corespunzătoare de tip sălbatic (Fig. 2).
3.2 Supraproducerea tuturor transportoarelor de hexoză
S-a demonstrat deja că Hxt1 - Hxt4, Hxt6 și Hxt7 sunt principalii transportatori de hexoză din drojdie și pot transporta glucoză, fructoză și manoză [15, 18]. Să investigheze dacă toate celelalte proteine legate de transportorul de hexoză, dacă sunt prezente în cantități suficiente, au capacitatea intrinsecă de a transporta glucoza sau una dintre celelalte hexoze, fiecare din cealaltă HXT genele au fost supraexprimate din plasmidele multicopie sub controlul celor puternici MET25 promotor în hxt1–17 gal2 tulpina de ștergere. Am constatat că toate proteinele Hxt, dar Hxt12 sunt capabile să transporte cel puțin una dintre diferite hexoze și să permită creșterea hxt1–17 gal2 tulpina de ștergere, deși cu specificități diferite ale substratului (Fig. 3). Nu am reușit să exprimăm funcțional Hxt12, susținând opinia că HXT12 este un pseudogen [4, 5] .
3.3 Clonarea și ștergerea transportorilor suplimentari de glucoză
Pentru a analiza reglarea transcripțională a AGT1 genă, care codifică un transportor general α - glucozidic [19, 20], AGT1 regiunea de codificare în tulpina CEN.PK2‐1C a fost înlocuită cu a lacZ - kanMX casetă reporter. Măsurarea activităților β-galactozidazei a arătat că AGT1 gena este puternic indusă de maltoză (1382 mU/mg proteină), dar reprimată de glucoză (23 mU/mg proteină). Rezultatele indică faptul că Agt1 și probabil și ceilalți omologi ai permeazei maltozei, Mph2 și Mph3, mediază absorbția reziduală de glucoză de către hxt1–17 gal2 tulpina după creșterea anterioară a maltozei, dar devine reprimată de glucoză ducând la încetarea consumului și creșterii glucozei. În acord cu aceste observații, ștergerea tuturor celor trei gene, AGT1, YDL247w/MPH2 și YJR160c/MPH3, în hxt1–17 gal2 tulpina mutantă a abolit complet consumul rezidual de glucoză (Fig. 4).
3.4 Ștergerea suplimentară a genelor senzorului de glucoză
SNF3 și RGT2 codifică senzorii de glucoză care generează un semnal de glucoză ca răspuns la concentrații scăzute și, respectiv, mari de glucoză, ducând în cele din urmă la inducerea transcripțională a mai multor HXT gene (revizuite în [21]). În mod surprinzător, după ștergerea fișierului SNF3 gena, dar nu RGT2 genă, în hxt1–17 gal2 sau hxt1–17 gal2 agt1 mph2 mph3 tulpina mutantă, creșterea celulelor pe glucoză, fructoză, manoză și zaharoză a fost parțial restabilită (Fig. 2). De asemenea hxt1–17 gal2 agt1 mph2 mph3 snf3 rgt2 tulpina de ștergere ar putea crește în continuare pe aceste hexoze. Aceste rezultate indică o funcție de reprimare a Snf3 pe o proteină suplimentară care este capabilă să transporte hexoze. Într-adevăr, am constatat că STL1 gena a devenit dereprimată după ștergerea SNF3 în hxt1–17 tulpina mutantă (datele nu sunt prezentate). Cu toate acestea, ștergerea fișierului STL1 genă în hxt1–17 gal2 agt1 mph2 mph3 snf3 rgt2 tulpina mutantă nu a împiedicat creșterea reziduală a hexozelor (Fig. 2) și nici supraexprimarea sa nu a restabilit creșterea hxt1–17 gal2 tulpina pe hexoze.
4. Discutie
Aici am demonstrat că peste 20 de proteine diferite din drojdie sunt capabile să transporte hexoze. Rezultatele anterioare au arătat că doar ștergerea HXT1-HXT7 în drojdia MC996A tulpina a împiedicat creșterea celulelor mutante pe glucoză, sugerând că cealaltă HXT genele nu sunt exprimate sau nu sunt funcționale [18]. În contrast, un hxt1–7 mutant de ștergere construit în fundalul tulpinii CEN.PK care a fost utilizat în această lucrare a fost încă capabil să crească pe glucoză, deși încet (date nepublicate). Sugerăm că aceste diferențe pot fi atribuite capacității respiratorii mai mari a tulpinii CEN.PK [22]. Rata de respirație mai mare permite în mod evident celulelor CEN.PK să catabolizeze glucoza chiar și la rate de absorbție foarte mici. La fel, ștergerea HXT1–4 și HXT6/7 într-o altă tulpină de laborator [23] nu a eliminat complet transportul glucozei. Inhibarea transportului de electroni mitocondriale/fosforilarea oxidativă a fost necesară pentru a preveni creșterea reziduală a glucozei, sugerând că transportorii minori de glucoză erau încă activi.
- Ar putea genetica să influențeze ceea ce ne place să mâncăm Înțelegerea rolurilor genelor în comportamentele alimentare
- DON T KNOCK ALBINE CARPENTER
- Umflarea condusă de entalpie a filmelor polimerice bloc fotonic Macromolecule
- Curaj necesar pentru WOWW! Factor; Woww Factor Women
- Ouă ușor murate (nu este necesară conservarea) - Cheltuiți cu bănuți