Ralf Siegner
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Stefan Heuser
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Ursula Holtzmann
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Jörn Söhle
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Andreas Schepky
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Thomas Raschke
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Franz Stäb
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Horst Wenck
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Marc Winnefeld
1 Cercetare și dezvoltare, Cercetare specială pentru îngrijirea pielii, Beiersdorf AG, Unnastrasse 48, Bf. 520, 20245 Hamburg, Germania
Abstract
fundal
Mecanismele celulare și moleculare ale biologiei țesutului adipos au fost studiate pe larg în ultimele două decenii. Creșterea țesutului adipos implică atât o creștere a dimensiunii celulelor grase, cât și formarea adipocitelor mature din celulele precursoare. Pentru a investiga modul în care substanțele naturale influențează aceste două procese, am examinat efectele extractului de frunze de lotus (soluție de extract Nelumbo nucifera obținută din Silab, Franța) și a L-carnitinei asupra preadipocitelor și adipocitelor umane.
Metode
Pentru studiile noastre in vitro, am folosit o soluție de extract de frunze de lotus singur sau în combinație cu L-carnitină. Folosind preadipocite umane cultivate, am investigat inhibiția indusă de soluția extractului de frunze de lotus a încorporării trigliceridelor în timpul adipogenezei și a posibilelor efecte asupra viabilității celulare. Au fost efectuate studii asupra adipocitelor umane cu scopul de a elucida eficacitatea soluției de extract de frunze de lotus pentru a stimula activitatea lipolitică. Pentru a caracteriza în continuare efectele mediate de soluție de extract de frunze de lotus, am determinat expresia factorului de transcripție determinarea adipocitului și a factorului de diferențiere 1 (ADD1/SREBP-1c) la nivelul ARN și proteine utilizând analiza qRT-PCR și imunofluorescență. În plus, efectul L-carnitinei asupra beta-oxidării a fost analizat folosind preadipocite umane și adipocite mature. În cele din urmă, am investigat efectele aditive ale unei combinații de soluție de extract de frunze de lotus și L-carnitină asupra acumulării trigliceridelor în timpul diferențierii preadipocite/adipocite.
Rezultate
Datele noastre au arătat că incubația preadipocitelor cu soluție de extract de frunze de lotus a redus semnificativ acumularea de trigliceride în timpul adipogenezei, fără a afecta viabilitatea celulară. Comparativ cu martorii, adipocitele incubate cu soluție de extract de frunze de lotus au prezentat o creștere semnificativă a activității lipolizei. Mai mult, populațiile de celule cultivate în prezența unei soluții de extract de frunze de lotus au arătat o scădere a capacității de diferențiere a adipocitelor, așa cum este indicat de o scădere a semnalului ADD1/SREBP-1c. Important, rezultatele noastre au demonstrat că o combinație de soluție de extract de frunze de lotus și L-carnitină a redus acumularea de trigliceride într-o măsură mai mare în comparație cu incubarea cu oricare dintre substanțe singure.
Concluzii
În general, datele noastre demonstrează că o combinație de extract de frunze de lotus și L-carnitină a redus acumularea de trigliceride în (pre) adipocite umane prin afectarea diferitelor procese din timpul ciclului de viață al adipocitelor. Din acest motiv, această combinație ar putea reprezenta o opțiune de tratament pentru bolile legate de obezitate.
fundal
În toate țările industrializate, prevalența obezității a crescut dramatic în ultimele decenii. Deoarece obezitatea este strâns asociată cu o serie de tulburări, inclusiv diabetul de tip 2, hipertensiunea și ateroscleroza, prevenirea și tratamentul acestei boli sunt de mare interes [1].
Obezitatea apare atunci când aportul de energie al organismului depășește consumul de energie al corpului pentru o perioadă prelungită de timp. Gradul de obezitate este caracterizat de volumul și numărul de adipocite, care este reglementat în așa-numitul ciclu de viață al adipocitelor [2]. Astfel, tratamentele care vizează reglarea mărimii și numărului adipocitelor pot oferi o abordare terapeutică [3,4].
Mai multe extracte de plante și componentele lor bioactive respective sunt bine recunoscute pentru potențialul lor de a exercita efecte anti-obezitate [2]. În acest context, ne-am concentrat pe extractul de frunze de lotus, un extract natural de plante, obținut din frunzele de Nelumbo nucifera. Nelumbo nucifera este, de asemenea, cunoscut sub numele de lotus sacru și toate părțile acestei plante au fost utilizate ca medicamente tradiționale în China și India [5]. Extractul de frunze de lotus conține mai multe componente bioactive, cum ar fi flavonoide [6], glicozide flavonoide [7] și alcaloizi [8]. La șoarecii obezi, s-a raportat că extractul de frunze de lotus a împiedicat creșterea greutății corporale, a inhibat absorbția lipidelor și carbohidraților, a accelerat metabolismul lipidic și a cheltuielilor de energie reglate în sus, sugerând efecte benefice pentru suprimarea obezității [9]. De asemenea, la șoareci, s-a arătat că un extract de etanol 50% preparat din frunzele Nelumbo nucifera a stimulat lipoliza în țesutul adipos alb [6]. Cu toate acestea, din cunoștințele noastre studiile concludente care investighează efectele extractului de frunze de lotus asupra acumulării trigliceridelor sau asupra activității lipolizei în celulele umane lipsesc până acum.
Au fost identificate diverse substanțe fitochimice naturale care influențează ciclul de viață al adipocitelor. Potrivit lui Rayalam și colab. [2] o monoterapie selectivă care vizează prevenirea sau tratarea obezității nu a fost încă stabilită cu succes. Cu toate acestea, utilizarea combinată a mai multor produse naturale, care stimulează diferite mecanisme moleculare și celulare, poate reprezenta o abordare mai promițătoare pentru tratarea obezității. Lipoliza țesutului adipos duce la descompunerea trigliceridelor stocate în celulele adipoase și eliberarea ulterioară a acizilor grași și glicerol. Acești acizi grași eliberați sunt transportați în sistemul circulator și sunt prelucrați de ficat. Componentele unice la întoarcerea în țesutul adipos pot fi convertite înapoi în trigliceride adipocite. Pentru a preveni acest proces, stimularea beta-oxidării și, prin urmare, îndepărtarea acizilor grași (prin crearea de energie) ar putea ajuta la reducerea mai eficientă a depozitelor de grăsimi [10-12].
Pentru a determina în ce măsură extractul de frunze de lotus influențează adipogeneza și induce activitatea lipolizei, am investigat efectele unei soluții de extract de frunze de lotus asupra preadipocitelor și adipocitelor umane. Deoarece L-carnitina funcționează ca un stimulent pentru oxidarea acizilor grași, am determinat în plus posibilitatea efectelor combinate ale extractului de frunze de lotus și L-carnitinei în (pre) adipocite umane.
Metode
Substanțe de testat
Soluție de extract de frunze de lotus
Pentru studiile noastre, a fost utilizat un extract lichid de frunze de Nelumbo nucifera (Pro-Sveltyl OP ®; Lot 621021 și 621031; Silab, Brive, Franța) desemnat ca „soluție de extract de frunze de lotus”. Această soluție de extract lichid este obținută din frunzele Nelumbo nucifera și cuprinde un conținut de substanță uscată de aproximativ 6,4 mg/ml într-o soluție apoasă de butilen glicol 50%. Pentru a controla posibilele efecte induse de soluția de butilen glicol, a fost utilizată ca martor o soluție apoasă de butilen glicol 50% în concentrația respectivă.
L-carnitină
A doua substanță utilizată pentru experimentele noastre a fost L-carnitina (L-Carnipure cristalină; Lot 00002; Lonza, Basel, Elveția). Pentru experimentele de beta-oxidare, L-carnitina a fost dizolvată direct în mediul de cultură celular respectiv. În experimentele de acumulare a grăsimilor, L-carnitina a fost dizolvată în mediu de cultură celulară în prezență de 0,25% butilen glicol. Acest experiment ne-a permis să comparăm efectele induse de L-carnitină cu acțiunile mediate de combinația de L-carnitină și 0,5% soluție de extract de frunze de lotus care a avut o concentrație finală de 0,25% butilen glicol. Controlul respectiv a fost tratat în consecință.
Diferențierea preadipocitelor în adipocite
Determinarea viabilității celulare
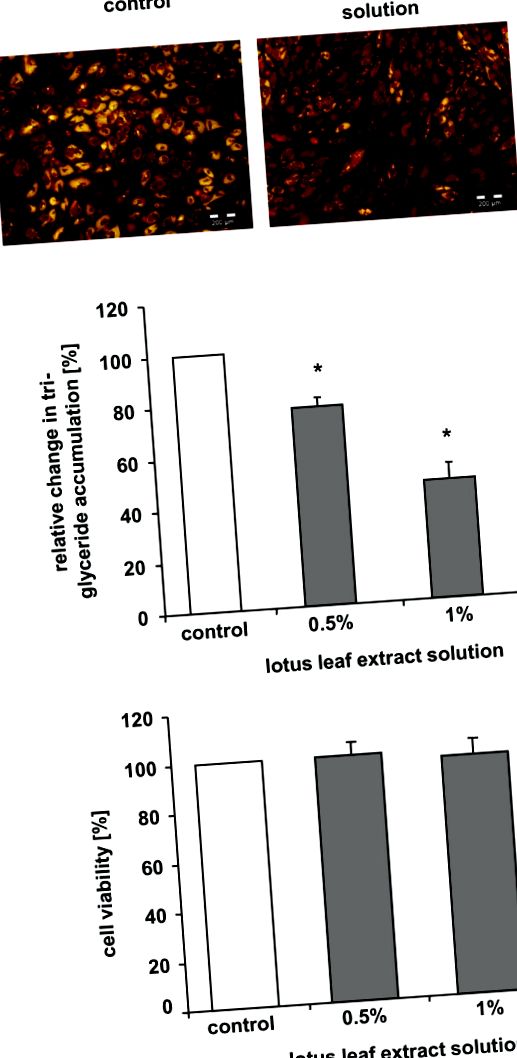
A fost utilizată o analiză de viabilitate care determină activitatea esterazei endogene, așa cum s-a descris anterior [14] pentru a evalua posibilele efecte citotoxice ale soluției de extract de frunze de lotus. Pe scurt, preadipocitele au fost cultivate timp de 7 zile în „mediu de diferențiere” conținând 0,5%, 1% soluție de extract de frunze de lotus sau soluția de control respectivă. Ulterior, celulele au fost spălate cu 1 × soluție salină tamponată cu fosfat Dulbecco (DPBS) (Cambrex, Verviers, Belgia) și incubate timp de 20 de minute în 100 μl diacetat de fluorescenă (FDA; Sigma, Taufkirchen, Germania) soluție (15 μg/ml FDA în 1 × DPBS). S-a determinat apoi fluorescența (excitație la 491 nm/emisie la 517 nm) folosind cititorul de plăci cu 96 de godeuri Safire 1 (Tecan, Crailsheim, Germania).
Determinarea acumulării trigliceridelor
Pentru experimente, preadipocitele au fost cultivate timp de 7 zile în „mediu de diferențiere” suplimentat cu 0,5% sau 1% soluție de extract de frunze de lotus, 0,01% L-carnitină, o combinație de 0,01% L-carnitină și 0,5% soluție de extract de frunze de lotus sau soluții de control.
Acumularea de trigliceride în timpul diferențierii a fost determinată în ziua 7 folosind un test AdipoRed (Cambrex, Verviers, Belgia) conform instrucțiunilor producătorului. Fluorescența a fost detectată (excitație la 485 nm/emisie la 572 nm) și cuantificată într-un cititor de plăci cu 96 de godeuri Safire 1 (Tecan, Crailsheim, Germania).
Pentru analize microscopice suplimentare, celulele au fost incubate cu reactiv AdipoRed timp de 10 minute la temperatura camerei. Probele au fost analizate prin microscopie cu fluorescență folosind un microscop Olympus IX71 (Hamburg, Germania).
Determinarea eliberării glicerinei
Preadipocitele umane subcutanate sau hADSC au fost însămânțate în baloane de cultură celulară (9 × 10 3 celule/cm2) și cultivate în Eagle Medium-F12 modificat de Dulbecco (Gibco/BRL, Eggenstein, Germania) conținând 10% FCS, 0,5% gentamicină (Gibco/BRL, Eggenstein, Germania), 33 μM biotină și 17 μM D-pantotenat (Sigma, Taufkirchen, Germania) la 37 ° C și 5% CO2. După 7 zile, celulele au fost transferate în plăci cu 96 de godeuri (105 celule/godeu). O zi mai târziu, mediul a fost înlocuit cu mediu proaspăt conținând 10% FCS, 0,5% gentamicină, 33 μM biotină, 17 μM D-pantotenat, 66 nM insulină, 1 nM T3, 100 nM hidrocortizol, 0,1 μg/ml apo-Transferrin și 1 μg/ml ciglitazonă (toate obținute de la Sigma, Taufkirchen, Germania). După 3 zile, mediul a fost substituit cu mediu cu aceeași compoziție, dar lipsit de ciglitazonă. Trei zile mai târziu, acest mediu a fost înlocuit cu „mediu de diferențiere” și celulele au fost cultivate timp de încă două săptămâni.
Înainte de incubația cu substanțe de testat, celulele diferențiate au fost cultivate timp de o săptămână în Glucoza Eagle Medium redusă modificată de Dulbecco (Cambrex, Verviers, Belgia) suplimentată cu 1% Fracție albumină bovină V, 100 U/ml penicilină, 100 μg/ml streptomicină și 1 × Glutamax (toate obținute de la Gibco/BRL, Eggenstein, Germania). Acest mediu de cultură este desemnat ca „mediu de întreținere”. Eliberarea de glicerol a fost analizată la 28 de zile după inducerea diferențierii.
Pentru experimente, celulele au fost incubate în 200 μl de „mediu de întreținere” conținând 0,5% sau 1% soluție de extract de frunze de lotus sau soluție martor timp de 24 de ore la 37 ° C și 5% CO2. Reactivul glicerol liber și soluția standard (Sigma, Taufkirchen, Germania, diluție standard: 125-1,95 μg/ml (pași de raport de amestecare 1: 1)) au fost utilizate conform instrucțiunilor producătorului.
Pentru măsurare, s-au obținut 100 pl de supernatant celular din fiecare godeu și s-au amestecat cu 100 pl de reactiv glicerol liber folosind o placă cu 96 de godeuri. După 15 minute de incubație la temperatura camerei în întuneric, absorbția a fost măsurată într-un cititor de plăci Spectra MAX cu 96 de godeuri (Molecular Devices, Union City, CA) la 540 nm.
Cuantificarea expresiei genei ADD1/SREBP-1c
Preadipocitele umane subcutanate au fost cultivate așa cum s-a descris mai sus. Pentru experimente, celulele au fost cultivate timp de 3, 6 și 9 zile în „mediu de diferențiere” cu sau fără soluție de extract de frunze de lotus de 1%. Celulele au fost recoltate în zilele 3, 6 și 9 după inducerea diferențierii și omogenizate în TRIzol® (Invitrogen, Karlsruhe, Germania) urmând protocolul producătorului. După transcriere inversă, probele au fost analizate pentru determinarea adipocitelor și factorul de diferențiere 1 (ADD1/SREBP-1c) prin Real-Time TaqMan ® -PCR folosind sistemul 7900HT Fast-Real-Time PCR System (Applied Biosystems, Darmstadt, Germania).
Primerii etichetați FAM pentru qRT-PCR (Applied Biosystems, Forster City, CA) au fost după cum urmează: Analize TaqMan inventariate pentru controlul intern gliceraldehidă-3-fosfat dehidrogenază (GAPDH; Hs99999905_m1) și pentru ARN-ul țintă ADD1/HREBp11069). TaqMan ® Fast Universal PCR Master Mix (Applied Biosystems, Forster City, CA) a fost utilizat și PCR a fost efectuat conform recomandărilor furnizorului. Datele PCR în timp real au fost analizate utilizând software-ul Detector de secvență versiunea 2.3 furnizat împreună cu sistemul de PCR în timp real 7900HT (Applied Biosystems, Darmstadt, Germania). Cuantificarea a fost realizată folosind metoda 2-2Ct care calculează modificările relative ale expresiei genice a țintei normalizate la o referință endogenă (GAPDH).
Analiza microscopică de imunofluorescență
Pentru analiza imunofluorescenței, populațiile de preadipocite au fost crescute pe lamele de acoperire și incubate în „mediu de diferențiere” cu sau fără soluție de extract de frunze de lotus 1% timp de 9 zile, așa cum este descris mai sus. Apoi, celulele au fost fixate cu soluție de formaldehidă 4% timp de 30 min la temperatura camerei, spălate cu soluție salină tamponată cu fosfat (PBS) și permeabilizate cu 0,2% Triton X-100. După spălarea cu succes cu PBS, celulele fixe au fost pretratate cu PBS conținând 10% ser de măgar timp de 30 de minute. Celulele au fost apoi incubate timp de 1 oră cu anticorpi primari direcționați împotriva ADD1/SREBP-1c (sc 8984; Santa Cruz, Heidelberg, Germania). Capace au fost clătite succesiv de trei ori cu PBS și apoi incubate timp de 1 oră cu un anticorp secundar marcat cu Cy3. Nucleii celulari au fost colorați utilizând Hoechst 33342 (1 μg/ml; Invitrogen, Karlsruhe, Germania). Rezultatele au fost determinate folosind microscopul de fluorescență IX71 în combinație cu celula software ^ F v. 2.4 (Olympus, Hamburg, Germania).
Determinarea beta-oxidării
Pentru determinarea beta-oxidării, preadipocitele umane subcutanate au fost cultivate în conformitate cu instrucțiunile producătorului, așa cum sunt descrise mai sus. Preadipocitele (300.000 celule/vas) au fost însămânțate în cutii Nunclon Petri sterile de 3,3 cm (Nunc, Roskilde, Danemarca) în PGM. A doua zi, beta-oxidarea a fost măsurată așa cum este descris mai jos.
În ceea ce privește populațiile de adipocite, diferențierea a fost indusă prin adăugarea de 10 μg/ml insulină, 1 μM dexametazonă, 200 μM indometacină și 500 μM izobutilmetilxantină (Cambrex, Verviers, Belgia) la mediu. Celulele au fost cultivate timp de 2 săptămâni, având loc o schimbare de mediu după o săptămână de cultură. Înainte de determinarea beta-oxidării, adipocitele au fost incubate timp de 7 zile în „mediu de întreținere”.
analize statistice
S-a ales un nivel de semnificație de 0,05 (alfa) pentru analiza statistică, pe baza testării ipotezelor pe două fețe.
S-a efectuat următoarea analiză:
Verificați distribuția normală prin testul lui Shapiro-Wilk.
Comparație versus control prin măsuri repetate ANOVA cu tratament ca variabilă de clasificare.
Comparație între experimente prin ANCOVA cu tratament ca variabilă de clasificare și control ca covariabilă.
Unde este necesar, comparație pereche post-hoc prin testul Tukey generalizat.
Software utilizat: pachet software SAS pentru Windows V9.1.3.
Rezultate
Soluția de extract de frunze de lotus a scăzut acumularea de trigliceride în timpul adipogenezei
Pentru a investiga efectele soluției de extract de frunze de lotus asupra acumulării de trigliceride în timpul diferențierii preadipocite/adipocite umane, celulele au fost cultivate în „mediu de diferențiere” timp de 7 zile în absența sau prezența soluției de extract de frunze de lotus. După cum se arată în Figura Figura 1A, 1A, majoritatea celulelor martor au prezentat o acumulare de trigliceride în picăturile de lipide. În schimb, majoritatea celulelor incubate cu 1% soluție de extract de frunze de lotus nu au acumulat trigliceride, așa cum este indicat de absența colorării galbene.
Soluția de extract de frunze de lotus a stimulat activitatea lipolizei în adipocite diferențiate
Efectul soluției de extract de frunze de lotus asupra expresiei ADD1/SREBP-1c în timpul adipogenezei. (A) Expresia genei ADD1/SREBP-1c în diferențierea preadipocitelor după incubare cu 1% soluție de extract de frunze de lotus comparativ cu celulele martor stabilite ca 100%. Exprimarea ADD1/SREBP-1c este normalizată la GAPDH. Au fost pregătite trei experimente independente atât pentru control cât și pentru incubare cu soluție de extract de frunze de lotus (n = 3). Rezultatele sunt descrise ca medie ± SD. (B) Populațiile umane de preadipocite au fost cultivate în „mediu de diferențiere” fără (a, c) sau cu (b, d) 1% soluție de extract de frunze de lotus timp de 9 zile. S-a efectuat colorarea prin imunofluorescență a ADD1/SREBP-1c (roșu) și a ADN (Hoechst-33342 (albastru)). a și b: Bară de scară: 200 μm; c și d: Bară de scară: 50 μm.
Pentru a investiga dacă efectele soluției de extract de frunze de lotus asupra expresiei genei ADD1/SREBP-1c se traduc la nivelul proteinei, am incubat celule cu soluție de extract de frunze de lotus 1% și am determinat expresia ADD1/SREBP-1c folosind analiza imunofluorescenței. În acord cu constatările noastre anterioare, celulele incubate cu soluție de extract de frunze de lotus (Figura 3B b și 3B d) au afișat doar un semnal slab ADD1/SREBP-1c comparativ cu celulele de control (Figura 3B a și 3B c). În special, numărul de nuclee, colorat cu Hoechst 33342, a fost comparabil în toate zonele investigate.
Pe scurt, rezultatele au indicat faptul că soluția de extract de frunze de lotus afectează adipogeneza.
- Rețetă de înveliș de corp cu alge de acasă Viața noastră de zi cu zi
- În viața tulburată a moștenitoarei Versace, Allegra Beck, care s-a luptat cu un debilitant
- Interior; Supranatural; bătrânul Jared Padalecki; viața înainte de arestare
- Rețetă cu microunde Omletă de 2 minute Blogul Nutrisystem Leaf
- Pierderea în greutate și schimbarea vieții ei