Galactoza (Gal) este metabolizată în glucoză-1-fosfat prin calea Leloir pentru glicoliză, această cale menține bazinele de zaharuri UDP pentru biosinteza glicoconjugaților.
Termeni asociați:
- Lactoză
- Glucoză
- Glucidele
- Enzime
- Proteine
- Polizaharide
- Gluconați
- Arabinoza
- Mannose
- Zaharoza
Descărcați în format PDF
Despre această pagină
GALACTOZĂ
Apariție
Galactoza este o monozaharidă și are aceeași formulă chimică ca și glucoza, adică C 6H12O6. Este similar cu glucoza în structura sa, diferind doar în poziția unei grupări hidroxil. Cu toate acestea, această diferență conferă galactozei proprietăți chimice și biochimice diferite glucozei.
Principala sursă alimentară de galactoză este lactoza, o dizaharidă formată dintr-o moleculă de glucoză plus una din galactoză. Lactoza se găsește numai în lapte; după înțărcare, cantități semnificative de lactoză alimentară se găsesc numai în produsele lactate (Tabelul 1). Nivelurile de lactoză sunt mai mici decât se aștepta în unele produse lactate, unde a fost utilizat de către microbii implicați în procesarea alimentelor.
Tabelul 1. Conținutul de lactoză din lapte și produse lactate
| Laptele vacii | 4.7 |
| Laptele caprei | 4.6 |
| Laptele uman | 7.2 |
| Unt | Urmă |
| Cremă | 2.0–3.2 |
| Brânză (majoritatea tipurilor) | Urmă |
| Brânză de vacă | 1.4 |
| Iaurt | 3.2–4.8 |
Din Paul AA și Southgate DAT (1978) The Composition of Foods de McCance și Widdowson, ed. A 4-a. Londra: Biroul de papetărie al Majestății Sale.
Lactoza, un produs secundar al industriei lactate, poate fi hidrolizată pentru a produce sirop de hidrolizat de lactoză, care conține lactoză, galactoză și glucoză. Acest sirop este folosit ca îndulcitor în biscuiți, cofetărie și unele deserturi lactate. Astfel, cantități mici de lactoză și galactoză pot apărea în alimentele care nu sunt lactate. (A se vedea lactoza.)
În afară de prezența sa în siropul de hidrolizat de lactoză, galactoza monozaharidică se găsește rar în dietă, deși a fost identificată ca o componentă a urmelor unor semințe și legume.
Nutriție și sănătate: Galactozemie
Introducere
Galactoza este un nutrient care furnizează energie și, de asemenea, un substrat de bază necesar pentru biosinteza multor macromolecule din organism. Galactoza este un constituent important al polizaharidelor complexe, care fac parte din glicoconjugații celulari, elemente cheie ale factorilor determinanți imunologici, hormoni, structuri ale membranei celulare, lectine endogene și numeroase alte glicoproteine. În plus, galactoza este încorporată în galactolipide, care sunt elemente structurale importante ale sistemului nervos central.
Căile metabolice pentru galactoză sunt importante nu numai pentru furnizarea acestor macromolecule, ci și pentru a preveni acumularea de metaboliți de galactoză și galactoză. Problemele cu metabolismul galactozei care duc la galactozemie pot provoca o varietate de manifestări clinice la om.
Tulburări ale metabolismului galactozei
Teste de diagnostic
Deficitul de GALE trebuie suspectat atunci când galactoza -1-fosfat de celule roșii este crescută în timp ce GALT este normal. Screeningul nou-născutului va da un rezultat anormal dacă este definit de un nivel crescut de galactoză totală din sânge cu activitate normală GALT. Diagnosticul este confirmat de testarea epimerazei în eritrocite. Părinții heterozigoți au redus activitatea epimerazei, o constatare care poate ajuta la evaluare. Studiile ulterioare ale activității GALE în limfoblaste transformate și galactoză-1-fosfat de celule roșii în timp ce galactoza alimentară este activată și oprită pot ajuta la caracterizarea tulburării în continuare. 97 În acele familii cu forma severă de deficit de GALE, secvențierea genei GALE a fost cea mai rapidă metodă de a determina dacă sugarii cu risc sunt sau nu afectați.
Biosinteza vitaminelor în plante Partea B
G l -Galactoză dehidrogenază
l-GalDH catalizează oxidarea dependentă de NAD + a l-Gal la C1 pentru a produce 1-galactono-1,4-lactonă (Gatzek și colab., 2002). Capacitatea enzimei pare a fi relativ ridicată, deoarece l -Gal furnizat exogen și produsul său de reacție l -galactonolactonă (l -GalL) sunt foarte rapid transformate în ascorbat, rezultând o creștere mare a dimensiunii bazinului de ascorbat (Davey și colab., 1999; Wheeler și colab., 1998). Activitatea Arabidopsis l -GalDH este codificată de At4g33670. Dovezile pentru rolul său în biosinteza ascorbatului sunt derivate din scăderea ascorbatului în plante unde expresia l-GalDH a fost scăzută prin suprimarea antisens. Enzima are o specificitate ridicată pentru l -Gal (Arabidopsis Km 0,4 mM, spanac Km 0,1 mM) și Vmax mult mai scăzut și afinitate mai mică pentru l -guloză (Km 4 mM) și l -fucoză (Km 56 mM) (Gatzek și colab., 2002; Mieda și colab., 2004). Spanacul purificat l-GalDH este inhibat competitiv de ascorbat (Mieda și colab., 2004). Valoarea Ki de 0,1 mM este cu mult peste concentrația de ascorbat dedusă în citosol (Tabelul I), sugerând că enzima ar putea fi reglată prin inhibarea feedback-ului.
Tabelul I. Concentrații de ascorbat (mM) în compartimentele intracelulare ale celulelor frunzelor din plante crescute sub iradiere scăzută sau ridicată (unități: μmol fotoni m - 2 s - 1)
| Arabidopsis | 250 | 21 | 10 | 10 | 23 | 16 | 2 |
| 700 | 29 | 20 | 13 | 16 | 21 | 12 | |
| Orz | 100 | 35 | 2 | n.d. | n.d. | n.d. | 0,6 |
| 500 | 61 | 10 | n.d. | n.d. | n.d. | 3 |
Concentrațiile de Arabidopsis au fost estimate din localizarea imunogold cu anticorpi ascorbați folosind datele din Zechmann și colab. (2010). Datele despre orz au fost obținute prin fracționare neapoasă (Rautenkranz și colab., 1994). n.d., nedeterminat.
Modele Fly ale bolilor umane
3.3 Utilizarea Drosophila pentru a diseca rolurile diferențiale ale GALE în dezvoltare
Lucrarea descrisă în această secțiune este de la Daenzer, Sanders, Hang și Fridovich-Keil (2012), cu excepția cazului în care se menționează altfel.
3.3.1 Decuplarea celor două activități ale GALE în Drosophila
GALE atât de la oameni, cât și de Drosophila interconvertește două seturi de substraturi: UDPgal/UDPglc și UDPgalNAc/UDPglcNAc (Fig. 1). Pentru a decupla și a testa rolurile de dezvoltare ale acestor activități în mod individual, Daenzer și colegii au creat muște cu activitate către doar unul sau altul substrat. Această specificitate a substratului a fost realizată prin înlocuirea eficientă a expresiei dGALE cu expresia oricăreia dintre cele două gene epimerazice procariote, fiecare codificând un produs capabil să interconvertească o singură pereche de substrat: eGALE, care convertește numai UDPgal/UDPglc și wbgU, care interconvertește doar UDPgalNAc/UDPglcNAc . Exprimarea acestor transgene microbiene în Drosophila cu deficit de dGALE a dus la animale cu doar una sau alta activitate GALE.
3.3.2 Ambele activități GALE joacă roluri esențiale în timpul dezvoltării
După cum sa explicat anterior, Sanders și colab. (2010) au arătat că GALE este esențial pentru dezvoltarea Drosophila și că animalele cu deficit de dGALE mor în embriogeneză. Exprimând doar eGALE, numai wbgU sau ambele eGALE și wbgU împreună în embrioni cu deficit de dGALE, Daenzer și colegii au confirmat că activitatea GALE către ambele perechi de substrat este esențială pentru supraviețuirea Drosophila. Mai exact, nici transgenul microbian nu a permis supraviețuirea, dar împreună au făcut-o și, în plus, hGALE, care, la fel ca dGALE recunoaște ambele perechi de substrat, a fost, de asemenea, suficient.
3.3.3 Activitatea GALE către UDPgal/UDPglc este necesară pentru o durată normală de viață a Drosophila adulți expusă la galactoză dietetică
3.3.4 Cele două activități GALE au un impact diferit asupra nivelurilor de metabolit ale galactozei
Deși este clar că Drosophila cu deficiență dGALE experimentează o varietate de rezultate acute și pe termen lung, fiziopatologia acestor rezultate rămâne neclară. Daenzer și colegii săi au câștigat câteva cunoștințe despre fiziopatologie din studierea nivelurilor de metabolit de galactoză la animalele lor cu deficiențe diferite. De exemplu, Drosophila în care s-a produs knockdown dGALE la începutul dezvoltării a acumulat niveluri foarte ridicate de Gal-1P atunci când a fost expus la galactoză ca larve. Aceste larve au acumulat, de asemenea, niveluri foarte ridicate de UDPgal. În mod similar, larvele cu deficit de activitate doar către UDPgal/UDPglc au acumulat niveluri foarte ridicate atât de Gal-1P cât și de UDPgal atunci când s-au dezvoltat în prezența, dar nu și în absența, a galactozei dietetice bogate. În schimb, animalele cu deficit de activitate GALE numai către UDPgalNAc/UDPglcNAc nu au acumulat niveluri anormale de Gal-1P sau UDPgal. Cu toate acestea, aceste animale nu erau viabile. În mod clar, Gal-1P și UDPgal crescute nu pot fi singura cauză a fiziopatologiei în deficiența GALE.
Carbohidrați, alcooli și acizi organici
Metabolism
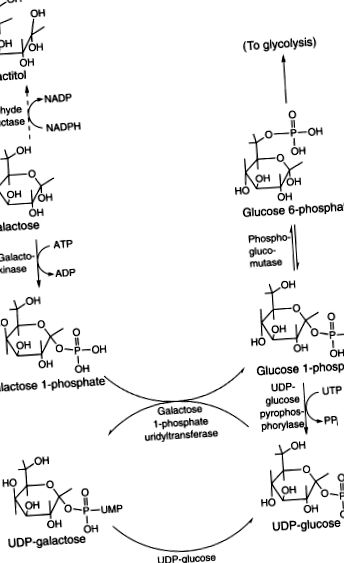
Gal se transformă în principal în glucoză l-fosfat și apoi în glucoză 6-fosfat în ficat (Figura 6.14). Există o cale alternativă minoră, dar rămâne de caracterizat (Berry și colab., 2001). Etapa critică inițială este fosforilarea prin galactokinază (EC2.7.1.6). Există două izoforme distincte genetic ale enzimei cu distribuție tisulară diferită. Acumularea de galactitol în lentilele persoanelor cu galactokinază 1 defectă poate provoca cataractă în copilărie sau la vârsta adultă timpurie. Următorul pas al metabolismului Gal este transferul UDP de către UDP-glucoză-hexoză-i-fosfat uridililtransferază (EC2.7.7.12). UDP-glucoza-4'-epimeraza (EC5.1.3.2) epimerizează UDPGal în UDP-glucoză. Deoarece UDP-glucoza furnizează din nou UDP pentru următoarea moleculă de Gal 1-fosfat, aceasta funcționează ca un mecanism autocatalitic cu o conversie netă de Gal 1-fosfat în glucoză 1-fosfat. Fosfoglucomutaza dependentă de magneziu (EC5.4.2.2; două izoforme, PGM1 și PGM2) transformă glucoză 1-fosfat în glucoză intermediară ușor metabolizabilă 6-fosfat. Gal poate fi alternativ redus la galactitol de aldehidă reductază dependentă de NADPH (aldozreductază, EC1.1.1.21), în special în prezența excesului de Gal.
Figura 6.14. Metabolismul Gal.
Tulburări ale metabolismului glucidic
93.4.1 Metabolismul galactozei
Galactoza, o componentă a lactozei, este un nutrient important pentru nou-născuți și copii mici. În laptele matern uman, conținutul de lactoză este de aproximativ 7 g/dL, iar în laptele de vacă concentrația este de aproximativ 5 g/dL. La nou-născut, lactoza poate furniza până la 40% din aportul caloric, dar doar 3-4% la adult, din cauza aportului de lapte proporțional mai mic. Galactoza este, de asemenea, un constituent al multor glicoproteine, glicolipide și mucopolizaharide.
Calea principală pentru metabolismul galactozei a fost desemnată ca cale Leloir (Figura 93-2). Galactoza este fosforilată în galactoză-1-fosfat de enzima galactokinază. Galactoza-1-fosfat este schimbat cu fragmentul glucoză-1-fosfat al uridinei difosfatului glucozei (UDPG) pentru a forma uridina difosfat galactoză (UDPGal) prin galactoză-1-fosfat uridil transferază (transferază sau GALT). Glucoza-1-fosfatul eliberat duce în calea glucozei. UDPGal format este convertit în UDPG de enzima UDPGal-4-epimerază (epimerază). Suma acestor trei reacții enzimatice care implică galactokinază, transferază și epimerază este
FIGURILE 93-2. Căi ale metabolismului galactozei.
Galactoză + adenozin trifosfat (ATP) = Glucoză-1-fosfat + adenozin difosfat (ADP).
UDPGal este, de asemenea, utilizat pentru sinteza glucidelor complexe care conțin galactoză. O cantitate mică de galactoză este convertită în galactitol de aldoză reductază și în acid galactonic de galactoză dehidrogenază.
Aceste trei enzime galactoză din calea principală sunt larg distribuite în țesuturi, inclusiv eritrocite, leucocite, ficat, rinichi, creier, fibroblaste cutanate cultivate, vilozități corionice și celule ale lichidului amniotic. Locurile genetice la om pentru galactokinază, transferază și epimerază se află pe cromozomii 17, 9 și respectiv 1 (34-36) .
Deficiența activității fiecăreia dintre cele trei enzime duce la tulburări metabolice cunoscute sub denumirea de deficit de galactokinază, deficit de galactoză-1-fosfat uridil transferază (galactozemie) și deficit de UDPgalactoză-4-epimerază. Toate cele trei tulburări pot fi identificate prin screening-ul nou-născutului, bazat pe cantități crescute de galactoză sau galactoză-1-fosfat în petele de sânge (carduri Guthrie), cu condiția să existe o cantitate normală de aport de lactoză în formula nou-născutului sau în alăptări. Identificarea defectului specific se bazează pe teste enzimatice în eritrocite, asigurându-se că nou-născutul nu a primit transfuzie de sânge înainte de recoltarea probei de sânge. Adesea, testul la fața locului Beutler a fost utilizat de laboratoarele de screening pentru nou-născuți pentru detectarea defectului transferazei (37). Unele laboratoare de screening utilizează analiza automată a activității transferazei. Recent, toate cele trei enzime galactoză pot fi analizate simultan printr-o nouă analiză enzimatică multiplex utilizând cromatografie lichidă ultraperformantă - spectrometrie de masă tandem (UPLC - MS/MS) (38) .
Hipoglicemie
Galactozemie
Galactoza este metabolizată prin intermediul căii Leloir, care îi permite să fie supusă fie gluconeogenezei, fie glicolizei. Pasul inițial al acestei căi este conversia β-d -galactozei în α- d -galactoză prin mutarotază. A-d-galactoza este apoi fosforilată de galactokinază (codificată de gena GALK1, localizată pe cromozomul 17q25.1) în galactoză-1-fosfat (Gal1P). Uridiltransferaza Gal1P (codificată de GALT, pe cromozomul 9p13.3) transferă apoi o grupare uridilmonofosfat (UMP) din uridildifosfat (UDP) -glucoză în Gal1P, formând UDP-galactoză. Ulterior, UDP galactoză-4'-epimerază (codificată de GALE, pe cromozomul 1p36.11) convertește UDP-galactoză în UDP-glucoză. 137
Galactozemia este o tulburare autosomală recesivă a metabolismului galactozei rezultată din defecte ale oricăreia dintre enzimele implicate în calea metabolismului galactozei. Galactozemia clasică, cunoscută și sub numele de galactozemie tip 1, datorită unei mutații/deleției heterozigoți homozigoți sau compuși din gena GALT, care are ca rezultat o scădere a funcției enzimei de peste 95%, este foarte frecventă. Incidența galactozemiei clasice este cuprinsă între 1/30.000 și 1/60.000 în țările occidentale, 138.139 cu o incidență mai mare la călătorii irlandezi (posibil datorită creșterii consanguinității). Este mai rar la populațiile asiatice. Peste 120 de mutații în GALT au fost identificate ca provocând galactozemie; au fost identificate încă 173 de mutații patogene. 81 Dintre acestea, un studiu a constatat că două mutații - Q188R și K285N - au reprezentat mai mult de 70% din galactozemia clasică asociată cu disfuncția GALT în populația caucaziană și că o singură mutație, S135L, a fost responsabilă pentru 62% din galactozemia în populația neagră.; acesta din urmă a fost asociat cu rezultate clinice mai bune. 140
- Sindromul dintelui crăpat - o prezentare generală a subiectelor ScienceDirect
- Diogene - o privire de ansamblu Subiecte ScienceDirect
- Demența frontotemporală - o prezentare generală Subiecte ScienceDirect
- Pancreatectomia distală - o prezentare generală Subiecte ScienceDirect
- Șobolan sensibil la sare Dahl - o prezentare generală Subiecte ScienceDirect