Yucheng Wang
1 Departamentul de Medicină Laser, Spitalul General PLA din China, Beijing
2 Colegiul de Medicină, Universitatea Nankai, Tianjin
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Ximing Wu
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Jia Chen
3 Spitalul de Dermatologie din Shanghai, China
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Reabilitare Amin
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Min Lu
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Brijesh Bhayana
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Jie Zhao
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Clinton K. Murray
7 Serviciul de boli infecțioase, Brooke Army Medical Center, Fort Sam Houston, Texas
Michael R. Hamblin
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
6 Harvard-MIT Divizia de Științe și Tehnologie a Sănătății, Cambridge, Massachusetts
David C. Hooper
Divizia a 5-a de Boli Infecțioase, Spitalul General din Massachusetts, Harvard Medical School, Boston
Tianhong Dai
4 Wellman Center for Photomedicine, Massachusetts General Hospital, Harvard Medical School, Boston
Abstract
fundal. Biofilmele afectează> 80% din infecțiile bacteriene la om și sunt de obicei dificil de eradicat datorită rezistenței lor inerente la medicamente.
Metode. Am investigat eficacitatea luminii albastre antimicrobiene (aBL) (lungime de undă, 415 nm) pentru inactivarea biofilmelor Acinetobacter baumannii sau Pseudomonas aeruginosa în microplăci cu 96 de godeuri sau răni infectate cu arsuri de șoarece.
Rezultate. In vitro, în microplăci cu 96 de godeuri, expunerea biofilmelor A. baumannii de 24 de ore și 72 de ore la 432 J/cm2 aBL a dus la inactivarea a 3,59 log10 și 3,18 log10 unități care formează colonii (CFU), respectiv. Pentru biofilmele P. aeruginosa s-au atins niveluri similare de inactivare - 3,02 log10 și respectiv 3,12 log10 CFU. În rănile arse la șoarece infectate cu 5 × 106 CFU de A. baumannii, aproximativ 360 J/cm 2 și 540 J/cm 2 aBL a fost necesară pentru a inactiva 3 log10 CFU în biofilme atunci când au fost livrate 24 și respectiv 48 de ore, după inocularea bacteriană . Analiza cromatografiei lichide de înaltă performanță a relevat prezența porfirinelor endogene atât în A. baumannii, cât și în P. aeruginosa. Testul TUNEL nu a detectat celule apoptotice în pielea de șoarece iradiată de aBL până la 24 de ore după expunerea la aBL (540 J/cm2).
Concluzii. aBL are activitate antimicrobiană în biofilmele de A. baumannii și P. aeruginosa și este o abordare terapeutică potențială pentru infecțiile legate de biofilm.
Biofilmele afectează> 80% din infecțiile bacteriene la om [1]. În biofilme, bacteriile vii sunt grupate împreună într-o matrice extracelulară foarte hidratată [2, 3]. Epuizarea substanțelor metabolice sau acumularea de deșeuri în biofilme determină intrarea bacteriilor într-o stare lentă sau necrescentă (staționară) [3]. În consecință, biofilmele sunt mai tolerante la medicamentele antimicrobiene convenționale și la apărarea gazdei, în comparație cu omologul lor planctonic [4, 5] și sunt asociate cu infecții persistente [6, 7]. Situația este agravată de apariția tot mai mare a tulpinilor bacteriene rezistente la medicamente, în special bacterii gram-negative rezistente la medicamente [8]. Sunt necesare noi abordări terapeutice pentru a combate rezistența la medicamente în infecțiile legate de biofilm [9].
O nouă abordare antimicrobiană bazată pe lumină, lumina albastră antimicrobiană (aBL), a atras atenția din ce în ce mai mult datorită efectului său antimicrobian intrinsec fără implicarea fotosensibilizatorilor exogeni [10-14]. Mecanismul care stă la baza activității antimicrobiene a aBL nu este încă pe deplin înțeles. O ipoteză obișnuită este că aBL excită cromoforii fotosensibilizatori endogeni naturali (în principal porfirine fără fier) și conduce ulterior la producerea speciilor de oxigen reactiv citotoxic (ROS) [14]. În studiile noastre anterioare, am demonstrat că aBL celulele bacteriene planctonice inactivate selectiv (inclusiv tulpini multirezistente) păstrând în același timp celulele gazdă și că a eliminat cu succes infecțiile acute din rănile șoarecilor [15-17]. În prezentul studiu, am investigat în continuare eficacitatea inactivării aBL a biofilmelor Pseudomonas aeruginosa și Acinetobacter baumannii în microplăci cu 96 de godeuri sau plăgi cu arsuri de șoarece cu infecții stabilite.
MATERIALE ȘI METODE
Sursă de lumină albastră
Pentru iradierea aBL, am folosit un prototip de diodă emițătoare de lumină (LED; Vielight, Toronto, Canada) cu emisie maximă la 415 nm și lățime completă la jumătate de maxim 10 nm. LED-ul a fost montat pe un radiator pentru a preveni efectele termice asupra țintei iradiate. Iradianța de pe suprafața țintei a fost ajustată prin manipularea distanței dintre diafragma sursei de lumină și țintă și a fost măsurată folosind un contor de putere/energie PM100D (Thorlabs, Newton, New Jersey).
Tulpini bacteriene
Tulpinile bacteriene utilizate în acest studiu au fost P. aeruginosa ATCC 19660 (tulpina 180) și un izolat clinic rezistent la medicamente de A. baumannii. Ambele tulpini au fost făcute bioluminescente prin transfectarea operonului lux în tulpinile bacteriene așa cum s-a descris anterior [18, 19], permițând monitorizarea în timp real a bioluminiscenței de la bacterii utilizând imagistica cu bioluminescență. Bacteriile au fost cultivate în mod obișnuit în mediu de infuzie a inimii creierului (BHI) suplimentat cu 50 ug/ml kanamicină într-un incubator orbital (37 ° C; 1300g).
Corelația luminescenței bacteriene cu unitățile care formează colonii (CFU) în biofilme
Suspensiile bacteriene din BHI au fost incubate în microplăci cu 96 de godeuri (200 μL/godeu; aproximativ 106 CFU/mL) timp de 24 de ore pentru a permite creșterea biofilmului [20-22]. La sfârșitul perioadei de incubație, biofilmele au fost spălate cu atenție de două ori cu soluție salină tamponată cu fosfat (PBS) pentru a îndepărta bacteriile neadezive și s-au adăugat 200 pl de PBS în fiecare godeu. Biofilmele din diferite godeuri au fost apoi expuse la aBL la o iradiere de 100 mW/cm2 pentru perioade diferite. După expunerea la aBL, biofilmele au fost supuse atât măsurării intensității luminiscenței (în unități de lumină relativă [RLU]), utilizând un cititor de plăci multi-etichetă Victor-2 1420 (EG&G Wallac, Gaithersburg, Maryland), cât și un test de formare a coloniilor. Pentru testul de formare a coloniilor, fiecare godeu a fost atent sfărâmat și apoi vibrat prin sonicare timp de 1 minut. Suspensiile au fost apoi colectate și placate pe agar BHI după diluții seriale utilizând metoda descrisă anterior [23]. Numărul total de CFU din biofilme a fost determinat și echipat liniar cu luminiscența bacteriană corespunzătoare.
aBL Inactivarea bacteriilor în biofilme in vitro
Suspensiile bacteriene din bulionul BHI au fost incubate în microplăci cu 96 de godeuri (200 μL/godeu; aproximativ 106 CFU/mL) timp de 24 sau 72 de ore pentru a permite creșterea biofilmului [20-22]. În timpul incubației, mediul de cultură a fost schimbat în fiecare zi. La sfârșitul incubației, biofilmele au fost spălate cu atenție de două ori folosind PBS și 200 μL de PBS proaspăt au fost adăugate în fiecare godeu. Biofilmele au fost apoi iradiate cu aBL la o iradiere de 100 mW/cm2. La diferite momente de timp după inițierea iradierii aBL, luminiscența bacteriană a biofilmelor a fost măsurată folosind cititorul de plăci multietichete, iar viabilitatea bacteriană în biofilme a fost estimată pe baza luminiscenței bacteriene. Experimentul a fost realizat în 4 replici pentru fiecare condiție.
aBL Inactivarea biofilmelor bacteriene în rănile arse de șoareci
Șoareci BALB/c femele adulte în vârstă de 7-8 săptămâni și cântărind 17-19 g au fost cumpărate de la Charles River Laboratories (Wilmington, MA). Toate procedurile pentru animale au fost aprobate de comitetele instituționale de îngrijire și utilizare a animalelor din Spitalul General din Massachusetts (protocol 2014N000009) și acordate cu liniile directoare ale Institutelor Naționale de Sănătate.
Înainte de apariția rănilor prin arsură termică la șoareci, șoarecii au fost anesteziați prin injectarea intraperitoneală a unui cocktail de ketamină-xilazină (100 mg/kg-20 mg/kg). O plagă cu arsură de gradul trei, de gradul trei, a fost făcută prin expunerea zonei depilate pe spatele fiecărui șoarece timp de 3 secunde la un bloc de alamă (1 cm × 1 cm), care a fost încălzit până la echilibrare termică cu apă de la robinet fierbinte. S-a administrat soluție salină sterilă (0,5 ml intraperitoneal) pentru a susține echilibrul fluidelor în timpul recuperării. La cinci minute după inducerea leziunii termice, suspensiile bacteriene (50 μL) conținând 5 × 106 CFU în PBS au fost inoculate pe locurile de arsură și au rămas la locul lor în timp ce șoarecii s-au recuperat din anestezie. A. baumannii a fost folosit ca agent patogen model în acest experiment. La 24 sau 48 de ore după inocularea bacteriană, când s-au format biofilme în rănile arse la șoarece [24-27], aBL a fost administrat la rănile infectate arse la o iradiere de 100 mW/cm2. Șoarecilor li s-a administrat o expunere totală la lumină de până la 360 J/cm 2 și 540 J/cm 2 în alicote pentru răni cu arsuri în vârstă de 24 de ore și, respectiv, în vârstă de 48 de ore, respectiv, cu imagini cu bioluminiscență care au loc după fiecare alicotă de lumină . Pentru fiecare afecțiune (inclusiv controale netratate), s-a folosit un grup de 8-10 șoareci.
Imagistica cu bioluminiscență in vivo
Emisia de bioluminiscență a bacteriilor în rănile arse de șoareci a fost detectată prin utilizarea unui sistem de imagistică a bioluminescenței Hamamatsu (Hamamatsu Photonics KK, Bridgewater, New Jersey). Acest sistem a inclus o cameră intensificată cu dispozitiv cuplat la încărcare (C2400-30H, Hamamatsu) dezvoltată pentru imagistica la niveluri de lumină extrem de scăzute (până la niveluri de fotoni), un controler al camerei, o cameră pentru probe și un procesor de imagine (C5510-50, Hamamatsu ). Când este setat pentru numărarea fotonilor, circuitul de amplificare automată al controlerului camerei a fost utilizat pentru o sensibilitate maximă. Un timp de integrare de 2 minute a fost utilizat pentru achiziționarea imaginii cu bioluminiscență. Pentru fiecare măsurare, semnalul de fundal a fost scăzut din semnalul de bioluminiscență. Intensitatea bioluminiscenței infecțiilor a fost cuantificată folosind software-ul Argus 5.0 (Hamamatsu).
Analiza cromatografiei lichide de înaltă performanță (HPLC) Analiza prezenței porfirinelor endogene în celulele bacteriene
Testul TUNEL al celulelor apoptotice într-o piele de șoarece iradiată de BL
pielea de șoarece iradiată cu aBL a fost examinată pentru prezența celulelor apoptotice, utilizând un test TUNEL în care ADN fragmentat din celulele apoptotice este supus marcării finale cu fluorofor. Probele de biopsie cutanată au fost colectate înainte și la 0 ore și 24 de ore după expunerea la BL. Probele de biopsie au fost fixate în 10% formalină tamponată cu fosfat (Fisher Scientific) timp de 24 de ore, prelucrate și apoi încorporate în parafină. Secțiunile seriale de 4 μm - țesut gros au fost analizate utilizând sistemul fluorescent TUNEL DeadEnd (Promega, Madison, WI) conform protocolului producătorului. Pe scurt, după deparafinare și rehidratare, secțiunile au fost fixate, permeabilizate cu proteinază K timp de 8-10 minute și fixate în mod repetat. Părțile de acoperire de 50 uL de amestec terminal de deoxinucleotidil transferază au fost aplicate pe secțiuni timp de 1 oră la 37 ° C într-o cameră umidificată. După îndepărtarea lamelelor de acoperire, secțiunile au fost scufundate în tampon SSC (2 ×) timp de 15 minute, spălate cu PBS și montate cu mediu, inclusiv DAPI (Vectashield, Vector Laboratories). Imaginile de fluorescență au fost capturate folosind o microscopie confocală FluoView FV1000-MPE (Olympus Corporation, Tokyo, Japonia) cu izotiocianat de fluorescenă ca fluor și DAPI ca contrapunct nuclear.
Pentru controlul pozitiv, secțiunile de țesut au fost tratate cu DNază I pentru a induce fragmentarea ADN-ului, folosind DNază RQ1 fără RNază (catalog nr. M6101; Promega). Pe scurt, după tratamentul cu proteinază K, secțiunile de țesut au fost tratate cu 10 unități/ml de DNază I timp de 10 minute la temperatura camerei și apoi au fost urmate restul etapelor testului TUNEL.
Analize statistice
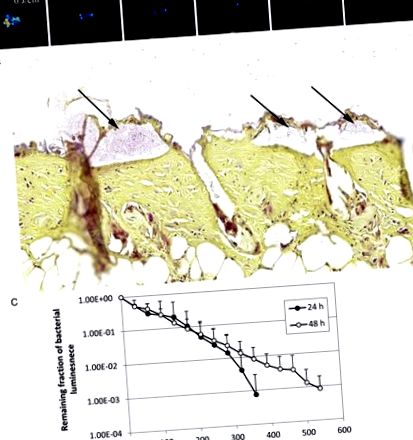
Inactivarea luminii albastre antimicrobiene (aBL) a biofilmelor în rănile arse ale șoarecilor infectați. A, Imagini de luminescență bacteriană succesive de la un șoarece reprezentativ arsă rana infectată cu 5 × 106 unități care formează colonii de Acinetobacter baumannii și expuse la 360 J/cm 2 aBL 24 de ore după inocularea bacteriană. B, secțiunea colorată cu Gram a unui exemplar reprezentativ de rană a pielii de șoarece arătând prezența biofilmelor (săgeți) A. baumannii. Proba de piele a fost recoltată la 24 de ore după inocularea bacteriană. C, Curbele doză-răspuns ale luminescenței bacteriene medii a rănilor arse la șoarece infectate cu 5 × 106 A. baumannii și tratate cu aBL 24 de ore (n = 10) și 48 de ore (n = 10) după inocularea bacteriană. Barele indică abateri standard.
Figura Figura 3 3 C prezintă curbele doză-răspuns ale luminescenței bacteriene medii în rănile arse la șoarece infectate cu 5 × 106 CFU de A. baumannii și tratate cu aBL 24, respectiv 48 de ore, după inocularea bacteriană. Infecțiile au fost mai rezistente la terapia cu ABL 48 de ore după inoculare decât 24 de ore după inoculare. Pentru a realiza inactivarea a 3 log10 CFU de A. baumannii în rănile arse la șoarece, a fost necesară aproximativ 360 J/cm 2 și 540 J/cm 2 aBL 24 de ore și respectiv 48 de ore, după inoculare (P = .06). Această diferență se datorează faptului că infecțiile la 48 de ore după inoculare au fost localizate mai adânc în pielea șoarecelui decât infecțiile la 24 de ore după inoculare. Luminiscența bacteriană a șoarecelor arde rănile fără expunere la aBL a rămas aproape neschimbată în perioada echivalentă (date neprezentate; P Figura 4. Vârfurile intensității emisiilor în cromatograme (Figura 4 A și 4 B) indică prezența porfirinelor endogene în atât pentru A. baumannii, cât și pentru P. aeruginosa. Pentru A. baumannii, au fost detectate 3 vârfuri principale de intensitate a emisiilor la timpii de retenție de aproximativ 18,5 minute, 20,3 minute și respectiv 21 de minute, cu un timp total de funcționare de 30 de minute (Figura 4 4 Pentru P. aeruginosa, pe lângă vârfurile de intensitate a emisiilor observate în cromatograma lui A. baumannii, a fost observat un pic de intensitate a emisiilor la timpul de reținere de 17,5 minute, sugerând prezența Pp IX (Figura 4 4 B) Pentru ambele tulpini bacteriene, vârful intensității emisiilor la 18,5 minute a fost predominant, însă acest vârf al intensității emisiilor nu a fost detectat în amestecul standard de porfirină. s compus din uroporfirină, heptaporfirină, hexaporfirină, pentaporfirină, coproporfirină și mezoporfirină IX (datele nu sunt prezentate).
Cromatografii lichide de înaltă performanță cromatograme de extracte de porfirină din Acinetobacter baumannii (A), extracte de porfirină din Pseudomonas aeruginosa (B) și protoporfirină standard IX (Pp IX; C).
Nici o celulă apoptotică nu a fost detectată într-o piele de șoarece iradiată de BL
Imaginile cu imunofluorescență ale pielii reprezentative ale șoarecilor înainte și la 0 ore și 24 de ore după o singură expunere aBL (540 J/cm2), prezentate în Figura Figura 5, 5, nu au evidențiat prezența celulelor apoptotice în pielea de șoarece iradiată de aBL. Fluorescența detectată la controlul pozitiv (secțiunea pielii șoarecelui tratată cu DNază I) a indicat prezența celulelor apoptotice.
Testarea TUNEL a celulelor apoptotice în pielea șoarecelui înainte și la 0 ore și 24 de ore după expunerea la lumină albastră antimicrobiană (540 J/cm2). Controlul pozitiv a fost tratat cu DNază I. Nucleele au fost colorate în albastru cu DAPI.
DISCUŢIE
Este bine cunoscut faptul că biofilmele pot fi greu de eradicat prin utilizarea antibioticelor tradiționale și că a fost raportată o creștere de 100-1000 de ori a toleranței/rezistenței antimicrobiene în celulele biofilmului, în comparație cu celulele planctonice [30]. Multe mecanisme funcționează împreună pentru a produce o toleranță/rezistență totală specifică biofilmului [3], inclusiv eșecul antibioticelor de a pătrunde în biofilm [31], rata lentă de creștere [31], metabolismul modificat [31], gradienții de oxigen [32], celule persistente [33], subpopulații în biofilme [34], concentrații subminime inhibitoare de antibiotice [35], mutații [36], detectarea cvorumului [37] și transfer genetic [38]. Rezultatele prezentului studiu sunt promițătoare prin faptul că aBL pătrunde în biofilm atât pentru biofilmele în stadiu incipient (vechi de 24 de ore), cât și pentru cele mature (> 48 de ore).
Pe de altă parte, există posibilitatea ca porfirinele să nu fie singurii cromofori fotosensibilizatori endogeni care se prezintă în bacterii. Alți cromofori fotosensibilizatori endogeni (de exemplu, flavine și citocromi) pot exista, de asemenea, în bacterii și contribuie la efectul inactivării aBL [14]. Sunt necesare studii suplimentare pentru a investiga această posibilitate.
Există o limitare a ABL în gradul său de penetrare a luminii, la fel ca toate celelalte abordări terapeutice și diagnostice bazate pe lumină. În acest studiu, am testat eficacitatea inactivării aBL a biofilmelor pe suprafața pielii de șoarece arse, un loc în care livrarea sistemică a medicamentului poate fi limitată, sugerând că terapiile bazate pe lumină pot completa terapiile sistemice antibacteriene în setările plăgii arse și alte infecții ale pielii. Pentru biofilme adânc așezate, poate fi luată în considerare și lumina livrată interstițial și suntem în curs de dezvoltare a unui patch cu microneedle-array care poate ajuta la livrarea aBL în mod interstițial către biofilme adânc asezate [45].
Note
Mulțumiri. Îi mulțumim lui Tayyaba Hasan, dr., La Wellman Center pentru co-mentorarea lui Y. W., J. C. și R. A.
Declinare de responsabilitate. Opiniile exprimate aici sunt cele ale autorilor și nu reflectă politica oficială sau poziția Departamentului Armatei, Departamentului Apărării sau a Guvernului SUA.
Sprijin financiar. Această lucrare a fost susținută de Centrul pentru integrarea medicinii și tehnologiei inovatoare, în cadrul unui acord de cooperare privind activitatea de achiziție medicală a armatei SUA (acordarea 14-1894 către T. D.); Institutele Naționale de Sănătate (1R21AI109172 la T.D.); și Societatea Americană pentru Medicină și Chirurgie Laser (subvenție de cercetare studențească BS.S02.15 la Y. W.).
Potențiale conflicte de interese. C. K. M. este angajat al armatei SUA. Toți ceilalți autori nu raportează potențiale conflicte. Toți autorii au trimis formularul ICMJE pentru dezvăluirea potențialelor conflicte de interese. Au fost dezvăluite conflicte pe care editorii le consideră relevante pentru conținutul manuscrisului.
- Lumina albastră are o latură întunecată - Harvard Health
- Coacăze negre; Ferma de fructe albastre
- O rezoluție de pierdere în greutate care; Lumina pe portofel - Știri - Gainesville Sun - Gainesville, FL
- 5 alternative la produsele de curățat prin pulverizare pentru lumina de gătit din oțel inoxidabil
- Blue Buffalo Blue s Stew Conserve de hrană umedă pentru câini - 1800PetMeds Categoria uuid 9474afa3548bc4ac54043a91b4