Adrien Mann
1 Departamentul de Medicină de Urgență, Universitatea din Cincinnati College of Medicine
Allie Thompson
1 Departamentul de Medicină de Urgență, Universitatea din Cincinnati College of Medicine
Nathan Robbins
1 Departamentul de Medicină de Urgență, Universitatea din Cincinnati College of Medicine
Andra L. Blomkalns
1 Departamentul de Medicină de Urgență, Universitatea din Cincinnati College of Medicine
Abstract
Introducere
Adiposul a făcut o apariție notabilă în lumina reflectoarelor media, datorită creșterii dramatice a obezității în ultimele decenii ale secolului XX. Obezitatea afectează în prezent mai mult de o treime din adulți și 17% din copii și adolescenți din Statele Unite (SUA) 1. În toate grupurile etnice, cercetările statistice din jurul epidemiei de obezitate au arătat că negrii non-hispanici au cea mai mare rată de obezitate ajustată în funcție de vârstă (49,5%), comparativ cu mexicanii americani (40,4%), toți hispanicii (39,1%) și cei non-hispanici. Albii hispanici (34,3%) 2. Efectul economic al obezității este, de asemenea, o preocupare tot mai mare pentru sistemul de sănătate. În 2012, s-a estimat că costul medical anual al îngrijirii obezității în SUA în 2005 a fost de 190,2 miliarde de dolari, aproape 21% din bugetul total al cheltuielilor medicale. Din păcate, obezitatea infantilă a fost estimată a fi responsabilă doar de 14 miliarde de dolari în costuri medicale directe. Statistic, s-a stabilit că costul medical mediu al persoanelor cu obezitate a fost de 2.741 dolari mai mare pe an decât cei fără această morbiditate 3-5 .
Obezitatea este un factor de risc major pentru o varietate de afecțiuni, cum ar fi: diabetul de tip 2, dislipidemia, bolile cardiovasculare, cancerul, tulburările scheletice musculare și inflamația cronică. Obezitatea este profund legată de patogeneza sindromului metabolic și a altor boli cronice 6-8. Cu legături atât de drastice și negative între obezitate și alte comorbidități, cercetările științifice au concentrat atenția pentru a înțelege mai bine epidemia actuală și rolurile diverse și pivot jucate de adipos.
Din punct de vedere istoric, țesutul adipos a fost considerat lipsit de consecințe și a fost privit doar ca un simplu țesut de umplere. În prezent, s-a demonstrat că adiposul joacă multe roluri esențiale în funcția corpului în: metabolism, reglarea hormonilor, inflamație, protecție și izolare 9. Țesutul adipos este compus în principal din adipocite, dar conține, de asemenea, pericite, celule endoteliale, monocite, macrofage și celule stem pluripotente 8. Țesutul adipos este distribuit pe tot corpul în depozite distincte. Principalele depozite pot fi găsite subdermic, subcutanat, intramuscular și visceral 10. S-a arătat că depozitele adipoase au profiluri metabolice specifice depozitului, care au demonstrat o sensibilitate specifică depozitului la obezitate și tulburări conexe 8 .
În mod tradițional, țesutul adipos a fost clasificat în două tipuri majore: țesutul adipos alb (WAT) și țesutul adipos maro (BAT); deși literatura recentă indică prezențele unui al treilea grup botezat brite sau bej adipos 11. S-a demonstrat că țesutul adipos are diferite culori, morfologii, funcții metabolice, caracteristici biochimice și modele genetice de exprimare 10. Adipocitele din WAT au o picătură lipidică simplă și mare și cantități variabile de mitocondrii. WAT se găsește în mod predominant în localitățile subcutanate și viscerale ale corpului. WAT funcționează în primul rând ca un loc de stocare a energiei și protecție a organelor. Adipocitele din BAT au o morfologie multiloculară și mitocondrii abundente. BAT este localizată în principal în gât și în vasele mari de sânge ale toracelui, precum și în scapule 12. BAT funcționează în principal în comportamente care consumă energie care reglează termogeneza 7. S-a dovedit că adipozele brite sau bej împărtășesc o morfologie și o expresie similare BAT, dar s-a constatat că provine din adipocite albe 11 .
Scopul acestui protocol este de a oferi o metodă precisă pentru identificarea și izolarea diferitelor tipuri de depozite de grăsime din locații anatomice multiple.
Protocol
NOTĂ: Toate procedurile la animale au fost efectuate cu aprobarea Comitetului instituțional de îngrijire și utilizare a animalelor (IACUC) al Universității din Cincinnati și în conformitate cu Ghidul pentru îngrijirea și utilizarea animalelor de laborator de la Institutul Național de Sănătate (Publicația NIH nr. 85-23, revizuit 1996).
1. Eutanasiați și sterilizați mouse-ul
Așezați mouse-ul într-o cutie care conține o doză suprateraputică de izofluran și lăsați să inspire să efectueze. Odată ce mouse-ul este eutanasiat, scoateți din cutie.
Dislocarea cervicală ca al doilea mijloc de eutanasie.
Sterilizați suprafața exterioară a șoarecelui prin curățarea animalului cu 70% etanol.
2. Identificarea și izolarea a trei depozite adipoase diferite
Izolarea țesutului adipos maro (BAT):
Asigurați-vă că blana este umedă de curățarea alcoolului pentru a ajuta la tăierea straturilor epidermice și dermice.
Poziționați mouse-ul într-o poziție culcat pe spate cu masa.
Apucați pielea chiar sub diafragmă cu forceps, ridicați și incizați cu foarfeca.
Tăiați transversal în jurul circumferinței mouse-ului pentru a expune peritoneul.
Descoperiți depozitul BAT în formă de fluture prin degloving jumătatea superioară a mouse-ului. Țineți apendicele inferioare și abdomenul într-o mână și trageți pielea în sus spre cap.
Orientează mouse-ul, astfel încât să fie poziționat înclinat pe masă. Aveți grijă să nu contaminați depozitul expus cu păr.
Curățați instrumentele chirurgicale și schimbați-le cu o pereche proaspătă de mănuși.
Localizați scapulele și depozitul corespunzător. Îndepărtați cu grijă orice adipos alb superficial de deasupra fluturelui și apoi disecați fluturele de grăsime maro intercapulară. Aveți grijă să evitați mușchiul strâns asociat cu grăsimea brună. NOTĂ: Se recomandă utilizarea unui microscop de disecție pentru îndepărtarea adiposului alb, precum și pentru separarea adiposului maro de scapule.
Îndepărtați depozitul de grăsime și transferați într-un tub de microcentrifugă de 2 ml.
Dacă ARN-ul sau proteina urmează să fie extrase, înghețați țesutul prin imersiune în azot lichid și depozitați la -80 ° C. Congelați proba imediat pentru a preveni degradarea. Dacă cultivați, acoperiți țesutul în DMEF-12 și puneți-l pe gheață până când toate probele sunt colectate pentru cultură (informații suplimentare).
Izolarea țesutului adipos subcutanat (SQ), un depozit de țesut adipos alb (WAT):
Puneți o pereche proaspătă de mănuși pentru a nu se contamina încrucișat între depozitele de grăsimi.
Descoperiți depozitele SQ inghinale, triunghiulare, scoțând din mănușă jumătatea inferioară a mouse-ului. Țineți apendicele superioare și toracele într-o mână și trageți pielea în jos spre picioare cu cealaltă mână.
Orientați mouse-ul în poziție culcat în timp ce aveți grijă să nu contaminați depozitul expus cu păr.
Curățați instrumentele chirurgicale și schimbați-le cu o pereche proaspătă de mănuși.
Disecați cu atenție triunghiurile grăsimii SQ. Aveți grijă să nu contaminați proba cu mușchi, grăsimi învecinate, glande mamare sau prin tăierea oricăror vase și contaminați proba cu sânge. NOTĂ: Se recomandă utilizarea unui microscop de disecție dacă marginile nu sunt clar definite.
Îndepărtați depozitele de grăsime și transferați-le în tuburile de microcentrifugă de 2 ml.
Dacă ARN-ul sau proteina urmează să fie extrase, înghețați țesutul prin imersiune în azot lichid și depozitați la -80 ° C. Congelați proba imediat pentru a preveni degradarea.
Pentru colorare, fixare sau încorporare în OCT. Dacă cultivați, acoperiți țesutul în DMEF-12 și puneți-l pe gheață până când toate probele sunt colectate pentru cultură (informații suplimentare).
Izolarea grăsimii gonadale a unui țesut adipos visceral (TVA) și a depozitului de țesut adipos alb (WAT):
Puneți o pereche proaspătă de mănuși pentru a nu se contamina încrucișat între depozitele de grăsimi.
Cu foarfeca, tăiați peritoneul transversal, direct sub diafragmă. Tăiați peritoneul de la diafragmă la rect în mijlocul coroanei pentru a expune organele abdominale.
Localizați testiculele sau ovarele și identificați țesutul adipos alb atașat, cunoscut sub numele de adipos epididimal la bărbați sau adipos gonadal la femele.
Curățați instrumentele chirurgicale și schimbați-le cu o pereche proaspătă de mănuși
Disecați cu atenție ambele depozite de grăsimi epididimale de la testicule, epididimide și vasa deferențială. Sau dacă sunteți de sex feminin, disecați cu atenție ambele tampoane de grăsime gonadală din ovare.
Îndepărtați depozitele de grăsime și transferați-le în tuburi de microcentrifugă de 2 ml.
Dacă ARN-ul sau proteina urmează să fie extrase, înghețați țesutul prin imersiune în azot lichid și depozitați la -80 ° C. Congelați proba imediat pentru a preveni degradarea.
Pentru colorare, fixare sau încorporare în OCT. Dacă cultivați, acoperiți țesutul în DMEF-12 și puneți-l pe gheață până când toate probele sunt colectate pentru cultură (informații suplimentare).
3. Izolarea țesutului adipos perivascular (PVAT)
Izolarea inimii:
Așezați mouse-ul în decubit dorsal cu anexele superioare și inferioare extinse spre exterior.
Asigurați anexele folosind bandă chirurgicală.
După poziționarea mouse-ului așa cum este enumerat mai sus, creați tensiune ridicând procesul xifoid cu forceps. Tăiați orizontal prin diafragmă, expunând porțiunea inferioară a cavității toracice.
În timp ce mențineți tensiunea, ridicând procesul xifoid, tăiați carcasa superioară spre cap, chiar în partea sternului.
Ridicați cutia toracică doar inferioară claviculei și tăiați-o pe lungimea inferioară a claviculei spre axilă în ambele direcții. Cavitatea toracică și conținutul acesteia (inimă, plămâni etc.) ar trebui acum să fie clar vizibile.
Curățați cavitatea toracică de sânge și lichid străin folosind tifon steril pentru a absorbi lichidul. În cazul în care organele sau vasele de colectare trebuie să profuze (informații suplimentare).
Odată ce zona este curățată de lichid, tăiați bronhiile și atașați vasele pentru a îndepărta plămânii, permițând o mai bună expunere a inimii.
Localizarea și excizia țesutului adipos perivascular aortic (PVAT):
Îndepărtați următoarele organe pentru a identifica mai bine porțiunile inferioare ale aortei: ficat, stomac, splină, pancreas, intestine și colon.
Mai întâi începeți cu identificarea stomacului și a esofagului. Tăiați esofagul la joncțiunea gastro-esofagiană pentru a elibera stomacul de corp.
Apoi, identificați intestinele și mezenterul din jur. Tăiați superficial prin mezenter, deoarece se află foarte aproape de porțiunea renală a aortei, apoi „rulați intestinul”.
Tăiați colonul cât mai aproape posibil de rect. Astfel, eliberând stomacul, intestinul și colonul de la șoarece.
Îndepărtați stomacul, intestinul, colonul, pancreasul și splina tăind prin mezenterul și vasele de atașare. Pancreasul și splina trebuie să se elibereze cu stomacul, intestinul și colonul.
Îndepărtați ficatul tăind prin venele hepatice și atașând mezenterul, îndepărtați toți lobi.
Tăiați stratul visceral și grăsimea înconjoară rinichii. Lăsați rinichii atașați de aorta in vivo pentru a servi drept markeri geografici pentru diferite segmente ale aortei.
Clătiți zona cu 1x PBS steril și îndepărtați tot lichidul prin absorbție cu un tifon steril.
Folosind micro-foarfece și micro-forceps, separați aorta de atașamentul său dorsal la coloana vertebrală și de atașamentul ventral la esofag.
Izolați aorta urmărind și detașând aorta lungimea aortei descendente de la originea din inimă până la bifurcația din regiunea iliacă.
Identificați și izolați vasele subclaviei. Izolați aceste vase de la gât la rădăcina aortică pentru a expune mai bine joncțiunea aortică și rădăcina în inimă.
Îndepărtați timusul, apoi tăiați artera brahiocefalică, artera carotidă comună stângă și artera subclaviană stângă, permițând mișcarea inimii.
Cu ajutorul unui microscop de disecție, vizualizați stratul de țesut adipos perivascular (PVAT) care înconjoară aorta.
Având mare grijă să nu ciupiți sau strângeți PVAT, trageți ușor PVAT de la aortă cu micro-forceps. Tăiați ușor atașarea PVAT la aortă cu micro-foarfece începând din regiunea toracică chiar superioară locului în care se află diafragma. NOTĂ: Se recomandă un microscop de disecție.
Repetați acest proces pe toată lungimea aortei, terminând la regiunea aortică infrarenală, care este situată doar superioară bifurcației iliace a vasului aortic.
Dacă se dorește PVAT pentru arc aortic, utilizați aceeași metodă pentru a elimina PVAT din curbura mai mică a arcului.
Așezați probele PVAT într-un tub de microcentrifugă de 2 ml.
Dacă ARN-ul sau proteina urmează să fie extrase, înghețați țesutul prin imersiune în azot lichid și depozitați la -80 ° C. Congelați proba imediat pentru a preveni degradarea. Dacă se cultivă, acoperiți țesutul în DMEF-12 și puneți-l pe gheață până când toate probele sunt colectate pentru cultură (informații suplimentare). NOTĂ: Depozite adipoase suplimentare de luat în considerare dacă sunteți interesat de o analiză cuprinzătoare a depozitului adipos includ: retroperitoneal, mezenteric, omental, pericardic și popliteu.
Rezultate reprezentative
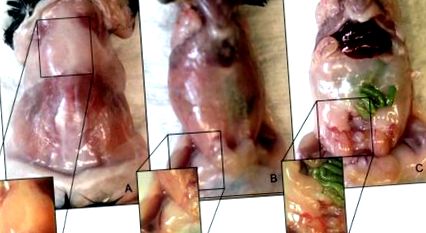
Identificarea și localizarea adiposului subcutanat inghinal, adipos maro intercapular, adipos epididimal visceral (figura 1), precum și adiposul perivascular al arcului aortic, adiposul aortic toracic, adiposul aortic suprarenal și adiposul aortic infrarenal (Figura 2) a fost realizat cu succes folosind metoda chirurgicală descrisă. Examenul histologic și diferențierea între probele BAT și WAT au fost evaluate pozitiv folosind colorarea hematoxilinei și a eozinei (H&E)Figura 3). Analiza nivelurilor de ARN ale adiponectinei (AdipoQ), receptorului gamma activat de proliferatorul peroxizomului (PPAR-γ), efector a DFFA-inducător de moarte celulară (CIDEA) și alți markeri specifici grăsimii au fost măsurate pentru toți cei izolați și excizați mai sus depozite (datele nu sunt afișate).
Liniile celulare primare de adipocite subcutanate și adipocite perivasculară au fost cultivate și diferențiate de la preadipocite la adipocite cu succes pentru analiza microarray. Preadipocitele cultivate convertite în adipocite au fost confirmate cu colorarea cu ulei roșu O (Figura 4). Izolarea cu succes, cultura și diferențierea adipocitelor au fost realizate pentru utilizare în studiile in vitro, iar activitatea proteinelor a fost măsurată cu succes. Activitatea enzimatică a matricei metaloprotează-2 (MMP2) a fost măsurată într-un grup de tratament comparativ cu martorul. Activitatea MMP2 a fost măsurată in situ într-o linie adipocitară perivasculară primară prin zimografie (Figura 5).
Figura 1. Locațiile anatomice ale depozitelor de grăsime de șoarece C57BL/6 masculin. (A) Depozit de grăsime adiposă maro interscapulară. (B) Depozit adipos subcutanat inghinal. (C) Depozit de grăsimi adipose epididimale viscerale. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 2. Locațiile anatomice ale depozitelor PVAT într-un șoarece mascul C57BL/6. (A) Depozit adipos perivascular de arc aortic. (B) Depozit adipos perivascular aortic toracic. (C) Depozit adipos perivascular aortic suprarenal. (D) Depozit adipos perivascular aortic infrarenal. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 3. Colorarea H&E a BAT și WAT adipos. (A) Colorare H&E a paraformaldehidei fixate, probă de șoarece mascul C57BL/6 încorporată în parafină de adipos WAT la o mărire 40X. (B) Colorarea H&E a paraformaldehidei fixate, probă de șoarece mascul mascul C57BL/6 încorporată în parafină de BAT la o mărire 40X. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 4. Colorarea cu ulei roșu O a preadipocitelor și adipocitelor PVAT cultivate. (A) Colorare roșie cu ulei a preadipocitelor perivasculare aortice cultivate la momentul inițial al diferențierii la mărirea 20X cu contrast de fază. (B) Colorare roșie cu ulei a adipocitelor perivasculare aortice cultivate după 5 zile de diferențiere la mărire 20X cu contrast de fază. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 5. Zimografia adipocitelor diferențiate, izolat din țesutul adipos perivascular, a demonstrat o activitate scăzută a MMP2 eliberată după tratament comparativ cu celulele netratate (martor), * P 13-14 .
În cadrul acestei metodologii, există mai mulți pași care sunt de o importanță vitală pentru izolarea și puritatea eșantionului. Curățarea sculelor, a mănușilor și a suprafețelor de multe ori pentru îndepărtarea părului și a contaminanților este un pas imperativ pentru a evita contaminarea depozitului. Atunci când tăiați pielea transversal în jurul circumferinței mouse-ului pentru a expune peritoneul pentru degloving, este vital să evitați tăierea prea profundă. Tăierea peritoneului va face foarte dificilă degloving și va crește potențialul de contaminare a probei. Atunci când excizați depozitele adipoase SQ este vital să identificați limitele triunghiulare ale depozitului înainte de a exciza oricare dintre adipoase. De asemenea, trebuie făcute tăieri cu atenție pentru a evita mușchii și vasele adiacente, glandele și adiposul. Acest lucru va preveni contaminarea probei de adipos alternativ, țesut glandular, mușchi sau sânge.
Limitarea majoră a izolării și exciziei depozitelor adipoase, în această metodă și în alte metode comparabile, se găsește în definirea limitelor anumitor depozite. Datorită granițelor slab definite în depozite, cum ar fi depozitele subcutanate, izolarea lipsită de o cantitate mică de contaminare din adiposul vecin poate fi o provocare. O altă limitare poate fi găsită în asigurarea colectării unui țesut suficient pentru experimentarea suplimentară în depozitele asociate vasculare. Această limitare necesită uneori punerea în comun a eșantioanelor, deși aceasta depinde de locul de izolare și de dieta asociată animalului.
După ce depozitele adipoase sunt izolate, acestea pot fi utilizate pentru o varietate de teste. Adiposul poate fi utilizat pentru studii moleculare, cum ar fi expresia proteinelor, activitatea enzimei și analiza expresiei genelor. În plus, se pot izola adipocitele pentru studii de linie celulară primară in vitro. Liniile celulare nemurite pot fi, de asemenea, utilizate pentru studii in vitro, cu toate acestea, celulele nemuritoare nu sunt la fel de credibile ca liniile celulare primare izolate. În cele din urmă, adiposul poate fi fixat sau înghețat în TTPM pentru examinarea histologică pentru a identifica infiltrarea leucocitelor, localizarea proteinelor, precum și caracterizarea morfologiei adipocitelor.
Dezvăluiri
Autorii declară că nu au interese financiare concurente sau alte conflicte de interese.
- Identificarea și disecarea diverselor protocoluri de depozite adipoase de șoarece
- Componentele amare de hamei maturate induc termogeneza în țesutul adipos maro prin nervul simpatic
- Identificarea ciupercilor homarului (Hypomyces lactifluorum); Informații
- Există un rol de nutriție pentru farmaciști
- Cina hawaiană de foaie de pui - O viață drăguță în suburbii