Aamer M. Qazi 1,2, Rabia Tabassum 1, Fatima Arshad 1, Aysha Shaukat 1, Warda Qazi 1, Muhammad Tahir Javaid 1,2, Abdul Manan 2
Contribuții: (I) Concepție și proiectare: AM Qazi; (II) Sprijin administrativ: AM Qazi; (III) Furnizarea de materiale de studiu sau pacienți: AM Qazi, R Tabassum, W Qazi, MT Javaid, A Manan; (IV) Colectarea și asamblarea datelor: AM Qazi, F Arshad, A Shaukat; (V) Analiza și interpretarea datelor: AM Qazi, R Tabassum, MT Javaid, A Manan; (VI) Scrierea manuscriselor: Toți autorii; (VII) Aprobarea finală a manuscrisului: Toți autorii.
Abstract: Deși o serie de factori pot influența reglarea, precizia și eficacitatea căilor biologice vitale, rolul dietei/nutriției nu poate fi ignorat. Nutriția oferă energie și materie primă pentru procesele esențiale ale vieții. O dietă echilibrată duce la un rezultat sănătos nu numai la nivel sistemic, ci și la nivel celular și molecular. Alimentele sănătoase pot avea, de asemenea, un impact semnificativ asupra reparării și vindecării sistemului biologic. Cu toate acestea, anumite tipuri și cantități de dietă sunt, de asemenea, un factor de risc pentru diferite afecțiuni. Modelele dietetice moderne, precum și lipsa activității fizice influențează modelul global al bolii. Nutrigenomica a relevat interacțiunea funcțională dintre nutrienți (macronutrienți și micronutrienți) și genomii individuali. Acest articol trece în revistă literatura științifică recentă pentru a înțelege dacă și cum ar ajuta nutriția în menținerea integrității genomice, supravegherea imunitară adecvată și prevenirea cancerului.
Cuvinte cheie: Inflamaţie; cancer; Deteriorarea ADN-ului; nutrienți; nutrigenomică; nutrigenetică
Primit: 06 aprilie 2019; Acceptat: 07 februarie 2020; Publicat: 15 iunie 2020.
Introducere
Dieta nu este doar esențială pentru supraviețuirea organismelor vii, ci tipul dietei și cantitatea dietei afectează performanța, acuratețea și durata de viață a diferitelor sisteme biologice, precum și sănătatea generală și durata de viață a organismului viu.
Îmbătrânire
Sistem nervos
Ficat
Nutrienții ajută procesele celulare vitale
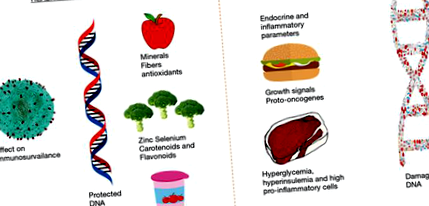
Sinteza blocurilor de construcție este necesară pentru reacțiile vitale din corpul nostru. Deoarece nutriția oferă energie și materie primă pentru aceste elemente de bază, tipul de dietă joacă un rol important în procesele celulare vitale. De exemplu, vitamina A este un nutrient important pentru ochii sănătoși, iar calciul este esențial pentru rezistența oaselor. Pentru sinteza ADN sunt necesare vitamine B3, B12 și acid folic în cantitate suficientă (22). Lipsa acestor vitamine duce la producția slabă de ADN care ar putea avea impact asupra menținerii integrității genomice, stabilității și viabilității celulare. Multe alte substanțe nutritive joacă un rol important, cum ar fi zincul este important pentru formarea structurii ADN (23), iar seleniul joacă un rol important ca o componentă a anumitor gene supresoare tumorale (24,25) (Figura 1). Deficitul de acid folic este asociat cu o serie de anomalii, inclusiv leziuni genetice, îmbătrânire prematură, boli de inimă și anumite tipuri de cancer (26). Deficitul de vitamina D poate duce la osteoporoză și este, de asemenea, asociat cu boli precum cancerul (27), diabetul zaharat (28,29) sau scleroza multiplă (30).
Impactul factorilor alimentari asupra inflamației și deteriorării ADN-ului și integrității
ADN-ul se poate deteriora într-o varietate de moduri prin interferarea cu activitatea normală a genelor. Daunele pot include radicalii liberi, erori de replicare în ADN sau erori de transcripție; îmbătrânirea și pielea ridată sunt semnele deteriorării ADN-ului. Deteriorarea ADN-ului poate apărea în toate organele la viteze diferite, ceea ce crește șansele de anomalie sistemică (31,32).
Moleculele instabile, cum ar fi radicalii liberi, sunt responsabile pentru îmbătrânirea și deteriorarea ADN-ului. Radicalii liberi se formează în organism ca un produs secundar al diferitelor procese biochimice, cum ar fi descompunerea alimentelor, infecția și detoxifierea substanțelor chimice periculoase. Unii poluanți, cum ar fi fumul de țigară, evacuarea automobilelor, fumurile copiatorilor și alți poluanți ai aerului liber. Radiațiile UV și razele X sunt, de asemenea, responsabile pentru generarea de radicali liberi. Diferite teorii sugerează că fiecare celulă a corpului este capabilă să genereze mii de radicali liberi. Deteriorarea radicalilor liberi nu apare decât la vârsta de douăzeci și șapte de ani. După aceea, daunele radicalilor liberi încep să apară. Odată cu creșterea numărului de radicali liberi, aceștia se acumulează în diferite poziții pe ADN. Daunele cauzate de fumatul țigării sunt localizate în plămâni, unde pot apărea niveluri ridicate de mutație a ADN-ului (33,34).
Mitocondriile sunt dependente de majoritatea sistemului de fosforilare oxidativă (OXPHOS) pentru genomul nuclear și sunt, de asemenea, utilizate pentru menținerea și reproducerea ADN-ului mitocondrial (ADNmt), precum și a proliferării și distrugerii organelor (35). Când apare deteriorarea ADN-ului, acesta declanșează diferite anomalii, de exemplu, detașarea și autofagia mitocondrială ulterioară, pierderea reparării ADN-ului, histopatologia și alte infecții degenerative (36). Astfel, deteriorarea genomului mitocondrial are ca rezultat modificări stabile și dăunătoare integrității. Prin urmare, menținerea integrității ADNmt este fundamentul unei vieți sănătoase. Nutriția poate juca un rol crucial în controlul integrității ADNmt și extinderea speranței de viață.
Subnutriție și deteriorarea ADN-ului
Foamea și malnutriția sunt una dintre cele mai copleșitoare probleme cu care se confruntă mai multe țări. Aproape 30% dintre oameni suferă de una sau mai multe forme de foame (37). Rezultatele teribile ale subnutriției constau în deces, dizabilitate și creștere mentală și fizică uimită. Dintre copiii din țările dezvoltate, aproximativ 60% din cele 10,9 milioane de decese pe an sunt identificate cu o lipsă de hrană sănătoasă (38). Cauzele care stau la baza malnutriției includ sărăcia și inegalitatea. Planificarea nutrițională poate elimina doar aceste cauze care necesită acțiune politică și socială. Diverse suplimente alimentare contracarează starea de sănătate, precum și diminuează diferite anomalii cronice (39).
Legătura dintre dietă și instabilitatea genomică sugerează un efect important sau preventiv al diferiților factori dietetici. Deteriorarea ADN-ului, epigenomul și nivelurile cromozomiale sunt cauzele care stau la baza tulburărilor de dezvoltare și degenerative. Sute de gene complică și mențin integritatea genomică (40). Proteinele codificate prin traducerea ADN-ului și repararea ADN-ului sau detoxifierea toxinelor potențial genetice se bazează pe cofactorii necesari unei funcții optime, prezenți în dietă (41). Instabilitatea genomică excesivă cauzată de deficiențele micronutrienților poate fi diagnosticată utilizând biomarkeri de deteriorare a ADN-ului și poate optimiza starea nutrițională prin reducerea ratelor de deteriorare a genomicii și epigenomului după intervenția diagnosticului (42).
Acidul folic, complexul B și alte minerale în sinteza și repararea ADN-ului
Micronutrienții (vitamine și minerale) sunt necesare ca cofactor pentru proteine asociate cu sinteza și repararea ADN, contracarând daunele oxidative ale ADN-ului. Orice deficiență de micronutrienți, cum ar fi acidul folic, complexul B, fierul, zincul și alte minerale, duce la leziuni citotoxice sau leziuni oxidative. Lipsa micronutrienților poate duce la deteriorarea ADN-ului, creșterea malignă și alte anomalii degenerative (43). Insuficiența acidului folic determină acumularea de uracil în ADN-ul uman provocând rupturi cromozomiale. Astfel de pauze cromozomiale sunt un factor de prognostic robust pentru cancerul uman. Deficitul de acid folic poate fi principala cauză a leucemiei limfoblastice acute. Administrarea de acid folic poate inversa nivelurile ridicate de uracil ale ADN-ului uman și rupturile cromozomiale (44). La fel ca deficitul de folat, deficitul de B12 duce la acumularea de uracil în ADN și rupturi cromozomiale. Aceste două defecte pot juca un rol sinergic. Studiile au arătat că suplimentele B12 sunt importante pentru limitarea pauzelor cromozomiale (45). Insuficiența B6 se atribuie accidentului vascular cerebral și aterosclerozei și este, de asemenea, asociată cu pauze cromozomiale. Suplimentele B6 reduc aceste riscuri (46).
Niacina (Vitamina B3) ajută la repararea defectelor de rupere a ADN-ului prin menținerea nivelurilor de nicotinamidă adenină dinucleotidă (NAD), menținând astfel reacția ploy-ADP riboză la deteriorarea ADN-ului (47). Deficitul de niacină poate afecta golurile și repararea ADN-ului, astfel încât este de așteptat ca acțiunea sinergică a folatului și a deficitului de antioxidanți să provoace deteriorarea ADN-ului și creșterea malignă (48). Seleniul este esențial pentru rezistența enzimatică la oxidanți și seleniul insuficient poate provoca deteriorarea ADN-ului oxidativ. Seleniul joacă un rol important în prevenirea cancerului (49). Deficitul de zinc este o cauză a cancerului esofagian uman. Consecințele sunt creșterea oxidării ADN-ului, ruperea ADN-ului și creșterea leziunilor cromozomiale (50).
Obezitate, osteoartrita și sindromul metabolic
Modificările stilului de viață și ale expunerilor la mediu sunt factori majori în patogenie și în sindromul metabolic. Mai mult, obezitatea și sindromul metabolic asociate cu inflamația, dislipidemia și diabetul rezistent la insulină sau complet dezvoltat și un risc crescut de tulburări cardiovasculare sunt, de asemenea, afectate de susceptibilitatea genetică (51). Astfel de factori metabolici pot crește riscul de osteoartrită indusă de obezitate (52). Obezitatea este predominant o consecință naturală a supra-nutriției și a stilurilor de viață sedentare. Obezitatea persistentă poate deregula procesele metabolice și poate afecta grav procesul de control al zahărului din sânge, al tensiunii arteriale și al lipidelor din sânge, astfel fiind denumit sindrom metabolic (53). Obezitatea este, de asemenea, considerată a fi un factor de risc pentru osteoartrita. Contribuția sa se poate datora diferitelor mecanisme astringente care duc la distrugerea cartilajului. În ciuda acestui fapt, progresele recente au arătat că celulele adipoase creează un număr mare de elemente numite adipokine care au un rol cheie în dezvoltarea și progresia osteoartritei (54).
Popkin și Doak (55) au raportat că în mai multe țări dezvoltate prevalența obezității a crescut de la 2,3% la 19,6% în ultimele 10 decenii. Rata obezității în Orientul Mijlociu, insula Pacificului, Australia și China a crescut din 1980 (56). Cu sprijinul guvernului și al activității legislative, diferite strategii de sănătate constând din inițiative individuale și comunitare, vor contribui, de asemenea, la reducerea incidenței obezității și a tulburărilor metabolice în țările în curs de dezvoltare.
Subnutriție, inflamație și imunodeficiență
Bolile microbiene ale celulelor inițiază o reacție provocatoare. Impresia de bază a bolii este mediată de receptori înnăscuti de recunoaștere a modelelor (PRR) care conțin receptori de tip Toll (TLR), receptori RIG (RLR), receptori NOD (NLR) și receptori de lectină de tip C (CLR). Această cascadă de semnalizare intracelulară activată de aceste PRR determină expresia transcripției pentru a elimina agenții patogeni și celulele infectate. Cu toate acestea, acest sistem este activat anormal prin inducerea autoimunității și imunodeficienței (57).
Deficitul de malnutriție este cauza deficienței secundare, cum ar fi malnutriția proteinelor afectează imunitatea mediată celulară, fagocitoza și consumul de microorganisme este intact, dar capacitatea celulelor fagocitice de a ucide organismele intracelulare este afectată. Deficiențele nutriționale pot duce la cancer, boli renale cronice, leziuni multiple și infecții cronice. Deficitul de zinc și fier are efecte multiple asupra imunității, inclusiv reducerea întârziată a hipersensibilității cutanate.
Suplimentele vitaminice (B6, B12), seleniul și cuprul sunt, de asemenea, importante pentru sistemul imunitar. Acum se crede că stresul oxidativ este asociat cu toate bolile provocatoare (inflamații articulare, vasculită glomerulonefrită și boli respiratorii la adulți), boli ischemice, SIDA, emfizem, transplant de organe, ulcer gastric, hipertensiune arterială, tulburări neurologice (boala Alzheimer, boala Parkinson ), distrofie musculară) și așa mai departe (61). Stresul oxidativ apare din cauza neregulilor dintre apărarea antioxidantă și producția de radicali liberi. Producția mai mare de ROS în organism poate modifica structura ADN-ului, ducând la modificarea proteinelor și lipidelor, activarea factorilor de transcripție induși și producerea de citokine pro-inflamatorii și antiinflamatorii (62). Antioxidantul poate reduce stresul oxidativ prin eliminarea directă a ROS sau inhibarea proliferării celulare. B-carotenul previne carcinogeneza indusă de UV. β-carotenul poate avea un impact anticancer prin modificarea metabolismului hepatic al agenților cauzatori de cancer (63).
Vitaminele C ajută la prevenirea cancerului. Mecanismul său poate influența carcinogeneza datorită caracterului său antioxidant, blochează formarea nitrozaminelor, îmbunătățește răspunsul imun și accelerează procesul de detoxifiere a ficatului (64). Vitaminele E sunt un antioxidant principal care crește lichidul corporal, producția de anticorpi, infecția anti-bacteriană, imunitatea mediată celular, limfocitul T, factorul de necroză tumorală (TNF), inhibarea formării mutagene, repararea membranelor și blocarea formării liniei de microcelule. În consecință, vitamina E poate fi utilizată pentru a preveni creșterea malignă și pentru a reprima carcinogeneza prin stimularea sistemului imunitar (65). Prin urmare, nutriția poate contribui la extinderea răspunsului inflamator la limitele expunerii la agenți patogeni, toxine și leziuni tisulare. Componentele dietetice, cum ar fi vitaminele, antioxidanții, flavonoidele din plante, prebioticele și probioticele, au toate potențialul de a modifica susceptibilitatea inflamației cronice și pot funcționa în tratament.
Un tip divers de nutrienți afectează performanța ADN-ului. Mai mulți nutrienți precum zincul, acidul folic, vitamina D, flavonoidele și carotenoizii afectează sănătatea ADN-ului. Diferite vitamine afectează sănătatea ADN-ului, cum ar fi vitamina A influențează creșterea și diferențierea celulelor. Complexul de vitamina B este implicat în repararea, sinteza și reglarea ADN-ului. Alte vitamine importante sunt vitamina C, D și E. Mineralele precum zincul, cromul și seleniul sunt importante pentru sănătatea ADN-ului (66,67).
Acțiunea suplimentelor alimentare asupra cancerului
Au fost identificate mai multe gene care cauzează cancer și pot fi suprimate printr-o varietate de mecanisme. gena p53 este una dintre genele supresoare ale cancerului. Gena p53 este implicată în inhibarea celulelor canceroase, atunci când este activată. Mutațiile genei p53 au fost identificate în mai mult de cincizeci de tipuri de cancer. Alți factori implicați sunt acidul folic și seleniul care ajută la menținerea activității normale și a stabilității genetice a p53. O altă genă, GST, care codifică enzimele glutation-S-transferază, este de asemenea implicată în prevenirea cancerului. Funcționează ca un antioxidant care ajută la protecția împotriva deteriorării radicalilor liberi. De asemenea, oferă protecție împotriva deteriorării substanțelor chimice periculoase. Polimorfismul VDR (receptorul vitaminei D) este, de asemenea, asociat cu un risc crescut în cancerul de sân, prostată și colon (68-70).
Într-o anumită măsură, cancerul poate fi controlat printr-o varietate de stiluri de viață și suplimente nutritive. Legumele și fructele prezintă un risc scăzut de majoritate a cancerelor. Plantele sunt o sursă bogată de antioxidanți, care ajută la protejarea deteriorării ADN-ului. Un alt antioxidant puternic este glutation peroxidaza și componenta sa importantă este seleniul. Aceste molecule de seleniu protejează ADN-ul de radicalii liberi. Sucinat natural, o formă de vitamina E are un puternic efect anticancerigen (71). Procesele de reparare a ADN-ului și suprimarea oncogenelor sunt menținute de vitamina B6 și B12. Coenzimele Q10 sunt un nutrient asemănător vitaminei care acționează ca un antioxidant protector. Crește activitatea celulelor imune pentru a combate celulele canceroase (72). Pentru tratamentul cancerului, unii medici orientați nutrițional folosesc cantități mari de vitamine și minerale cu combinația altor terapii medicale convenționale. Cancerul de col uterin a fost tratat prin utilizarea vitaminei E, a co-enzimei Q10, a vitaminei C, a beta-carotenului, a carotenoidelor mixte și a vitaminei A în combinație cu terapia medicală. Acești nutrienți nu afectează cancerul, ci stimulează sistemul imunitar al pacientului pentru a combate celulele canceroase (73).
Concluzie
Antioxidanții naturali din dietă joacă un rol crucial în mai multe căi metabolice care afectează progresia bolii. Dieta pe bază de plante, fructele și legumele, sunt o sursă bogată de fibre, antioxidanți și acizi grași sănătoși, care sunt asociați cu un risc redus de orice tulburare. Multe substanțe prezente în fructe și legume sunt de natură protectoare pentru sistemul biologic. Prin urmare, este posibil ca întregul efect să nu se datoreze nici unui singur fitochimic sau nutrient.
Componentele unei diete echilibrate, cum ar fi compușii bioactivi, pot reconfirma expresia unei gene care ar putea fi reglementată în sus sau în jos. Aportul de nutrienți este considerat semnificativ pentru a atenua riscul de apariție a unei boli pe baza profilului genetic al individului. Nutrigenetica/genomica poate fi folosită pentru a manipula o dietă personalizată pentru fiecare pacient. Mai multe studii au raportat modificarea metabolismului în toate tulburările, în special în cazul cancerului, care prezintă o utilizare ridicată a energiei metabolice, împreună cu o producție crescută de ROS. Moleculele alimentare acționează ca ligand împotriva mai multor ținte din sistemul biologic. Aceste ținte ar putea fi atât extracelulare, cât și intracelulare.
Mulțumiri
Notă de subsol
Provenance and Peer Review: Acest articol a fost comandat de editorii invitați (Masood A. Shammas, Pierfrancesco Tassone și Bisweswar Nandi) pentru seria „Instabilitate genomică, evoluție clonală și oncogeneză” publicată în Precision Cancer Medicine. Articolul a fost trimis pentru o evaluare inter pares externă organizat de editorii invitați și redacție.
Conflicte de interese: Toți autorii au completat formularul de divulgare uniformă ICMJE (disponibil la http://dx.doi.org/10.21037/pcm.2020.02.01). Seria „Instabilitate genomică, evoluție clonală și oncogeneză” a fost comandată de redacție fără finanțare sau sponsorizare. Autorii nu au conflicte de interese de declarat.
Declarație etică: Autorii sunt responsabili pentru toate aspectele lucrării, asigurându-se că întrebările legate de acuratețea sau integritatea oricărei părți a lucrării sunt investigate și rezolvate în mod corespunzător.
- Prelegere publică - Dieta; Boală Explorarea relației dintre nutriție și cancer - Răceală
- SNR # 169 Chad Macias - Metabolismul cancerului; Atenție față de cetonele dietetice ketogene; Sigma Nutrition
- Gastroenterologie și nutriție pediatrică Weill Cornell Medicine
- Rețetă de proteine; Nutriție Nutriție de precizie; s Enciclopedia Alimentelor
- Interviu cu masa rotundă 3 persoane pe care ar trebui să le ascultați, partea 1 Precision Nutrition