Robert H. Lustig
1 Departamentul de Pediatrie, Universitatea din California San Francisco, San Francisco, CA, SUA
Abstract
Obezitatea este o complicație obișnuită după terapia cu craniofaringiom, care apare la până la 75% dintre supraviețuitori. Creșterea în greutate este diferită de cea a obezității normale, prin aceea că apare chiar și cu restricție calorică, iar încercările de modificare a stilului de viață sunt inutile pentru a preveni sau trata obezitatea. Patogeneza acestei afecțiuni implică incapacitatea de a transduce semnalele hormonale aferente de adipozitate, imitând efectiv o stare de înfometare a SNC. Activitatea simpatică eferentă scade, ducând la stări de rău și reducerea cheltuielilor de energie, iar activitatea vagală crește, rezultând creșterea secreției de insulină și a adipogenezei. Intervenția în stilul de viață este în esență inutilă în acest sindrom, denumit „obezitate hipotalamică”. Tratamentul farmacologic este, de asemenea, dificil, constând din substanțe adrenergice pentru a imita activitatea simpatică sau suprimarea secreției de insulină cu octreotidă sau ambele. Recent, chirurgia bariatrică (by-pass gastric Roux-en-Y, bandare gastrică laparoscopică, vagotomie truncală) a fost de asemenea încercată cu rezultate variabile. Este necesar un management precoce și intensiv pentru a atenua obezitatea și consecințele sale negative.
Introducere
Când vine vorba de tumori cerebrale, prevalează cele trei legi ale proprietății imobiliare din New York: „Locație, locație, locație”. Craniofaringioamele sunt mai puțin problematice pentru ceea ce sunt decât pentru locul în care se află. Hipotalamusul, așa cum este adevărat pentru majoritatea sistemelor hormonale, este sediul anatomic al reglării energiei periferice. Când hipotalamusul este deteriorat, apare un sindrom de creștere în greutate intratabil. Acest sindrom, denumit „obezitate hipotalamică”, descris inițial de Babinski (1900) și Frohlich (1901) la începutul secolului al XX-lea, documentează „organicitatea” obezității. Obezitatea hipotalamică poate apărea din cauza tumorii în sine, a intervenției chirurgicale pentru extirparea acesteia sau a radioterapiei ulterioare (Bray, 1984; Lustig, 2002). Deși această comorbiditate se manifestă de obicei la copii datorită incidenței crescute a tumorilor localizate în fosa posterioară (Stahnke și colab., 1984; Sorva, 1988; Pinto și colab., 2000), adulții pot prezenta, de asemenea, creșteri în greutate similare după finalizare . de terapie (Daousi și colab., 2005). Craniofaringiomul reprezintă jumătate din cazurile raportate, alte tumori de fosă posterioară contribuind fiecare cu un număr mai mic. Cu toate acestea, sindromul a fost raportat și în cazuri de pseudotumor cerebral, traume și boli infiltrative sau inflamatorii ale hipotalamusului (Bray, 1984).
Incidența și factorii de risc
Obezitatea hipotalamică poate apărea ca răspuns la orice leziune hipotalamică. Majoritatea studiilor au fost efectuate în populația supraviețuitoare a leucemiei limfoblastice acute (LUC) (Lustig, 2002; Rogers și colab., 2005), în care obezitatea se poate datora mai multor factori, inclusiv glucocorticoizi și modificări ale activității. Cu toate acestea, majoritatea acestor studii documentează o creștere anormală a greutății la înălțime mult timp după ce terapia tumorală a fost întreruptă și multe dintre aceste studii demonstrează că radiația craniană este un factor de risc important (Lustig, 2002).
Mai recent, Müller și colab. (2011), respectiv, au evaluat datele rezultatelor pe termen lung pe baza de date Kraniopharyngeom din Germania. În această analiză, implicarea hipotalamică preoperatorie a fost implicată în mod specific în dezvoltarea obezității hipotalamice postoperatorii, sugerând din nou că localizarea tumorii este cel mai important factor de risc pentru obezitate.
Calea de feedback negativ a bilanțului energetic
Studiile pe animale care elaborează calea de echilibru energetic cu feedback negativ au prezis patogeneza și simptomatologia obezității hipotalamice. Acest lucru poate fi cel mai bine descris ca „rezistență organică la leptină”; adică un eșec în semnalizarea leptinei în brațul aferent, din cauza leziunilor hipotalamice; conducând la disfuncție autonomă în brațul eferent, promovând cheltuieli de energie inadecvate și stocare excesivă de energie.
Brațul aferent
În schimb, în starea de repaus alimentat, secreția gastrică de grelină este crescută (Kamegai și colab., 2000; Tschöp și colab., 2000), în timp ce nivelurile de leptină, insulină și PYY sunt scăzute, ceea ce duce la stimularea căii orexigenice (NPY)/AgRP) și antagonismul căii anorexigenice (α-MSH/CART). Lipsa rezultată a presiunii anorexigenice asupra MC4R are ca rezultat un comportament crescut de hrănire și o eficiență energetică (cu oxidare redusă a grăsimilor), pentru a stoca substratul energetic ca grăsime. Acest lucru se realizează prin transducția semnalului în calea eferentă, constând din sistemul nervos simpatic (SNS) și vag (vezi mai jos).
Brațul eferent
Din PVN și LHA, proiecții eferente sinapsă în locus coeruleus (LC), care controlează SNS; și în nucleul motor dorsal al vagului (DMV), care controlează nervul vag, ieșirea principală a sistemului nervos parasimpatic.
În starea completă de energie, nivelurile ridicate de leptină și insulină determină brațul anorexigenic să activeze SNS (Muntzel și colab., 1994; Vollenweider și colab., 1995; Rahmouni și colab., 2003). Stimularea receptorilor β2-adrenergici de către SNS (Blaak și colab., 1993) măresc expresia a numeroase gene din mușchiul scheletic (Viguerie și colab., 2004), care promovează biogeneza mitocondrială, glicogenoliza, termogeneza și mișcarea crescută (Boss et. al. al., 1999; Lowell și Spiegelman, 2000), toate asociate cu creșterea cheltuielilor de energie (Collins și colab., 1996). SNS activează, de asemenea, adrenoreceptorii α2a- și α2c pe celula β, care stimulează Gi și inhibă adenil ciclaza, AMPc inferior și mențin canalele de potasiu într-o configurație deschisă cu un potențial negativ de membrană de repaus (Sharp, 1996), pentru a reduce secreția de insulină pancreatică și, astfel, reduce depunerea de energie în țesutul adipos. În cele din urmă, activarea SNS stimulează receptorul β3-adrenergic de pe adipocit pentru a promova lipoliza (Susulic și colab., 1995). Aceste evenimente simpatice coordonate servesc la reducerea expresiei și secreției de leptină a țesutului adipos; astfel se formează o buclă de feedback negativ cu sistemul aferent (Figura 1).
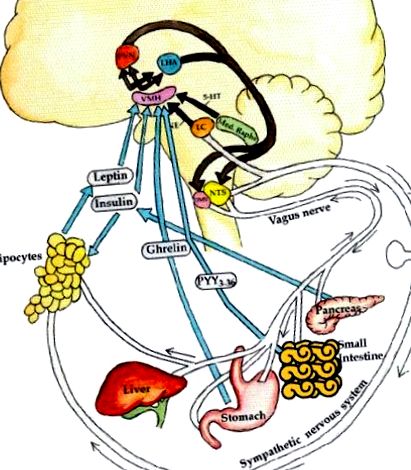
Reglarea neuroendocrină a echilibrului energetic. Sistemul aferent: semnalele neuronale (de exemplu, vagale) și hormonale (grelină, insulină, leptină) sunt generate din ficat, intestin, pancreas și adipos. În plus, se elaborează norepinefrină din locus cœruleus și serotonină (5-HT) din rafa mediană. Aceste semnale de sațietate vs. foamea și slăbiciunea vs. grăsimea este interpretată în hipotalamusul ventromedial (VMH). Aceste semnale sunt apoi integrate în nucleul paraventricular (PVN) și hipotalamusul lateral (LHA). Sistemul eferent: semnalele eferente din aceste zone stimulează la rândul lor sistemul nervos simpatic (SNS) să cheltuiască energie prin activarea receptorilor β3-adrenergici și decuplarea proteinelor în adipocit, pentru a elibera energie sub formă de lipoliză, căldură sau activitate fizică. Dimpotrivă, sistemul nervos parasimpatic (vagal eferent) crește secreția de insulină, cu adipogeneza rezultată și stocarea energiei, și crește, de asemenea, sensibilitatea la insulină prin efecte directe asupra țesutului adipos (Lustig, 2006). De la Nature Publishing Group, cu permisiunea.
În schimb, în starea de repaus alimentar, leptina și insulina sunt scăzute, ducând la reducerea tonusului SNS și la termogeneza musculară scheletică redusă și la lipoliza țesutului adipos redusă. În plus, LHA și PVN trimit proiecții eferente care locuiesc în fasciculul longitudinal medial către nervul DMV (Powley și Laughton, 1981). Prin încetinirea ritmului cardiac, vagul reduce consumul de oxigen miocardic. Prin efectele sale asupra tractului digestiv, vagul promovează peristaltismul și absorbția substratului energetic. Prin efectele sale asupra adipocitului, vagul promovează creșterea activității lipoproteinelor lipazice pentru a crește clearance-ul substratului energetic în țesutul adipos (Boden și Hoeldtke, 2003). În cele din urmă, prin efecte asupra celulei β (D'Alessio și colab., 2001), vagul accentuează hipersecreția de insulină postprandială ca răspuns la o masă, care promovează depunerea de energie în adipocit (Rohner-Jeanrenaud și Jeanrenaud, 1985; Marin et. al., 1988; Peles și colab., 1995; Lustig, 2003). Neurotransmisia vagală hiperactivă crește secreția de insulină prin trei mecanisme distincte, dar suprapuse (Gilon și Henquin, 2001; Figura Figura 2):
1. Arderea vagală crește disponibilitatea acetilcolinei și legarea de receptorul muscarinic M3 de pe celula β, care este cuplată la un canal de sodiu din membrana celulei β pancreatice (Miura și colab., 1996). Pe măsură ce glucoza intră în celula β după ingestia unei mese, enzima glucokinază fosforilează glucoza pentru a forma glucoză-6-fosfat. Acest lucru crește generarea de ATP intracelular, care induce închiderea canalului de potasiu dependent de ATP al celulei β. La închiderea canalului, celula β se confruntă cu o depolarizare a celulei β dependente de concentrația ATP (Nishi și colab., 1987; Zawalich și colab., 1989) și deschiderea unui canal de calciu separat cu tensiune în membrană. Afluxul intracelular de calciu crește acut, ceea ce duce la exocitoza veziculară rapidă a insulinei. Deschiderea concomitentă a canalului de sodiu prin acetilcolină derivată vag crește depolarizarea celulelor β, care mărește influxul intracelular de calciu și are ca rezultat hipersecreția insulinei (Berthoud și Jeanrenaud, 1979; Komeda și colab., 1980; Rohner-Jeanrenaud și Jeanrenaud, 1980 ).
2. Acetilcolina mediată vag crește fosfolipazele A2, C și D, în celula β, care hidrolizează fosfatidilinozitolul intracelular în diacilglicerol (DAG) și inozitol trifosfat (IP3; Gilon și Henquin, 2001). DAG este un puternic stimulator al protein kinazei C (PKC; Tian și colab., 1996) care fosforilează substratul proteic kinază C bogat în alanină miristoilat (MARCKS), care leagă apoi actina și calciu-calmodulina și induce exocitoza veziculară a insulinei (Arbuzova et. al., 1998). IP3 potențează eliberarea de calciu în celulele β din depozitele intracelulare, care promovează și secreția de insulină (Blondel și colab., 1994).
3. Vagul stimulează, de asemenea, eliberarea peptidei-1 de tip glucagon (GLP-1) din celulele L intestinale, care circulă și se leagă de receptorul GLP-1 al celulei β. Activarea acestui receptor induce o adenil ciclază sensibilă la calciu-calmodulină, cu generare de AMPc, care activează proteina kinază A (PKA), stimulând fosforilarea proteinelor veziculare, cu rezultată exocitoză de insulină (Kiefer și Habener, 1999).
În acest fel, sistemul aferent este antrenat cu sistemul eferent de un servo-mecanism complicat pentru a coordona semnalele centrale și periferice fie pentru apetitul și stocarea energiei, fie pentru sațietate și cheltuială de energie.
Patogenia obezității hipotalamice
Modelele șobolanilor de leziuni hipotalamice, fie datorate leziunilor electrolitice bilaterale, fie dezaferențierea VMH, conduc la creșterea greutății intratabile (Berthoud și Jeanrenaud, 1979; Rohner-Jeanrenaud și Jeanrenaud, 1980; Bray și colab., 1981; Jeanrenaud, 1985; Satoh et al., 1997), chiar și după restricționarea alimentelor (Bray și Nishizawa, 1978). În mod similar, copiii cu obezitate hipotalamică prezintă creștere în greutate, chiar și ca răspuns la restricția calorică forțată (Bray și Gallagher, 1975). Acest lucru pare paradoxal, deoarece ne-am aștepta că dacă hiperfagia ar fi motivul obezității, atunci restricția calorică ar fi eficientă în prevenirea creșterii în greutate. De fapt, analiza aportului de energie la copiii cu obezitate hipotalamică nu demonstrează nicio diferență vs. controlul pacienților cu obezitate simplă (Harz și colab., 2003). În schimb, atât cheltuielile de energie în repaus (Shaikh și colab., 2008), cât și cheltuielile de energie voluntare (Harz și colab., 2003) sunt grav compromise la acești pacienți. Într-adevăr, cea mai proeminentă și preocupantă plângere la pacienții cu obezitate hipotalamică este oboseala persistentă, lipsa de energie și lipsa activității fizice. Această stare generală de rău nu se datorează hipopituitarismului, deoarece persistă chiar și după înlocuirea hormonală completă.
Scăderea cheltuielilor de energie este mediată prin suprimarea activității SNS de leziuni hipotalamice. Rapoarte recente demonstrează o capacitate afectată a acestor pacienți de a răspunde la epinefrină la hipoglicemia indusă de insulină (Schofl și colab., 2002; Coutant și colab., 2003) și documentează scăderea excreției de epinefrină la 24 de ore (Coutant și colab., 2003 ).), împreună cu scăderea acidului homovanilic urinar și a acidului vanililmandelic (Roth și colab., 2007); toate indicând scăderea tonului simpatic. Se crede că această stare de rău și scăderea tonusului simpatic ar putea duce la scăderea ratelor de lipoliză prin receptorul β3-adrenergic al adipocitului (al-Adsani și colab., 1997), ceea ce duce la scăderea cheltuielilor energetice de odihnă și voluntare.
În plus față de „rezistența organică la leptină”, este posibil ca acești pacienți să manifeste și „rezistență organică la grelină”, deoarece suprimarea foametei prin grelină poate fi atenuată la copiii cu obezitate hipotalamică (O'Gorman și colab., 2911). Acest lucru poate crește aportul total de alimente; deși modificările consumului total de alimente la acești pacienți nu diferă de controalele obeze sănătoase altfel (Harz și colab., 2003).
Diagnostic
O analiză retrospectivă a înregistrărilor de creștere a copiilor cu craniofaringiom (Muller și colab., 2004) indică faptul că creșterea în greutate și creșterea IMC este evidentă chiar înainte de diagnosticarea tumorii. Cu toate acestea, după operație sau radioterapie, creșterea în greutate este imediată, rapidă și extrem de exagerată. Dovezile depunerii aberante de energie sunt evidente în prima lună. Medicii confundă uneori această creștere în greutate cu efectul glucocorticoid și reduc doza de hidrocortizon de întreținere, care nu afectează obezitatea și face pacientul cu și mai multă oboseală și stare de rău.
Scatterplot de secreție de insulină (Răspunsul corectat la insulină sau CIRgp) vs. sensibilitate (Indicele de sensibilitate la insulină compozit sau CISI) reprezentată grafic logaritmic la 113 copii obezi non-diabetici. S-a observat o corelație liniară negativă (r = -0,54, p 2/an la 4,5 kg/m 2/zi), dar rata de creștere este încă destul de inacceptabilă pe care să ne bazăm (Rakhshani și colab., 2010).
Farmacoterapie
Deoarece hipotalamusul nu este supus terapiei și transducția aberantă a semnalului hormonal nu poate fi corectată, farmacoterapia trebuie să abordeze în schimb modificările căilor eferente. Câteva încercări de utilizare a inhibitorilor recaptării serotoninei sau norepinefrinei (de exemplu, fen-fen, fluoxetină, sibutramină) au fost întâmpinate cu eficacitate numai salutară (Molloy și colab., 1998). Un studiu a evaluat efectele sibutraminei 10-15 mg PO qd, cu un efect mic, dar reproductibil în IMC (Danielsson și colab., 2007); cu toate acestea, sibutramina a fost retrasă de pe piață. Aceste medicamente funcționează central pentru a reduce aportul de alimente, dar nu funcționează periferic pentru a stimula mușchii scheletici pentru a crește consumul de energie și, prin urmare, au o valoare limitată. Mason și colab. (2002) au folosit dextroamfetamină 5 mg PO bid, care acționează atât central, cât și periferic, și a obținut stabilitatea în greutate pentru un interval de 6 luni. Am observat, de asemenea, îmbunătățirea afectivității și a vigilenței, care este un beneficiu major al dextroamfetaminei.
În încercarea de a reduce hiperinsulinemia, Hamilton a încercat să trateze pacienții cu o combinație de diazoxid și metformină (Hamilton și colab., 2011). Creșterea în greutate de peste 6 luni a fost redusă în comparație cu pre-tratament; cu toate acestea, efectele secundare au fost semnificative, inclusiv edemul, și au existat unele întreruperi.
În încercarea de a reduce hiperinsulinemia și de a îmbunătăți simultan acțiunea insulinei, am examinat efectele octreotidei analogice a somatostatinei (un agonist al receptorului somatostatinei-5 pe celula β, care inhibă canalul de calciu cu tensiune; Figura Figura2). 2). Un studiu pilot, deschis, cu octreotidă 15 μg/kg/zi subcutanat timp de 6 luni la opt subiecți (Lustig și colab., 1999) a demonstrat pierderea IMC proporțional cu gradul de suprimare a insulinei, împreună cu scăderea aportului caloric și subiectivă. îmbunătățiri ale activității fizice spontane și ale calității vieții. Un studiu dublu-orb, controlat cu placebo, efectuat pe 20 de subiecți (Lustig și colab., 2003b) a dus la suprimarea insulinei și stabilizarea IMC, scăderea leptinei, scăderea aportului caloric, creșterea activității fizice spontane și îmbunătățirea calității vieții proporțional cu gradul de suprimare a insulinei. O analiză retrospectivă a demonstrat că octreotida a fost cea mai eficientă la acei pacienți care au prezentat atât hipersecreție de insulină cu sensibilitate continuă la insulină (Preeyasombat și colab., 2005).
Interventie chirurgicala
Severitatea și morbiditatea obezității la acești pacienți și lipsa relativă de alternative au dus la încercări de intervenție chirurgicală bariatrică. Inge și colab. (2007) au raportat o pierdere în greutate de 25 kg după ocolirea gastrică Roux-en-Y la un subiect, dar a cărei greutate s-a stabilizat la un nivel inacceptabil. Recent, Müller și colab. (2007) au raportat în formă abstractă experiența sa cu patru subiecți care au suferit o bandă gastrică reglabilă laparoscopic, cu reduceri ale consumului de alimente și reduceri lente ale IMC. În sfârșit, vagotomia poate fi eficientă în acest sindrom (Smith și colab., 1983), prin reducerea producției eferente atât la celulele beta, cât și la adipocite. Recent am efectuat vagotomie truncală laparoscopică la patru subiecți cu obezitate hipotalamică, rezultatele timpurii susținând această procedură și cu relativ puține complicații sau efecte secundare (Lustig și colab., 2009).
rezumat
Hipotalamusul interpretează semnale aferente pentru echilibrul energetic și le transformă în semnale eferente autonome pentru a consuma sau a stoca energia. Când acest sistem de feedback negativ se descompune, ca după terapia craniofaringiomului, apare fenomenul obezității hipotalamice. În timp ce această tulburare este un defect al căii aferente, tratamentul se concentrează pe calea eferentă, deoarece este modulabilă cu medicamente și tehnici chirurgicale disponibile în prezent. Medicii trebuie să explice pacienților riscurile acestei tulburări înainte de terapia tumorală și trebuie să fie dispuși să acționeze rapid și decisiv odată cu începerea creșterii în greutate, pentru a asigura un control intensiv, astfel încât obezitatea să nu se înrăutățească.
Declarație privind conflictul de interese
Autorul declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi construite ca un potențial conflict de interese.
- Epidemiologia, mecanismele și tratamentul bolilor renale și obezității Nature Reviews Nephrology
- Diagnosticul de obezitate la pacienți, utilizarea tratamentului chirurgical și costurile asociate în funcție de tipul de plătitor în
- Obezitate hipotalamică după intervenția chirurgicală a craniofaringiomului; Tratament cu un glucagon cu acțiune îndelungată, asemănător
- Hiperaldosteronism (Conn; s) Simptome, diagnostic și tratament John Wayne Cancer Institute
- Inflamarea hipotalamică și obezitatea o revizuire mecanicistă SpringerLink