Lei Wang 1,2, Shuangni Yu 3 și Anthony WH Chan 4 *
1 Departamentul de patologie, Universitatea Fudan Shanghai Cancer Center, Shanghai, China
2 Departamentul de Oncologie, Colegiul Medical din Shanghai, Universitatea Fudan, Shanghai, China
3 Departamentul de patologie, Spitalul Universitar Medical Medical din Beijing, Beijing, China
4 Departamentul de Patologie Anatomică și Celulară, Laboratorul cheie de stat în Oncologie din China de Sud, Spitalul Prince of Wales, Universitatea chineză din Hong Kong
* Autor corespondent: Anthony WH Chan
Profesor asociat, catedra de patologie anatomică și celulară
Spitalul Prince of Wales, Universitatea chineză din Hong Kong, Hong Kong
Tel: 852 2632-2352
Fax: 852 2637-4858
E-mail: [e-mail protejat]
Data primirii: 01 decembrie 2015 Data acceptată: 12 ianuarie 2016, Data publicării: 21 ianuarie 2016
Citare: Wang L, Shuangni Yu, Chan AWH și colab. Patologia bolii hepatice grase nealcoolice. Int J Dig Dis. 2016, 2: 1. doi: 10.4172/2472-1891.100014
Introducere
Modele patologice ale NAFLD
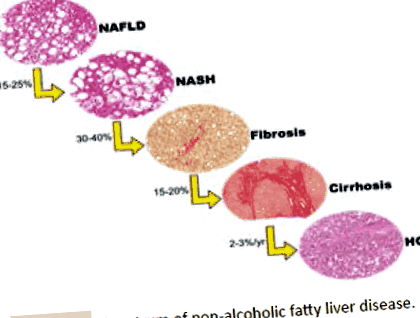
Multe date esențiale despre istoria naturală, caracteristicile clinice, managementul și caracteristicile patologice ale NAFLD au fost furnizate de Rețeaua de cercetare clinică a steatohepatitei nealcoolice [NASH-CRN]. NASH-CRN a propus mai multe tipare histologice ale NAFLD, care au fost deja aplicate pe scară largă în setările clinice și de cercetare [7] (figura 1).
Figura 1: Spectrul bolilor hepatice grase nealcoolice.
Steatoza cu sau fără inflamație
Figura 2: [A] Steatoză macroveniculară: Hepatocite cu predominant o singură picătură de grăsime de dimensiuni mari. [B] Steatoza macroveniculară: Hepatocite cu picături de grăsime multiple mici și mijlocii. [C] Necroză pătată: Un grup mic de limfocite mici și histiocite înlocuiește hepatocitele. [D] Balonare hepatocelulară: hepatocitele umflate prezintă rarefierea citoplasmei hepatocitare și a catenelor aglomerate de filamente intermediare. Unele suvite aglomerate de filamente intermediare sunt calificate drept corpuri Mallory-Denk. [E] Pierderea caracteristică a expresiei citoplasmatice în hepatocitele cu balon, unde imunoreactivitatea reziduală este limitată la corpurile lor Mallory-Denk [Imunohistochimia citokeratinei 8/18]. [F] Fibroză centrizonală și perisinusoidală [pete roșii Sirius]. [G] Lipogranulom. [H] Nucleuri glicogenate. [I] Carcinom hepatocelular steatohepatitic.
Gradul și distribuția steatozei într-o biopsie hepatică trebuie înregistrate în raportul patologic. Examinarea histologică cu putere redusă [adică, cel mult 10x și obișnuit 4x obiectiv] este suficientă pentru evaluare. Evaluarea steatozei la o putere mai mare trebuie evitată, deoarece severitatea steatozei poate fi supraevaluată. Gradul de steatoză este clasificat semi-cantitativ în 3 clase: ușoară [5 până la 33%], moderată (> 33 până la 66%) și marcată (> 66%) [11]. Gradul de steatoză este corelat cu inflamația lobulară și fibroza centrizonală și nu este asociat cu balonarea hepatocelulară, corpurile Mallory-Denk sau fibroza portală/avansată [12]. Distribuția zonală predominantă a steatozei trebuie de asemenea comentată, cu excepția cazului în care steatoza este prea ușoară sau biopsia este prea fragmentată. Există 4 modele diferite de distribuție zonală: zona 3 (centrizonală), zona 1 (periportal), periacinar panacinar și azonal. Zonele 3 și modelele de distribuție panacinară sunt modele obișnuite la NAFLD la adulți. Distribuția predominantă a zonei 1 este rară la pacienții adulți [1%], dar mai frecvent la copii și adolescenți [12%] [11]. Distribuția azonală este mai frecvent întâlnită în bolile mai severe cu balonare hepatocelulară, corpuri Mallory-Denk și fibroză avansată [12].
Steatohepatită la limită
Ciroza criptogenă
Ciroza criptogenă se stabilește după excluderea hepatitei virale, a bolilor hepatice metabolice, autoimune și colestatice după o evaluare extinsă. Este o indicație comună pentru transplantul hepatic și reprezintă 7-14% dintre pacienții care necesită transplant hepatic. NAFLD este una dintre principalele cauze ale cirozei criptogene [29]. Prevalența diabetului zaharat și a obezității la pacienții cu ciroză criptogenă este similară cu cea a pacienților cu NAFLD și o depășește cu mult pe cea a pacienților cu ciroză asociată cu hepatită virală cronică și hepatită autoimună [30]. Steatoza și/sau activitatea necroinflamatorie se pot rezolva sau „arde” pe măsură ce boala progresează spre fibroză avansată la pacienții cu NAFLD/NASH. Căutarea atentă a balonului hepatocelular rezidual, a corpurilor Mallory-Denk și a fibrozei perisinusoidale, precum și a corelației clinice cu riscurile metabolice subiacente, sunt utile pentru stabilirea unui diagnostic de NAFLD „ars” în ciroza criptogenă [31].
Alte leziuni patologice în NAFLD
Unele modificări patologice care sunt utilizate pentru a clasifica modelul bolii sunt menționate pe scurt aici. Lipogranulomul este compus dintr-un agregat slab de limfocite și histiocite care înconjoară o globulă grasă (Figura 2G), și poate fi găsit în NAFLD, ALD și ingerarea de ulei mineral în alimente și medicamente. Nucleii glicogenați reprezintă acumularea nucleară de glicogen (Figura 2H), și sunt observate mai frecvent în NAFLD decât ALD. Deși probabil rezultă din toleranța la glucoză sau rezistența la insulină, nu sunt patognomice pentru NAFLD. Pot apărea în mod normal la copii și adulți tineri (11% și 4% în anii 20 și, respectiv, la începutul anilor 30) [32] și în alte boli ale ficatului, inclusiv boala de depozitare a glicogenului, boala Wilson și alte tulburări de supraîncărcare a cuprului. Mitocondriile uriașe, cunoscute sub numele de megamitocondriile, sunt incluziuni intracitoplasmatice globulare sau aciforme eozinofile mai mari decât nucleul hepatocitelor. Deși se găsesc de obicei în afecțiunile hepatice grase alcoolice și nealcoolice [33], ele pot fi observate ocazional în diferite condiții fiziologice și patologice, inclusiv îmbătrânirea, ficatul gras acut al sarcinii, boala de stocare a glicogenului și defectele ciclului ureei.
Sindromul metabolic este un factor de risc semnificativ pentru carcinomul hepatocelular (HCC; Odds ratio 2,13; 95% CI: 1,96-2,31) și colangiocarcinom intrahepatic (Odds ratio 1,56; 95% CI: 1,32-1,83) [34]. Pacienții cu ciroză legată de NAFLD prezintă un risc crescut de a dezvolta HCC cu o incidență de 2-3% pe an [35]. O variantă histologică recent descrisă a HCC, HCC steatohepatitic, este caracterizată prin faptul că HCC prezintă trăsături ale steatohepatitei [steatoza la mai mult de 5% din celulele tumorale, balonarea hepatocelulară, corpurile Mallory-Denk, infiltratul inflamator intratumoral și fibroza perisinusoidală] și asociată cu fibroza subiacentă NAFLD și riscuri metabolice [36,37] (Figura 2I).
Sisteme de notare patologică, stadializare și notare
Limitări ale biopsiei hepatice
Deși biopsia hepatică este instrumentul de diagnostic standard pentru NAFLD/NASH, are câteva limitări. În primul rând, este o procedură invazivă cu incidența complicațiilor grave și a mortalității de 0,57% și
- Fumatul de canabis vă poate reduce riscul de studiu al bolilor hepatice grase nealcoolice
- Boala hepatică grasă nealcoolică explică mortalitatea cronică legată de bolile hepatice HCPLive
- Boala hepatică grasă nealcoolică și factorii de risc asociați la femeile braziliene aflate în postmenopauză
- Boală hepatică grasă nealcoolică, pentru a lupta cu sugrumarea Disponibilitatea oxigenului în grăsimi
- Ratele bolilor hepatice grase nealcoolice cresc în U