Subiecte
Abstract
Adipozitatea viscerală este puternic asociată cu riscul bolilor metabolice, în timp ce adipozitatea subcutanată este comparativ benignă. Cu toate acestea, importanța lor fiziologică relativă în homeostazia energetică rămâne neclară. Aici, arătăm că după postul de 24 de ore, țesutul adipos subcutanat al șoarecilor capătă proprietăți cheie ale grăsimii viscerale. În timpul acestei „visceralizări” induse rapid, reglarea în sus a miR-149-3p vizează direct domeniul PR care conține 16 (PRDM16), o proteină cheie coregulatorie necesară pentru „rumenirea” grăsimii albe. În preadipocitele inghinale cultivate, supraexprimarea miR-149-3p promovează un comutator de tip visceral în timpul diferențierii celulare. Șoarecii deficienți în miR-149-3p prezintă o creștere a cheltuielilor de energie ale întregului corp, cu termogeneză îmbunătățită a grăsimii inghinale. Cu toate acestea, s-a observat un fenotip adipos de tip visceral în depozitele inghinale care supraexprimă miR-149-3p. Aceste rezultate indică faptul că, pe lângă capacitatea de „rumenire” de a apăra împotriva hipotermiei în timpul expunerii la frig, depozitul adipos subcutanat este, de asemenea, capabil să „albească” pentru a păstra energia în timpul postului, probabil pentru a menține echilibrul energetic, prin miR-149-3p -reglementarea mediată a PRDM16.
Introducere
Recent, a devenit clar că WAT subcutanat și visceral au semnături unice de expresie genică 1. Mai mult, grăsimea subcutanată posedă o capacitate termogenică substanțială ca răspuns la stimularea la rece comparativ cu depozitele viscerale 14. O acumulare mare de celule asemănătoare maro (denumite celule bej/brite) în timpul expunerii la rece este cea mai proeminentă în depozitul inghinal subcutanat, în timp ce adipocitele viscerale sunt mai puțin susceptibile la „rumenire” 1. Controlul de dezvoltare și transcripție al celulelor bej a primit multă atenție, în principal din cauza rolurilor lor potențiale în apărarea împotriva obezității și a tulburărilor asociate.
Ca integrator al homeostaziei energetice, multe funcții fiziologice de bază furnizate de țesutul adipos au fost trecute cu vederea datorită asocierii lor cu obezitatea. Frigul și foamea au fost probabil stările de bază la oameni pe o parte substanțială a timpului evolutiv 15. Prin urmare, adipocitele maro/bej cu ardere de lipide sunt specializate pentru menținerea temperaturii corpului prin producerea căldurii într-un mediu rece, în timp ce adipocitele albe de stocare a lipidelor sunt adaptate pentru a face față deficitului de alimente 16. Apariția adipocitelor asemănătoare cu maro în WAT subcutanat indusă de frig sugerează că anumite procese adipoase sunt extraordinar de plastice ca răspuns la modificările indicilor de mediu 17,18. Postul este definit ca un set coordonat de modificări metabolice care economisesc consumul de carbohidrați și sporesc dependența de grăsimi ca sursă de energie 19. Deși mai multe studii au raportat că mobilizarea depozitului subcutanat pare a fi mai mică decât cea a grăsimii viscerale în timpul foametei, o provocare importantă este înțelegerea mecanismelor moleculare prin care modificările fiziologice reglează aceste diferite depozite adipoase albe 20 .
Domeniul PR care conține 16 (PRDM16) este o proteină de deget de zinc care funcționează ca o schimbare a destinului celulei bidirecționale între mioblastele scheletici și promovează diferențierea BAT 2,3. În plus, expresia ectopică a PRDM16 în adipocite induce puternic programul termogen în depozitele subcutanate, dar nu și în grăsimea viscerală 5. În special, nivelurile de ARNm și proteine PRDM16 sunt dependente de depozit, probabil datorită stabilității diferențiale a proteinei PRDM16 în depozitele subcutanate și viscerale 1.20. O atenție semnificativă a fost concentrată asupra rolului microARN-urilor (miARN) în funcția adipocitelor. În special, mai mulți miARN au un efect preferențial asupra diferențierii și funcției celulelor maro și bej, inclusiv unele care vizează PRDM16 (referințe 21, 22, 23, 24, 25).
Aici, raportăm că, după 24 de ore de privare a alimentelor, WAT inghinal subcutanat (ingWAT) preia multe dintre caracteristicile morfologice și moleculare ale grăsimii viscerale pentru a păstra energia prin suprimarea mediată de miR-149-3p a PRDM16. Aceste date dezvăluie rolul critic al WAT subcutanat în reglarea echilibrului energetic prin reglarea PRDM16 mediată de miARN.
Rezultate
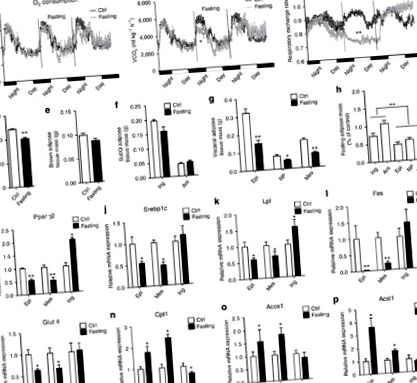
Postul mobilizează mai multe grăsimi viscerale decât depozitul subcutanat
Postul acționează comutatoare fenotip de tip visceral în ingWAT
Postul suprimă termogeneza ingWAT prin inhibarea PRDM16
miR-149-3p care vizează direct PRDM16 în ingWAT subcutanat
Inhibarea miR-149-3p stimulează rumenirea adipocitelor Ing
miR-149-3p induce diferențierea viscerală a adipocitelor Ing
Inhibarea ingWAT a miR-149-3p crește termogeneza șoarecilor
miR-149-3p determină visceralizarea parțială a ingWAT la șoareci
Discuţie
După 24 de ore de post, ingWAT subcutanat preia multe dintre caracteristicile morfologice și moleculare ale grăsimii viscerale pentru a păstra energia prin suprimarea PRDM16 mediată de miR-149-3p. Prin contrast, expunerea la rece de 24 de ore a scăzut miR-149-3p și a dus la creșterea nivelului de proteine PRDM16 și la termogeneza adaptativă în ingWAT. Aceste descoperiri dezvăluie plasticitatea extraordinară a WAT subcutanat și rolul său critic în reglarea homeostaziei energetice, în special ca răspuns la diferite schimbări fiziologice. BAT, țesut adipos maro; SubQ, subcutanat; VISC, visceral; WAT, țesut adipos alb.
miR-149-3p a fost rar investigat. Studiul nostru a demonstrat că miR-149-3p vizează direct și reglează negativ Prdm16 și că inhibarea miR-149-3p promovează diferențierea precursorilor de la celulele subcutanate la cele bej, ducând astfel la creșterea activității mitocondriale (figurile 4 și 5). Cu toate acestea, niciuna dintre aceste modificări nu a fost observată în adipocite epididimale epuizate cu miR-149-3p, sugerând că miR-149-3p ar putea avea roluri specifice țesuturilor. Acest lucru s-ar putea datora faptului că expresia Prdm16 este mult mai scăzută în epiWAT decât în ingWAT 1. În plus, manipularea depozitelor de grăsime este un obiectiv terapeutic evident, dar întreruperea diferențierii normale sau a dezvoltării WAT provoacă lipodistrofie atât la oameni, cât și la animale experimentale. Aici, am demonstrat că inhibarea subcutanată prin dezvoltarea celulelor bej activate anti-miR-149-3p în ingWAT și ulterior a crescut cheltuielile de energie ale întregului corp fără a provoca disfuncționalități în alte țesuturi, care ar putea fi o strategie potențială pentru a contracara obezitatea (Fig. 7 ).
Suntem încă în procesul de înțelegere a asemănărilor și diferențelor dintre țesutul adipos subcutanat și visceral. Aici, arătăm că, pe lângă capacitatea de „rumenire” de a se apăra împotriva hipotermiei în timpul expunerii la frig, WAT subcutanat capătă multe caracteristici ale WAT visceral pentru a păstra energia în timpul postului prin reglarea PRDM16 mediată de miARN. Aceste date sugerează un rol important pentru subcutanat în reglarea homeostaziei energetice, mai ales atunci când întâmpină diferite modificări fiziologice.
Metode
Reactivi și anticorpi
FBS (cat # 16000-044), reactiv TRIzol (cat # 15596-018), DMEM/F-12 (cat # 11330-032) și DMEM (cat # 11965-092) au fost cumpărate de la Invitrogen (Carlsbad, CA, STATELE UNITE ALE AMERICII). Vopseaua fluorescentă SYBR-Green (cat # 4368577) și sondele miRNA TaqMan au fost achiziționate de la Applied Biosystems (Foster City, CA, SUA). Colagenază tip II (pisica # c6885), oligomicină (pisică # 75351), FCCP (pisică # C2920), rotenonă (pisică # R8875), indometacină (pisică # I-7378), dexametazonă (pisică # D-1756), izobutilmetilxantină ( pisica # I-5879), rosiglitazona (pisica # R-2408), T3 (pisica # T-2877) și analiza MystiCq microRNA qPCR (pisica # MIRRM02) au fost achiziționate de la Sigma (Deisenhogfen, Germania).
Pentru Western Blot, anticorpul anti-UCP1 (cat # 14670) a fost achiziționat de la Cell Signaling Technologies (Danvers, MA, SUA), anticorpul anti-PRDM16 (cat # AF6295) a fost achiziționat de la R&D Systems (Tustin, CA, SUA) 21, anticorpul anti-GAPDH (cat # sc-25778) a fost achiziționat de la Santa Cruz Biotechnology (Santa Cruz, CA, SUA) 38. Pentru imunohistochimie, anticorpul anti-UCP1 (cat # ab10983) a fost achiziționat de la Abcam (Cambridge, MA, SUA) 39. Anticorpii utilizați pentru citometria în flux, inclusiv anti-CD45 (cat # 103121), CD11b (cat # 101207) și F4/80 (cat # 123115) 26, au fost achiziționați de la BioLegend (San Diego, CA, SUA).
Animale
Toate procedurile experimentale pe animale au fost efectuate în conformitate cu Ghidul Institutelor Naționale de Sănătate pentru Îngrijirea și Utilizarea Animalelor de Laborator și au fost aprobate de Comitetul de îngrijire a animalelor de la Universitatea Nanjing (Nanjing, China). Șoarecii C57BL/6J bărbați sau femele (cu vârsta de 6-8 săptămâni) au fost obținuți de la Centrul de Cercetare Animal Model din Universitatea Nanjing și au fost menținuți pe o dietă standard (Research Diets cat # D10001, New Brunswick, NJ, SUA) cu h ciclu de lumină. Pentru expunerea la rece, șoarecii au fost adăpostiți individual într-un incubator la 4 ° C timp de 24 de ore cu hrană și apă adecvate. Pentru post, șoarecii au fost adăpostiți individual la 25 ° C numai cu apă. Pentru post combinat cu expunere la rece, șoarecii au fost adăpostiți individual într-un incubator la 4 ° C timp de 24 de ore numai cu apă. Experimentele au fost efectuate cu cel puțin trei cohorte independente.
Cultură de celule
Fracțiile stromal-vasculare ale tampoanelor de grăsime inghinale și epididimale ale șoarecilor masculi C57BL/6J de 7-8 săptămâni au fost preparate și diferențiate timp de 6 zile, după cum se indică în figurile suplimentare. 5a. Preadipocitele izolate primare au fost expuse la inducție prin DMEM/F-12 (pisica Invitrogen # 11330-032, Carlsbad, CA, SUA) conținând indometacină (125 μM; pisica Sigma # I-7378), dexametazonă (5 μM; pisică Sigma # D-1756), insulină (0,5 μg ml -1), izobutilmetilxantină (0,5 mM; Sigma cat # I-5879), rosiglitazonă (1 μM; Sigma cat # R-2408), T3 (1 nM; Sigma cat # T- 2877) și 10% (vol/vol) FBS. Din ziua 4 după inducție, celulele au fost menținute în mediu care conțin insulină (0,5 μg ml -1), T3 (1 nM), rosiglitazonă (1 μM) și 10% (vol/vol) FBS până când au fost colectate.
Expresia genelor și western blot
ARN-ul total din celule sau țesuturi cultivate a fost izolat folosind metoda TRIzol (cat # 15596-018) (Invitrogen, Carlsbad, CA, SUA). Pentru analiza PCR cantitativă a ARNm (qPCR), ARNm a fost transcris invers folosind kitul de sinteză ADNc de mare capacitate ABI și a fost apoi utilizat pentru reacțiile PCR cantitative cu colorant fluorescent SYBR-Green (ABI cat # 4368577, Foster City, CA, SUA). Expresia relativă a ARNm a fost determinată după normalizare la Gapdh niveluri folosind ΔΔCT metodă. Pentru analiza Western blot, celulele sau țesuturile au fost lizate în tampon RIPA (0,5% Nonidet P-40, 0,1% deoxicolat de sodiu, 150 mM NaCI și 50 mM Tris-Cl la pH 7,5). Lizatele au fost rezolvate prin SDS - PAGE, transferate la o membrană PVDF (Millipore, Temecula, CA, SUA) și testate cu anticorpul indicat. Anticorpul anti-UCP1 (1: 2.000) (cat # 14670) a fost achiziționat de la Cell Signaling Technology (Danvers, MA, SUA). Anticorpul anti-PRDM16 (1 μg ml -1) (cat # AF6295) a fost achiziționat de la R&D Systems (Tustin, CA, SUA). Anticorpul anti-GAPDH (1: 1.000) (cat # sc-25778) a fost achiziționat de la Santa Cruz Biotechnology (Santa Cruz, CA, SUA) și a servit ca control de încărcare.
analiza expresiei miARN
Respiraţie
Respirația țesuturilor a fost evaluată folosind un electrod Clark (Strathkelvin Instruments, North Lanarkshire, Scoția). Tesuturile proaspete au fost izolate de la soareci netratati, postiti 24 ore sau expusi la frig timp de 24 ore. Țesuturile au fost tocate și plasate în mediu respirator (DPBS, 2 mm glucoză, 1 mm piruvat, 2% albumină serică bovină). Consumul de O2 a fost normalizat la greutatea țesutului. Pentru fiecare depozit adipos, citirile au fost efectuate folosind trei bucăți separate de țesut de dimensiuni echivalente. Experimentele au fost repetate de cinci ori independent.
Citometrie în flux
Țesutul adipos subcutanat visceral și inghinal epididimal au fost excizate și digerate folosind colagenază tip II (cat # c6885; Sigma, Germania). Suspensiile celulare au fost filtrate printr-o sită de 40 mm, iar SVF a fost colectat după centrifugare la 450g timp de 10 min. Pentru a măsura dimensiunile celulelor țesuturilor adipocite indicate, s-au analizat de fiecare dată 2 × 104 celule eșantion. Pentru a cuantifica macrofagele, celulele colorate cu anti-CD45 (cat # 103121), CD11b (cat # 101207) și F4/80 (cat # 123115) au fost achiziționate de la BioLegend (San Diego, CA, SUA). Celulele au fost analizate folosind un instrument LSRII (BD Bioscience, New Jersey, SUA) și software-ul FlowJo (Analiza unei singure celule, versiunea 7.6.1, Ashland, Oregon).
Colorarea IHC și H&E
Țesuturile au fost fixate în 10% formalină, prelucrate și încorporate în parafină. Au fost preparate secțiuni multiple (10 μm grosime) și colorate cu hematoxilină și eozină pentru observare morfologică. Pentru colorarea imunocitochimică, secțiuni de țesut adipos au fost incubate cu anticorp anti-UCP1 (cat # ab10983; 1: 1.000; Abcam, Cambridge, MA, SUA) peste noapte la 4 ° C. Semnalele au fost detectate folosind un anticorp secundar capră biotinilat anti-iepure (cat # ba-1000; 1: 1,000; Vector Laboratories, Burlingame, CA, SUA) cu kitul ABC (cat # PK-4001; Vector Laboratories, Burlingame, CA ), SUA) și substrat DAB (cat # h-2200; Vector Laboratories, Burlingame, CA, SUA).
Infecția adenovirală și transfecția microARN
Culturile de celule SV la confluență de 70% au fost incubate cu adenovirus (MOI 50) exprimând sh-Prdm16 sau shRNA amestecat peste noapte în mediu de creștere. Mediul a fost apoi înlocuit și celulele au fost menținute în mediu de creștere pentru încă 36 de ore înainte de transfecția miARN. Apoi, celulele SV au fost tripsinizate, colectate prin centrifugare, spălate de două ori cu PBS și resuspendate în DMEM/F-12. Transfecțiile au fost efectuate la o concentrație de 20 nM pentru mimic sau anti-miRs, folosind sistemul de electroporare Gene Pulser Xcell (Bio-Rad, Hercules, CA, SUA). Celulele au fost apoi însămânțate în plăci cu 6 godeuri. După 4 ore, complexul de transfecție a fost înlocuit cu mediu de inducție adipogen proaspăt. După 2 zile de inducție, mediul a fost înlocuit cu mediu de întreținere adipogen și celulele au fost colectate pentru analiza ARN după încă 4 zile de diferențiere. Toate experimentele au fost efectuate în godeuri triplate pentru fiecare afecțiune și repetate de cinci ori independent.
Testul luciferazei
Plasmidele care poartă gena luciferazei Renila legate de un fragment al Prdm16 3'UTR care adăpostește site-uri de legare putoase miR-149-3p au fost co-transfectate în celule HEK293T (rinichi embrionar uman, achiziționat de la Type Culture Collection al Academiei de Științe din China Shanghai, China, autentificat prin STR Profiling, fără contaminare cu micoplasmă) împreună cu miRNA de control sau mimic miR-149-3p (Genepharm, Suzhou, China). Un mutant 3'-UTR al Prdm16 a fost construit prin mutageneza miR-149-3p de la AGGGAGG în GGAGGGA. Celulele HEK 293T au fost cultivate în DMEM (Gibco, Carlsbad, CA, SUA) conținând 10% FBS și însămânțate în plăci cu 12 godeuri. La 24 de ore după placare, 0,2 μg de plasmidă reporter luciferază licurică, 0,2 μg de vector de expresie β-galactozidază (cat # 10586-014) (Ambion, Carlsbad, CA, SUA) și cantități egale (20 pmol) de miR-149 -3p imitați sau mutați ARN de control negativ au fost transfectați în celule cu Lipofectamina 2000 (cat # 11668-019) (Invitrogen, Carlsbad, CA, SUA) conform instrucțiunilor producătorului. Un vector β-galactozidază a fost utilizat ca control al transfecției. La 24 h post-transfecție, celulele au fost analizate folosind un kit de testare a luciferazei (cat # E4550) (Promega, Madison, WI, SUA). Toate experimentele au fost efectuate în godeuri triplate pentru fiecare afecțiune și repetate de cinci ori independent.
Injectarea lentivirusurilor în țesutul adipos inghinal in vivo
Măsurarea metabolică
Experimentele au fost efectuate cu șoareci masculi C57BL6/J de 7 săptămâni, dacă nu se indică altfel. Cheltuielile cu energia au fost analizate folosind un sistem complet de colivii LabMaster (sistem TSE, Turingia, Germania). După citiri bazale în cuști timp de 48 de ore, șoarecii infectați cu lentivirus au fost injectați subcutanat cu NE (1 mg kg -1).
Consumul de O2
Celulele SV primare au fost cultivate în plăci cu 96 de godeuri și diferențiate. Ratele consumului de oxigen (OCR) au fost măsurate la nivelurile de glucoză bazale (Seahorse Bioscience, North Billerica, MA, SUA), precum și cu medicamente care perturbă lanțul respirator: oligomicină (inhibitor ATP sintază, 1 μM; pisica Sigma-Aldrich # 75351) și FCCP (decuplator, 1 μM) (Sigma-Aldrich, cat # C2920). În cele din urmă, respirația mitocondrială a fost blocată cu 1 μM rotenonă (Sigma-Aldrich, cat # R8875). OCR rezidual a fost considerat respirație non-mitocondrială. Toate experimentele au fost efectuate în godeuri triplate pentru fiecare afecțiune și repetate de cinci ori independent.
Statistici
Datele au fost analizate folosind Prism 6 (Software GraphPad) cu Student cu două cozi t-teste. Pentru rezultatele cheltuielilor de energie, valoarea medie a fost calculată pentru fiecare șoarece pentru fiecare dintre duratele indicate, iar valorile au fost utilizate pentru a calcula semnificația statistică între grupuri. Mărimea eșantionului sau a experimentului a fost determinată empiric pentru a obține suficientă putere statistică. Nu s-au folosit teste statistice pentru a stabili dimensiunea experimentelor. P valori de la 0,001 la 0,05 sau
Informatii suplimentare
Coduri de aderare: Datele privind expresia genelor au fost depuse în baza de date GEO sub codul de acces GSE74753.
Cum se citează acest articol: Ding, H, și colab. Postul induce un comutator de grăsime subcutanat-visceral mediat de microARN-149-3p și suprimarea PRDM16. Nat. Comun. 7: 11533 doi: 10.1038/ncomms11533 (2016).
- Răsucirea comutatorului metabolic Experiența mea post de 5 zile
- Luați în considerare alegerile durabile ale fructelor de mare din perioada postului
- Avantajele emoționale ale postului AllAboutFasting
- Chaitra Navratri 2020 5 alimente pe care încă le poți mânca în timp ce postim - NDTV Food
- Răspunsuri adaptative diferențiale la postul de 1 sau 2 zile în diferite țesuturi ale șoarecilor relevate de