Kyung Ae Ko
1 Departamentul de Cardiologie, Divizia de Medicină Internă, Universitatea din Texas MD Anderson Cancer Center
Keigi Fujiwara
1 Departamentul de Cardiologie, Divizia de Medicină Internă, Universitatea din Texas MD Anderson Cancer Center
Sunil Krishnan
2 Departamentul de Oncologie a Radiațiilor, Universitatea din Texas MD Anderson Cancer Center
Jun-ichi Abe
1 Departamentul de Cardiologie, Divizia de Medicină Internă, Universitatea din Texas MD Anderson Cancer Center
Abstract
Secțiunile de țesuturi încorporate în parafină sunt utilizate în mod obișnuit pentru studierea histologiei și histopatologiei țesuturilor. Cu toate acestea, este dificil să se determine care este morfologia tridimensională a țesutului din astfel de secțiuni. În plus, secțiunile de țesuturi examinate pot să nu conțină regiunea din țesut care este necesară în scopul studiului în curs. Această ultimă limitare împiedică studiile histopatologice ale vaselor de sânge, deoarece leziunile vasculare se dezvoltă în mod focalizat. Acest lucru necesită o metodă care să ne permită să analizăm o zonă largă a peretelui vaselor de sânge, de la suprafața sa până la regiunile mai adânci. O pregătire completă a vaselor de sânge în față îndeplinește această cerință. În acest articol, vom demonstra cum să facem preparate în față ale aortei șoarecelui și ale arterei carotide și să le colorăm imunofluorescent pentru microscopie confocală și alte tipuri de imagistică bazată pe fluorescență.
Introducere
Preparatele de montare completă în față (pronunțate än ˈfäs) ne permit să analizăm o zonă largă a suprafeței vaselor de sânge, cum ar fi întreaga aortă de la rădăcina aortică până la arterele iliace comune. Folosind un astfel de specimen colorat cu anticorpi specifici și alte sonde specifice, se poate identifica localizarea leziunilor și, de asemenea, în cazul în care apar diferite evenimente moleculare în celulele endoteliale coroborate cu aterogeneză, cum ar fi modificări de exprimare, localizare și modificări posttranslaționale ale proteinelor. În plus față de studierea aterogenezei, forma celulei endoteliale observată în preparatele pentru față este utilizată ca indicator al modelului regional al fluxului sanguin mediat în timp. Astfel de date sunt importante pentru studierea in situ a mecanosemnalizării celulelor endoteliale. În acest scop, vasele de sânge histologice de secțiune transversală de rutină nu sunt utile. Astfel, pentru medicina vasculară și biologie, este deosebit de important să se dobândească o tehnică pentru realizarea preparatelor de față a vaselor de sânge care să permită observarea unei zone largi a suprafeței vasului, precum și a zonelor subterane mai adânci ale vasului.
În acest articol, vom ilustra o metodă pentru prepararea preparatelor de față ale aortei de șoarece și ale arterei carotide pentru colorarea imunofluorescentă. Pregătirile în față se pot face chiar și după ce aceste vase au fost manipulate experimental. De exemplu, o arteră carotidă poate fi parțial ligată și apoi se poate face un preparat facial după o astfel de intervenție chirurgicală. Din acest motiv, vom descrie și în acest articol cum facem o ligatură parțială pe artera carotidă. Comparativ cu prepararea unor preparate similare de la animale mai mari, cum ar fi șobolani, iepuri și oameni, vasele de șoareci sunt de dimensiuni mici și mai fragile, necesitând astfel o îngrijire suplimentară pentru manipulare în timpul izolării chirurgicale a vaselor și pregătirea acestora pentru colorarea anticorpilor și microscopie. Deoarece modelul animal cel mai frecvent utilizat pentru modificarea genetică este șoarecele, devine esențial pentru mulți anchetatori să manipuleze vasele de șoarece fără a le deteriora. În acest manuscris, vom descrie cum să se ocupe de vasele de sânge ale șoarecilor atunci când se fac preparate în față ale aortei șoarecelui și ale arterei carotide. În scopul demonstrării, vom folosi șoareci de tip sălbatic C57/b6.
Protocol
Protocoalele pentru ligarea parțială a arterei carotide și izolarea mouse-ului aortei și a arterei carotide de șoarece pentru imunocolorarea în față sunt aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor (IBT 2014-9231).
1. Legătură parțială stângă a arterelor carotide
Pregătiți spațiul chirurgical așezând un tampon de încălzire de 12 inch x 14 inch pe masă și acoperiți tamponul și blatul mesei cu un draperie chirurgicală mare și curată. Reglați brațul suportului brațului astfel încât câmpul vizual al stereomicroscopului să fie în zona centrală a plăcii de încălzire.
Porniți plăcuța de încălzire de pe masă și setați selectorul de control cu 3 setări la nivelul mediu de căldură. La această setare a temperaturii, suprafața plăcii chirurgicale (vezi 1.6.1) va fi de 38-40 ° C.
Așezați o cușcă curată pe un alt tampon de încălzire. Porniți plăcuța de încălzire ca mai sus. Această cușcă va fi utilizată pentru recuperare după operație (vezi 1.16), precum și pentru adăpostire.
Pe masa chirurgicală, așezați o pungă de sterilizare autoclavată care conține foarfece de iris (1 pereche), forceps pentru țesut (1 pereche), forceps super grip (2 perechi), foarfece cu arc (1 pereche), retractor bont (1 pereche; 2,5 mm lățime), suport rotund cu ac cu mâner (1), sutură de mătase sterilizată 6-0, aplicatoare cu vârf de bumbac, mini aplicatoare cu vârf de bumbac, draperii chirurgicale și bureți de tifon de 2 "x 2". De asemenea, așezați o sticlă de stoarcere conținând 70% etanol și o altă sticlă care conține clorhexidină chirurgicală pe masa chirurgicală.
Cântărește un șoarece. Greutatea corporală este necesară pentru a determina cantitatea adecvată de analgezie, care va fi administrată imediat înainte de operație.
Așezați un mouse în camera de inducție.
Porniți rezervorul de oxigen și vaporizatorul anestezic pentru a anestezia mouse-ul din camera de inducție. Mențineți nivelul de izofluran la 2%. Durează 3-5 minute până când mouse-ul nu se mai mișcă.
În timp ce mouse-ul este anesteziat, plasați o bucată mai mică de draperie chirurgicală sterilă (24 inch x 24 inch) sub stereomicroscop pentru a crea o suprafață chirurgicală. Apoi puneți o placă chirurgicală acrilică (care a fost curățată cu 70% alcool) pe suprafața drapată. Prin urmare, placa chirurgicală ar trebui să fie pe plăcuța de încălzire, dar separată de două straturi de draperii chirurgicale.
Când mouse-ul încetează să se mai miște în camera de inducție, transferați mouse-ul într-o zonă de pregătire pre-chirurgicală și poziționați-l în conul nasului conectat la vaporizator (2% izofluran). Îndepărtați părul din jurul zonei cervicale folosind un aparat de tuns electric sau o loțiune pentru îndepărtarea părului. Vă recomandăm loțiune pentru îndepărtarea părului, deoarece această metodă nu va produce bucăți de păr libere, care sunt greu de îndepărtat complet din zona chirurgicală.
Cu conul nasului în poziție, mutați mouse-ul pe placa chirurgicală.
Bandați în jos picioarele anterioare dreapta și stânga pe placa chirurgicală. Bandați ambele picioare din spate împreună pe partea dreaptă a mouse-ului. Acest lucru determină o ușoară rotație a corpului mouse-ului, astfel încât partea stângă a zonei gâtului mouse-ului devine mai bine poziționată pentru operație.
Dezinfectați zona inciziei cu 70% alcool, scrub chirurgical cu clorhexidină și din nou cu 70% alcool. Acoperiți mouse-ul cu un draperiu chirurgical sterilizat, cu excepția zonei de incizie cervicală.
Confirmați prin strângerea degetelor de la picior că șoarecele este complet anesteziat și faceți analgezie (Caprofen 3-5 mg/kg) prin injecție intraperitoneală sau subcutanată.
Sub microscopul de disecție, efectuați o incizie ventrală a liniei medii în jurul zonei cervicale utilizând fie un bisturiu, fie o foarfecă de iris. NOTĂ: Folosim foarfece deoarece distanța de lucru a stereomicroscopului este limitată, ceea ce face dificilă utilizarea unui bisturiu.
Expuneți artera carotidă comună stângă (LCCA) împingând deoparte și repoziționând glandele salivare care acoperă vasele de sânge în partea stângă a animalului.
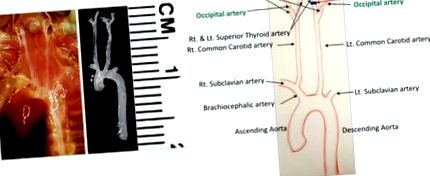
Identificați toate vasele de sânge din câmpul chirurgical (figura 1). LCCA se bifurcă în artera carotidă internă stângă (ICA) și în artera carotidă externă stângă (ECA). Artera tiroidiană superficială (STA) apare din partea ECA pe partea medială. Artera occipitală (OA) apare de obicei din ECA, dar la unii șoareci apare din ICA.
Ligează toate ramurile arterelor, cu excepția OA, folosind sutură de mătase sterilizată 6-0. Pentru a realiza acest lucru, efectuați următoarele două ligături.
Îndepărtați ușor țesutul conjunctiv în jurul și sub artera carotidă internă stângă (ICA). Luați o bucată de sutură de mătase pre-tăiată 6-0 (
2,5 cm) cu pensă și treceți-o pe sub arteră. Folosind o altă pereche de pensă, trageți sutura aproximativ 1/3 din lungimea sa și legați artera.
Îndepărtați țesutul conjunctiv din jurul arterei carotide externe stângi (ECA) în același mod descris mai sus și efectuați o ligatură proximală la artera tiroidă superioară stângă (STA) (figura 1). Aveți grijă să nu deteriorați fibrele nervoase care rulează în câmpul chirurgical.
După efectuarea acestor legături, readuceți glandele salivare în poziția inițială și hidratați câmpul chirurgical prin plasarea a 2-3 picături de ser fiziologic steril. Închideți pielea folosind suturi de vicryl acoperite cu 6-0.
După operație, așezați mouse-ul în cușca preîncălzită (vezi 1.2.1). Mouse-ul trebuie să se trezească în 5 minute și să înceapă să se plimbe. Odată confirmat faptul că șoarecele se comportă normal, aduceți cușca în camera de adăpostire a animalelor.
Observați zilnic mouse-ul în primele 3 zile de recuperare. Mouse-ul poate fi păstrat atâta timp cât experimentul necesită în diferite condiții pe care protocolul experimental le solicită. Pregătirile pentru față se pot face în orice moment după operație.
2. În Imunomarcarea feței
Eutanasiați un șoarece cu CO2 prin supradozaj prin inhalare.
Bandați mouse-ul într-o poziție culcat (cu burta în sus) pe o placă de disecție.
Expuneți cavitatea abdominală făcând o incizie a liniei medii folosind foarfece de iris.
Expuneți cavitatea toracică tăind coastele lateral la stern.
Faceți o crăpătură în vena cavă sau tăiați una dintre arterele femurale pentru drenarea sângelui.
Introduceți un ac de 26 G atașat la un sistem de perfuzie gravitațională (120 cm presiune de apă) în vârful ventriculului stâng și perfuzați sistemul circulator cu o soluție salină care conține heparină (40 U/ml). Continuați perfuzia până când soluția salină care curge din tăietură devine limpede.
Comutați sistemul de perfuzie de la soluție salină la soluția de fixare conținând 4% paraformaldehidă în PBS (soluție salină tamponată cu fosfat) și continuați perfuzarea încă 5 minute.
Recoltați aorta și ambele artere carotide stânga și dreapta folosind foarfece și forceps cu capul contondent și puneți-le într-un tub conic de 50 ml conținând fixatorul pe gheață.
Transferați vasul într-o cutie Petri care conține PBS la microscopul de disecare și îndepărtați cu atenție grăsimea și țesuturile conjunctive atașate la aortă și arterele carotide. Separați și împărțiți aorta și arterele carotide longitudinal pentru a expune endoteliul (Figura 2).
Se transferă fiecare vas separat într-un godeu al unei plăci cu 12 godeuri conținând 0,5 ml dintr-o soluție permeabilizantă (0,1% Triton X-100 în PBS) per godeu. Permeabilizați vasele de sânge timp de 10 minute cu balansare la temperatura camerei (RT).
Se spală scurt cu PBS.
Pentru a bloca locurile nespecifice de legare a anticorpilor, incubați vasele de sânge în ser normal 10% din speciile de animale în care au fost fabricate anticorpii secundari, în TTBS (soluție salină tamponată Tris (TBS) cu 2,5% Tween 20) timp de 30 de minute cu legănându-se la RT.
Incubați vasele cu anticorpii primari diluați corespunzător în TTBS cu 10% ser normal (așa cum s-a descris mai sus) peste noapte cu balansare la 4 ° C. Nivelul de diluare trebuie determinat pentru fiecare anticorp.
Efectuați următoarea colorare de control.
Incubați vasele cu TTBS în locul unui anticorp primar urmat de incubare cu un anticorp secundar.
Incubați vasele cu TTBS care conțin ser neimun (sau pre-imun) sau Ig al aceluiași animal (specie) în care au fost fabricați anticorpi primari, urmată de incubare cu un anticorp secundar.
Omiteți incubația cu un anticorp secundar. Aceste eșantioane de control trebuie manipulate în același mod și în același timp atunci când se efectuează colorarea cu anticorpi specifici.
Se spală vasele de sânge de 3 ori cu TTBS timp de 10 min fiecare cu balansare la RT.
Se incubează cu anticorpi secundari marcați fluorescent diluați corespunzător în TTBS cu 10% ser normal (așa cum s-a descris mai sus) timp de 1 oră cu balansare la RT. Colorarea nucleară cu DAPI (4 ', 6-diamidino-2-fenilindol) poate fi efectuată simultan în această etapă prin adăugarea de 1/5.000 în volum a unei soluții stoc DAPI care conține 5 mg/ml de DAPI în H2O.
Se spală de 3 ori cu TTBS timp de 10 min fiecare cu balansare la temperatura camerei.
Clătiți scurt în PBS.
Așezați o picătură de reactiv anti-estompare pe o sticlă de acoperire (22 mm x 50 mm) și așezați un vas de sânge pe sticla de acoperire cu endoteliul orientat în jos.
Așezați o sticlă glisantă (22 mm x 75 mm) pe vasul de sânge evitând în același timp prinderea bulelor.
Așezați diapozitivul pe un șervețel de laborator curat (de exemplu, Kimwipe) și acoperiți diapozitivul cu două bucăți de șervețel de laborator. Așezați ușor 3,5 kg de greutate (de exemplu, utilizați o sticlă de apă pe o carte groasă.) Pe lamelă timp de maximum 5 minute pentru a aplatiza proba de vas de sânge în față.
Îndepărtați greutatea și ștergeți soluția în exces din jurul lamelei de acoperire.
Aplicați oja la cele 4 colțuri ale lamelei de acoperire, așezați lamele într-o cutie de diapozitive, lamele de acoperire cu fața în sus și păstrați-le la întuneric la temperatura camerei (sau 4 ° C) peste noapte. Acest proces aplatizează țesutul în continuare și facilitează efectuarea microscopiei la măriri mari.
Sigilați complet capacul folosind oja.
Efectuați microscopia imediat ce oja este uscată.
Dacă este necesar, depozitați diapozitivele la -20 ° C.
Rezultate reprezentative
figura 1: Anatomia detaliată a navei în zona cervicală a șoarecelui. Rețeaua vasculară înainte și după disecție este prezentată în stânga. Toate arterele sunt identificate în diagrama prezentată în dreapta. Liniile negre indică legături. Scara: 1 divizare = 1 mm. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 2: Diagrama care arată modul în care arterele carotide și aorta sunt transformate în preparatele En Face. Liniile punctate de-a lungul peretelui navei indică tăieturi care trebuie făcute pentru a deschide vasele. Micrografiile colorate prezintă pregătiri reale în față. Scara: 1 divizare = 1 mm. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 3: O imagine En Face a endoteliului colorat cu Anti-VE-cadherin (verde) și Anti-VCAM-1 (roșu). Este prezentată o secțiune optică confocală a celulelor endoteliale în apropierea unei deschideri intercostale. Rețineți că expresia VCAM-1 este crescută în celulele endoteliale situate în punctul ramificației vasului unde fluxul sanguin este non-laminar. Imaginea a fost înregistrată folosind un obiectiv obiectiv 60X (NA 1.4, ulei). Bara de scalare = 20 µm. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 4: Imagini în față ale arterelor carotide stânga și dreaptă colorate cu Anti-VE-cadherin (verde), Anti-VCAM-1 (roșu) și DAPI (Violet). Artera carotidă stângă a fost parțial ligată, iar carotida dreaptă a fost lăsată intactă. Aceste preparate de față au fost făcute la 24 de ore după operație. Expresia crescută a VCAM-1 pe partea ligată comparativ cu vasul intact este evidentă. Aceste imagini au fost realizate în apropierea bifurcației arterelor carotide comune folosind un microscop confocal cu scanare laser cu un obiectiv obiectiv 60X (NA 1.4, ulei). Barele de scalare = 20 µm. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Discuţie
La manipularea vaselor de sânge de șoarece, este important să ne amintim că endoteliul este fragil și că orice forță mecanică excesivă va deteriora celulele endoteliale. De exemplu, celulele endoteliale se rup sau se detașează de peretele vasului dacă vasul este perfuzat prea puternic, ceea ce se poate întâmpla cu ușurință atunci când vasculatura este perfuzată folosind o seringă acționată manual.
Pentru a obține o presiune de perfuzie constantă, folosim un sistem de perfuzie gravitațională cu o presiune a coloanei de apă de 120 cm. S-a raportat că presiunea arterială medie a unui șoarece, care diferă prin tulpină, variază între 130 și 170 cm H2O14. Astfel, presiunea de perfuzie pe care o folosim este puțin mai mică decât presiunea arterială măsurată. Când am fixat perfuzia aorta de șobolan, s-a folosit o presiune de 90 cm pe coloană H2O6.
Celulele endoteliale in situ sunt, de asemenea, deteriorate dacă vasul este întins în timpul recoltării, curățării, despicării longitudinale, imunocolorării și montării. De fapt, deteriorarea mecanică este una dintre cauzele frecvente ale pierderii celulelor endoteliale în preparatele pentru față. Întinderea vasului poate avea loc în orice etapă din timpul procedurii, dar cel mai frecvent, are loc în momentul recoltării vasului. De asemenea, este ușor să întindeți vasul atunci când îndepărtați țesutul adipos atașat adventitiei.
Pregătirile în față se fac prin tăierea unui vas longitudinal pe toată lungimea sa. Acest lucru se face, de obicei, folosind foarfece ascuțite oftalmice. Cu toate acestea, tipul foarfecelor poate fi prea mare dacă diametrul interior al navei țintă este mic. Într-un astfel de caz, se poate folosi o lamă de ras de unică folosință fracturată pentru a face o tăietură. Am folosit această tehnică pentru a face preparate în față ale arterei mezenterice a puilor15.
După fixare, preparatele în față sunt permeabilizate. De obicei, PBS care conține Triton X-100 este utilizat în acest scop, dar este posibil să se utilizeze alți reactivi de permeabilizare, cum ar fi Tween-20, Nonidet P-40, saponină, digitonină și Leucomerm. În mod ideal, condiția de permeabilizare ar trebui optimizată în fiecare laborator. Pentru aorta de șoarece și arterele carotide, le tratăm cu PBS care conține 0,1% Triton X-100 timp de 10 minute la RT, iar acest tratament este suficient pentru a permeabiliza toate celulele din peretele vasului. Probele permeabilizate sunt apoi tratate secvențial mai întâi cu un anticorp primar și apoi un anticorp secundar care este marcat fluorescent. Pentru colorarea vaselor de șoarece, este esențial ca anticorpul primar să nu fie produs la șoarece, deoarece țesutul vascular al șoarecelui va conține IgG de șoarece care va fi marcat de IgG anti-șoarece secundar marcat fluorescent, provocând o colorare de fundal ridicată. Pentru microscopie, specimenul trebuie să fie cât mai plat posibil. Apăsăm lamele timp de 5 minute cu 3,5 kg greutate. Această greutate specifică a fost determinată empiric.
Utilizarea preparatelor pentru față nu se limitează la imagistica prin microscopie cu fluorescență. Folosind un stereomicroscop, preparatele vaselor pentru față pot fi utilizate pentru a studia gradul de formare a plăcii aterosclerotice după colorarea lor cu ulei roșu O. Preparatele pentru vasele pentru față se pot face aseptic. Astfel de preparate pot fi păstrate în cultură și pot fi utilizate ca sistem ex vivo pentru studierea interacțiunii leucocite-celule endoteliale.
Dezvăluiri
Mulțumiri
Activitățile de cercetare ale autorilor sunt susținute de subvenții de la Institutul Național de Sănătate Dr. Abe (HL-130193, HL-123346, HL-118462, HL-108551).
- Eliminarea celulelor deteriorate din corp ajută la vindecarea vaselor de sânge ale diabeticilor - ScienceDaily
- Coronavirus Care mască previne COVID-19 Cum se aplică o mască de față din argilă - Jackson Parish Hospital
- Presiunea arterială ridicată determină creșterea în greutate
- Crearea runelor de sânge Old School RuneScape Wiki Fandom
- Donarea de sânge sănătos sau Hype Paleo Leap