Ralf Weiskirchen
1 Institutul de patobiochimie moleculară, terapie genetică experimentală și chimie clinică (IFMPEGKC), Spitalul universitar RWTH Aachen, Pauwelsstraße 30, Germania
Sabine Weiskirchen
1 Institutul de patobiochimie moleculară, terapie genetică experimentală și chimie clinică (IFMPEGKC), Spitalul universitar RWTH Aachen, Pauwelsstraße 30, Germania
Frank Tacke
2 Departamentul de Medicină III, Spitalul Universitar RWTH Aachen, D-52074 Aachen, Pauwelsstraße 30, Germania
Abstract
Introducere
Patogenia fibrozei hepatice
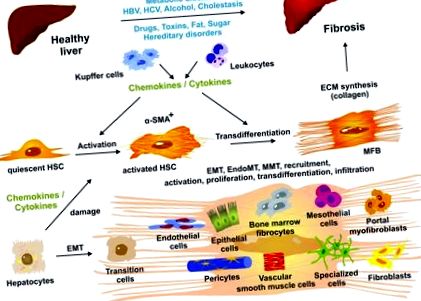
figura 1.
Leziunile hepatice prelungite duc la modificări ale arhitecturii hepatice și fibroză avansată. La nivel celular, celulele stelate hepatice în repaus (HSC) devin declanșate de mediatori solubili (chemokine și citokine) eliberați de macrofagele rezidente la ficat (celule Kupffer), leucocite care se infiltrează și alte tipuri de celule, inclusiv hepatocite deteriorate. Atât HSC-urile activate, cât și miofibroblastele transdiferențiate (MFB) sunt pozitive pentru actina α-mușchiului neted (α-SMA). MFB-urile sunt sursa predominantă de sinteză și depunere a colagenului. MFB-urile care produc matrice extracelulară (ECM) sunt în continuare crescute de diferite tipuri de celule, cum ar fi fibroblaste rezidente, celule mezoteliale, fibrocite circulante (măduva osoasă), celule epiteliale, celule endoteliale, pericite, celule musculare netede vasculare și alte celule specializate tipuri care dobândesc activități pro-fibrogene și devin capabile să exprime componentele ECM. Mecanismele moleculare și celulare relevante, inclusiv tranziția epitelial-mezenchimală (EMT), tranziția endotelial-mezenchimală (EndoMT), tranziția mezotelial-mezenchimală (MMT), recrutarea, activarea, proliferarea, transdiferențierea și infiltrarea sunt intens studiat în prezent. Pentru mai multe detalii, vezi 2, 15. VHB, virusul hepatitei B; VHC, virusul hepatitei C.
Figura 2.
În ficat, modificările genetice, tulburările metabolice, colestaza, infecțiile virale, paraziții, medicamentele, toxinele, alcoolul care duce la boli alcoolice hepatice (ALD) și o mare varietate de alți compuși nocivi și factori de mediu pot duce la inițierea și progresia fibroză. AIH, hepatită autoimună; CXCR3, receptorul 3 al chemokinei motiv C-X-C; VHB, virusul hepatitei B; VHC, virusul hepatitei C; IL28B, interleucina 28B; NASH, steatohepatită nealcoolică; PNPLA3, o proteină 3 care conține un domeniu de fosfolipază asemănătoare patatinului; RNF7, proteina degetului inelar 7; TGF-β, factor de creștere transformant-β.
Tulburări genetice
tabelul 1.
| Boala Wilson | ATP7B | 606882/13q14.3 | 1-9: 100.000 | ATPaza, membrana plasmatică transportul cuprului proteină | 8 |
| Ereditar hemocromatoza | HFE | 613609/6p22.2 | 3-5: 1.000 | Proteină membranară cu similaritate cu cea majoră complexe de histocompatibilitate proteine clasa I; se asociază cu receptorul transferinei | 7 |
| Non-HFE ereditar hemocromatoza Ferroportin |
Receptorul transferinei 2
16. Mai mult, obstrucția mecanică directă a fluxului biliar din ficat în duoden, denumită colestază extrahepatică, cauzată de invazia neoplazică a arborelui biliar (de exemplu, cancerele căilor biliare extrahepatice, vezica biliară sau ampula lui Vater), chisturi, pietre în comun canalul biliar, pancreatita sau îngustarea canalului biliar pot provoca afectarea fluxului biliar și pot induce fibroza hepatică 17 .
Alcool
Un număr covârșitor de pacienți cu consum excesiv de alcool și hepatită alcoolică prezintă fibroză marcată 18. În afecțiunile hepatice alcoolice, răspunsul fibrogen în ficat după absorbția alcoolului este determinat de acetaldehidă. Acetaldehida este primul metabolit în timpul detoxifierii etanolului, care poate regla în mod direct transcrierea colagenului I direct și indirect, declanșând sinteza transformării factorului de creștere-β1 (TGF-β1) 19. Mai mult, aportul cronic de alcool provoacă formarea ROS, crește multiplicarea bacteriilor intestinale și modifică permeabilitatea intestinului la macromolecule, crescând astfel endotoxinele derivate din intestin în circulația portalului și activând celulele Kupffer prin căile receptorilor asemănători cu Toll 20 .
Infecția cu virusul hepatitei
Infecțiile cu virusurile hepatitei B sau C sunt o problemă globală de sănătate asociată cu o mortalitate semnificativă și reprezintă mai mult de 1,3 milioane de decese pe an și rate de incidență regionale foarte variabile și susceptibilitatea de gen pentru complicațiile rezultate 21-23. Ambele infecții se caracterizează prin inflamație hepatică persistentă, reprezentând un factor important în stabilirea fibrozei și a cirozei. Studiile anterioare au estimat că, la nivel global, 57% din cazuri de ciroză și 78% din cazurile de carcinom hepatocelular sunt atribuite infecției cronice fie cu hepatită B, fie cu hepatită C 24. Strategiile de tratament antiviral și introducerea generală a vaccinării eficace împotriva hepatitei B au redus povara hepatitei B 25, în timp ce introducerea agenților antivirali direcți împotriva virusului hepatitei C oferă opțiunea de a vindeca boala la nivel mondial 26 .
Droguri
Leziunea hepatică indusă de droguri (DILI) este una dintre principalele cauze ale insuficienței hepatice acute în lumea occidentală, paracetamolul (acetaminofen [APAP]) fiind cel mai frecvent medicament cauzator urmat de antimicrobieni 27. Modelul de hepatotoxicitate legată de DILI este clasificat ca tip hepatocelular, colestatic sau mixt. DILI poate duce, în cazuri rare, la fibroză sau alte tipuri de leziuni cronice, cum ar fi hiperplazia regenerativă nodulară, sindromul căilor biliare care dispare sau chiar ciroza 27. .
Tulburări autoimune
Nutriție și boli metabolice
Microbiotă bună
Integritatea barierei intestinale este extrem de importantă pentru funcția axului intestin - ficat. Un intestin cu scurgeri și o translocație patologică a bacteriilor sau a componentelor bacteriene rezultate din modificări cantitative sau calitative ale microbiotei intestinale (disbioză) conduc la activarea macrofagelor hepatice rezidente (adică celulele Kupffer) eliberând citokine pro-inflamatorii și stimularea sintezei matricei prin HSC. prin receptorii de tip Toll 45. Modificările microbiomului intestinal detectate în testele neinvazive, bazate pe scaun, s-au dovedit recent a fi utile din punct de vedere clinic pentru diagnosticarea bolilor metabolice și a fibrozei avansate la pacienții cu NAFLD 46. În plus, există o corelație între compoziția microbiotei intestinale, alcoolul și formarea ROS (vezi mai sus).
Obstrucție venoasă
Obstrucția fluxului venos portal poate rezulta din tromboza venei portal intrahepatică sau extrahepatică sau cavernom portal. Factorii generali de risc pentru tromboza venei portale sunt viteza redusă a fluxului portal, tendința hipercoagulabilă, afectarea vasculară și invazia vasculară malignă 47. Obstrucția fluxului venos hepatic provoacă de obicei congestia sinusoidală și necroza celulelor parenchimatoase în cea mai mare parte în zonele perivenulare ale acinilor hepatici, ceea ce poate duce la formarea fibrozei de punte între venele centrale adiacente 48. Boala este complexă și obstrucția poate apărea în venele mici din ficat (boala veno-ocluzivă) sau în venele hepatice drenante (sindromul Budd-Chiari) sau este rezultatul creșterii presiunii în ramurile sublobulare ale venelor hepatice din cauza insuficiență cardiacă cronică (hepatopatie congestivă). Când nu este tratată corespunzător, obstrucția cronică duce la necroză ischemică, acumularea ulterioară de colagen și remodelarea regională a peretelui venei.
Paraziți
Cele mai importante boli parazitare asociate cu fibroza hepatică sunt schistosomiaza și echinococoza. Chisturile hidatice provenite din Echinococcus granulosus sau Echinococcus multilocularis și granuloamele formate în jurul ouălor prinse în timpul infecției cu Schistosoma mansoni și Schistosoma japonicum dau naștere fibrozei în jurul componentei invadatoare parazitare prinse din rezultatele răspunsurilor imune ale gazdei 49. Studiile experimentale au arătat că hidatidoza hepatică cauzată de infecția cu E. granulosus are ca rezultat creșterea expresiei mRNA TGF-β1 și a proteinelor în etapele medii și tardive ale infecției și stimulează dezvoltarea fibrozei hepatice 50. În mod similar, un studiu care a analizat 39 de pacienți cu echinococoză chistică a arătat că receptorul TGF-β II care ocupă un rol central în transducția semnalelor TGF-β1 a fost semnificativ reglat în zonele infectate cu E. granulosus în comparație cu țesuturile hepatice normale adiacente 51 .
Boală hepatică criptogenă și congenitală
De obicei, dezvoltarea criptogenă a fibrozei hepatice și a cirozei are loc la mijlocul până la sfârșitul maturității, ca urmare a tulburărilor moștenite. În unele cazuri, mutațiile anumitor proteine de citokeratină (keratina 18 și keratina 8) sunt asociate cu patogeneza bolii hepatice criptogene și congenitale. În acest sens, aminoacizii conservați localizați la joncțiunile dintre motivele structurale individuale din keratine sunt cei mai eficienți în producerea fibrozei hepatice și a cirozei prin interferența cu reorganizarea normală a filamentelor de keratină 52. Alte rapoarte au sugerat o boală hepatică criptogenă ca o consecință a mutației neidentificate în transportorii ABC implicați în limitarea absorbției intestinale și promovarea excreției biliare a sterolilor, cum ar fi genele ABCG5 (Sterolin-1) și ABCG8 (Sterolin-2) 53 .
Terapii existente și emergente pentru fibroza hepatică
Există un număr mare de ghiduri și recomandări practice practice clinice pentru tratamentul pacienților cu fibroză hepatică, în funcție de diferitele tipuri de boli hepatice. Bineînțeles, aceste orientări se concentrează asupra intervențiilor specifice etiologiei sau asupra gestionării complicațiilor bolii, dar nu recomandă terapii generale „antifibrotice” (Tabelul 2). Ghidurile de tratament clinic de la asociații profesionale precum Asociația Americană pentru Studiul Bolilor hepatice (AASLD) sau Asociația Europeană pentru Studiul Ficatului (EASL) sunt importante pentru a îmbunătăți consistența și calitatea îngrijirii primite de pacienți. În plus față de aceste linii directoare standardizate, terapiile complementare și alternative, produsele pe bază de plante, vitaminele sau alte suplimente alimentare sunt aplicate pe scară largă la pacienții care suferă de boli hepatice cronice (Figura 3). În cele ce urmează, vom rezuma pe scurt regimurile curente de tratament și baza patogenă a proprietăților anti-fibrotice ale tratamentelor specifice în fibroza hepatică, fie pe baza datelor experimentale, fie, în cazuri selectate, a dovezilor clinice.
masa 2.
Figura 3.
Fibroza hepatică în curs poate fi întreruptă sau rezolvată prin terapii specifice, eradicarea sau restricția dietetică a cauzei patogene sau intervențiile de stil de viață și dietetice. În plus, mai multe caracteristici neglijate ale stilului de viață, cum ar fi exercițiul fizic, expunerea la soare, suplimentarea vitaminelor și durata și ritmul somnului îmbunătățite s-au dovedit a fi benefice în gestionarea fibrozei hepatice. Pentru explicații mai detaliate, consultați textul. ACC, acetil-CoA carboxilaza; ACE, enzimă de conversie a angiotensinei; ALD, boală hepatică alcoolică; ASK1, kinaza 1 care reglează semnalul apoptozei; CCL2, ligand 2 al chemokinei motiv C-C; CCR2/CCR5, receptor C-C al chemokinei 2/5; FXR, receptorul farnesoid X; GLP-1, peptidă-1 asemănătoare glucagonului; LOXL2, lisil oxidază 2; NASH, steatohepatită nealcoolică; PPAR, receptor activat de proliferatorul peroxizomului; TGR5, receptor 5 cu membrană cuplată cu proteina G; THR-β, receptorul hormonului tiroidian-β; SFATURI, șunt portosistematic intrahepatic transjugular.
Antioxidanți
Inhibarea leziunilor hepatice
Direcționarea inflamației
Dezactivarea și eliminarea celulelor producătoare de matrice extracelulară
O provocare principală în atenuarea fibrozei hepatice este scăderea cantității celulare și a activității celulelor producătoare de matrice în țesutul rănit. Inducerea țintită a apoptozei și senescenței sau dezactivarea grupului celular respectiv este realizată experimental în multe moduri. Expresia proteinelor care acționează ca declanșator al senescenței celulare a fost capabilă să reducă producția de colagen de tip I atât la nivelurile de ARNm cât și de proteine în HSC și MFB-uri portale prin inducerea ROS și a semnalizării TGF-β atenuate 87, 88. De asemenea, modularea mediului inflamator poate induce dezactivarea MFB-urilor producătoare de matrice 89 .
Inhibitori ai semnalizării citokinelor
Producerea și degradarea matricei extracelulare
Eradicarea virală, îndepărtarea paraziților și retragerea de droguri/toxine
Numeroase studii au confirmat că simpla retragere sau suprimare a stimulului dăunător poate duce la rezolvarea spontană a fibrozei cu restabilirea arhitecturii normale a ficatului 95. Toate aceste studii demonstrează că fibroza hepatică este un proces bidirecțional dinamic, permițând regresia și recuperarea chiar și atunci când fibroza este avansată 96. Prin urmare, este evident că eliminarea sau reducerea încărcăturii virale în hepatita virală cronică prin medicamente antivirale (sau combinații), îndepărtarea paraziților hepatici sau retragerea oricărui medicament sau toxină care duce la afectarea parenchimatoasă este încă prima opțiune în tratarea tuturor leziunilor fibrotice ale ficatului. În majoritatea cazurilor de infecții parazitare, sunt disponibile medicamente adecvate (de exemplu, praziquantel pentru toate speciile de Schistosoma).
Restaurarea eubiozei intestinale și a homeostaziei
Refacerea fluxului sanguin
Tromboza venei porte și obstrucția venoasă sunt complicații frecvente în fibroza hepatică avansată și ciroza. La pacienții cu o stare protrombotică documentată persistentă, anticoagularea (de exemplu, cu heparină cu greutate moleculară mică) s-a dovedit a preveni progresia obstrucției venei porte care apare din cauza trombozei 47. Modelele experimentale au dat rezultate divergente cu privire la faptul dacă anticoagularea terapeutică (de exemplu, enoxaparina) reduce fibroza și rezistența vasculară 99, 100. Într-un studiu prospectiv randomizat, enoxaparina a prevenit tromboza venei portale, decompensarea hepatică și mortalitatea la pacienții cu ciroză hepatică avansată 101 .
Tratamentul steatohepatitei nealcoolice și a bolii hepatice grase nealcoolice
Concluzii
Abrevieri
ABC, casetă de legare ATP; AIH, hepatită autoimună; CVC, cenicriviroc; DILI, leziuni hepatice induse de medicamente; GLP-1, peptidă-1 asemănătoare glucagonului; GLP-1R, receptor al peptidei-1 asemănător glucagonului; HCC, carcinom hepatocelular; HSC, celulă stelată hepatică; LOXL2, lisil oxidază 2; MFB, miofibroblast; MMP, metaloproteinază matricială; NAFLD, boală hepatică grasă nealcoolică; NASH, steatohepatită nealcoolică; PBC, colangită biliară primară; PDGF, factor de creștere derivat din trombocite; PSC, colangită sclerozantă primară; ROS, specii reactive de oxigen; TGF-β, factor de creștere transformant-β; TIMP, inhibitori tisulari ai metaloproteinazei.
Mulțumiri
Mulțumim cordial tuturor membrilor laboratoarelor noastre și oamenilor de știință colaboratori pentru discuții utile.
Note
[versiunea 1; arbitri: 2 aprobați]
Declarație de finanțare
Această lucrare a fost susținută de Fundația Germană de Cercetare (DFG, SFB/TRR57) și subvenții de la Centrul Interdisciplinar de Cercetare Clinică (proiecte O3-1, O3-2) din cadrul Facultății de Medicină a Universității RWTH Aachen.
Finanțatorii nu au avut niciun rol în proiectarea studiului, colectarea și analiza datelor, decizia de publicare sau pregătirea manuscrisului.
Note
Notă editorială privind procesul de revizuire
Recenziile Facultății F1000 sunt comandate de la membrii prestigioasei Facultăți F1000 și sunt editate ca un serviciu pentru cititori. Pentru ca aceste recenzii să fie cât mai cuprinzătoare și accesibile posibil, arbitrii furnizează informații înainte de publicare și este publicată doar versiunea finală, revizuită. Arbitrii care au aprobat versiunea finală sunt enumerați cu numele și afilierile lor, dar fără rapoartele lor despre versiunile anterioare (orice comentarii vor fi deja abordate în versiunea publicată).
Arbitrii care au aprobat acest articol sunt:
Nahum Méndez-Sánchez, Unitatea de cercetare hepatică. Clinica și fundația Medica Sur, Mexico City, Mexic
Leo van Grunsven, Departamentul de Științe Biomedice de bază, Laboratorul de biologie a celulelor hepatice, Vrije Universiteit Bruxelles, Bruxelles, Belgia
- Evoluții recente în tehnologiile de prăjire aplicate alimentelor proaspete, Tendințe în știința alimentelor;
- Fiziopatologia fibrozei chistice Boala hepatică O canalopatie care duce la modificări la înnăscut
- Biologia nutrițională este o disciplină de bază neglijată a științei nutriționale
- Compusul natural din legume ajută la combaterea bolilor hepatice grase EurekAlert! Știri științifice
- Știința sau uleiul de șarpe pot detoxifia de fapt ficatul