Shohei Ikeda
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
b Departamentul de Medicină Cardiovasculară, Școala de Medicină a Universității Tohoku, Sendai, Japonia
Risa Mukai
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Wataru Mizushima
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Peiyong Zhai
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Shin-ichi Oka
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Michinari Nakamura
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Dominic P. Del Re
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Sebastiano Sciarretta
c Departamentul de Științe Medico-Chirurgice și Biotehnologii, Universitatea Sapienza din Roma, Latina, Italia
d Istituto Di Ricovero e Cura a Carattere Scientifico Neuromed, Pozzilli, Italy
Chiao-Po Hsu
e Divizia de Chirurgie Cardiovasculară, Departamentul de Chirurgie, Spitalul General al Veteranilor din Taipei, Școala Națională de Medicină a Universității Yang-Ming, Taiwan
Hiroaki Shimokawa
b Departamentul de Medicină Cardiovasculară, Școala de Medicină a Universității Tohoku, Sendai, Japonia
Junichi Sadoshima
un Departament de Biologie Celulară și Medicină Moleculară, Institutul de Cercetări Cardiovasculare, Rutgers New Jersey Medical School, Newark, New Jersey
Date asociate
Rezumat vizual
rezumat
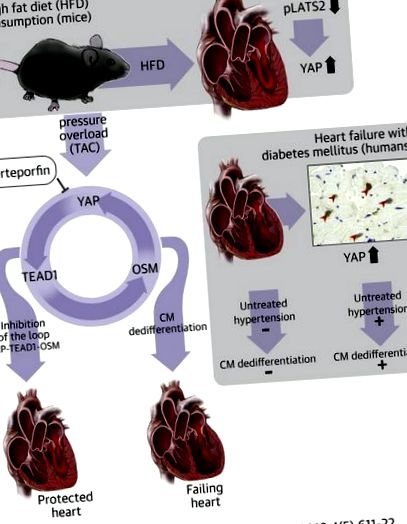
Pacienții cu diabet sunt mai predispuși la apariția insuficienței cardiace în prezența hipertensiunii arteriale decât cei fără diabet. Proteina asociată cu da (YAP), un efect cheie al căii de semnalizare Hippo, este activată în mod persistent în inimile diabetice, iar YAP joacă un rol esențial în medierea exacerbării insuficienței cardiace ca răspuns la supraîncărcarea presiunii din inimile șoarecilor hrăniți -dieta grasa. YAP a indus diferențierea cardiomiocitelor prin activarea factorului de amplificare transcripțională 1 (TEAD1), un factor de transcripție. Astfel, YAP și TEAD1 sunt ținte terapeutice promițătoare pentru pacienții diabetici cu hipertensiune arterială pentru a preveni dezvoltarea insuficienței cardiace.
Boala cardiovasculară este o cauză majoră a mortalității în țările dezvoltate (1). Recent, numărul cazurilor de boli cardiovasculare asociate sindromului metabolic, cum ar fi obezitatea și diabetul zaharat, a crescut rapid la nivel mondial (2). Acești pacienți dezvoltă adesea insuficiență cardiacă (IC) cu fracție de ejecție a ventriculului stâng conservată sau fracție de ejecție a ventriculului stâng redusă, deși tulburările metabolice, cum ar fi rezistența la insulină, adesea favorizează dezvoltarea IC cu fracție de ejecție a ventriculului stâng conservată la pacienții obezi cu diabet de tip 2 mellitus (3). În prezent, mecanismele moleculare ale cardiomiopatiei asociate cu sindromul metabolic rămân slab înțelese și, prin urmare, nu există un tratament specific.
Calea de semnalizare Hippo este o cale de semnalizare conservată evolutiv implicată în controlul dimensiunii organelor, regenerarea țesuturilor și tumorigeneză prin reglarea apoptozei și proliferării celulare (4). Componentele majore ale căii hipopotamului includ serina/treonina kinaze în amonte, și anume Mst1/2 (steril la mamifere 20 asemănător 1) și Lats1/2 (supresoare tumorale mari kinaza 1 și 2) și cofactorii factorului de transcripție nucleară din aval YAP (Da- proteină asociată) și TAZ (coactivator transcripțional cu motiv de legare PDZ), unde Mst1/2 și Lats1/2 reglează negativ nivelurile nucleare de YAP și TAZ (4). YAP și TAZ se leagă de factori de transcripție, cum ar fi TEAD (factorul de amplificare a transcripției) și FoxO1 (caseta de furcă O1), reglând astfel o varietate de funcții celulare, inclusiv proliferarea celulară și supraviețuirea celulară (5). Activarea căii Hippo este implicată intim în patogeneza bolilor de inimă, incluzând leziuni de ischemie/reperfuzie 6, 7, remodelare cardiacă și HF 8, 9. YAP este, de asemenea, implicat în regenerarea inimii postnatale după infarctul miocardic 10, 11, 12.
S-a propus că fie suprimarea componentelor căii hipopotamice din amonte, fie stimularea YAP pot fi utilizate ca o intervenție terapeutică pentru a facilita repararea și regenerarea inimii după infarctul miocardic acut 10, 11, 12; cu toate acestea, inactivarea persistentă a căii Hippo și activarea consecventă a YAP induce disfuncție cardiacă în prezența supraîncărcării presiunii (PO) prin activarea diferențierii cardiomiocitelor (13). Acest lucru sugerează că funcția YAP variază drastic în funcție de tipul de stres. Rămâne o întrebare importantă dacă activarea persistentă a YAP are loc în condiții relevante clinic și dacă suprimarea YAP îmbunătățește astfel de condiții.
YAP este suprareglat în celulele cancerului hepatic ca răspuns la un nivel ridicat de glucoză (14) și în celulele epiteliale ale rinichilor diabetici (15). Pacienții cu rezistență la insulină sunt mai predispuși la apariția hipertensiunii, iar coexistența diabetului și a hipertensiunii facilitează dezvoltarea HF 2, 16. Am întrebat: 1) dacă YAP promovează disfuncția cardiacă ca răspuns la PO la șoarecii hrăniți cu o dietă bogată în grăsimi ( HFD), un model de șoarece cu diabet zaharat de tip 2; 2) dacă exacerbarea cardiomiopatiei la șoarecii hrăniți cu HFD în prezența PO este însoțită de diferențierea cardiomiocitelor; și 3) dacă YAP este reglat în inima diabetică umană.
Metode
Modele de mouse
Toate experimentele pe animale au fost efectuate în conformitate cu protocoalele aprobate de Comitetul de îngrijire și utilizare a animalelor de la Universitatea Rutgers. Fundalul tuturor șoarecilor a fost C57BL/6J. Au fost descriși șoareci sistemici TEAD1 +/− (13). Șoareci de sex masculin de vârstă și sex potriviti au fost folosiți ca martori. Pentru tratamentul cu HFD, șoarecii masculi au fost împărțiți în mod aleatoriu în 2 grupuri și hrăniți fie cu dietă normală (ND), fie cu HFD timp de 8 săptămâni (17). Pentru experimentele cu verteporfin, șoarecii au fost împărțiți în mod aleatoriu în 2 grupe: verteporfin sau grupul de control DMSO. Șoarecii în vârstă de 12 săptămâni, după o intervenție chirurgicală simulată sau constricție aortică transversă (TAC) au fost injectați intraperitoneal cu verteporfin 100 mg/kg la fiecare două zile timp de 10 zile. Pentru măsurarea gradienților de presiune arterială, s-au folosit catetere de micromanometru de înaltă fidelitate (1.4-F, Millar Instruments Inc., Houston, Texas).
Constricție aortică transversală
Au fost descrise metodele utilizate pentru a impune PO la șoareci (13). Șoarecii masculi la vârsta de 12 săptămâni au fost împărțiți în mod aleatoriu în 2 grupe: PO cu TAC sau operație simulată. Ne-am concentrat pe șoareci masculi în acest studiu, deoarece studiile anterioare privind pierderea funcției YAP în inimă efectuate în acest laborator s-au concentrat și pe șoareci masculi (13). Șoarecii au fost anesteziați cu sodiu pentobarbital (60 mg/kg) și ventilați mecanic. Numărul de animale utilizate este descris în legenda fiecărei figuri. Aplicarea cu succes a TAC a fost confirmată de o viteză aortică transversală peste 4 m/s, evaluată prin ecocardiografie Doppler. Șoarecii care au murit de IC au fost incluși în analiza supraviețuirii, dar au fost excluși din evaluarea funcției cardiace și a histologiei. Nu au existat evenimente adverse neașteptate în timpul procedurii. Toate operațiile și analizele au fost efectuate într-un mod orbit în ceea ce privește genotipul șoarecilor.
Ecocardiografie
Șoarecii au fost anesteziați folosind 12 μl/g greutate corporală de 2,5% Avertin (Sigma-Aldrich, St. Louis, Missouri) și ecocardiografia a fost efectuată așa cum s-a descris anterior (13).
Mostre umane din inimi explantate
Mostre pentru imunocolorare
Studiul a fost aprobat de Comitetul de Etică al Facultății de Medicină a Universității Tohoku. Toți pacienții au acordat consimțământul scris pentru utilizarea țesuturilor cardiace pentru cercetare. Probele de biopsie miocardică au fost obținute de la pacienții cu IC la Spitalul Universitar Tohoku. Imunomarcarea a fost efectuată folosind 66 de probe de biopsie observabile consecutive obținute din ianuarie 2016 până în iunie 2017 (tabelele suplimentare 1 și 2). Douăzeci și cinci de pacienți au fost diagnosticați cu diabet, iar nivelul mediu al hemoglobinei glicozilate a fost de 6,98 ± 0,68% (comparativ cu 5,66 ± 0,32% la pacienții fără diabet; p Figura 1A, Figura suplimentară 1). Imunomarcarea secțiunilor cardiace a arătat că consumul de HFD a crescut semnificativ numărul de cardiomiocite cu nuclei YAP-pozitivi (Figura 1B). Analizele imunoblot au confirmat că nivelul proteinei YAP totale a crescut și în inimile șoarecilor hrăniți cu HFD (Figura 1C). Mai mult, consumul de HFD timp de 8 săptămâni a reglementat în mod semnificativ nivelul fosfo-Lats2, ceea ce sugerează că acest model imită deficiența de hipopotam (Figura 1C, Figura 2 suplimentară). Măsurătorile ecocardiografice (Tabelul suplimentar 3) și măsurătorile hemodinamice (Tabelul suplimentar 4) au indicat faptul că consumul de HFD timp de 8 săptămâni nu a indus disfuncție cardiacă sistolică, în concordanță cu rezultatele noastre anterioare (17).
- Sistemul de schimb alimentar diabetic nu este un plan de slăbire - de unde își iau proteinele gorilele
- De ce dieta de ridicare a greutăților include multe proteine
- Necesarul de proteine dietetice al unui somn bagrid, Mystus nemurus (Cuvier & Valenciennes),
- Adevărul despre bicicliști și proteine ACTIVE
- De ce consumul de proteine te face să te simți fericit