Abstract
fundal
Tratamentul fenilcetonuriei (PKU) cu diclorhidrat de sapropterină la pacienții receptivi de la o vârstă fragedă poate avea multe avantaje pentru pacient față de restricția alimentară numai. În consecință, aprobarea sapropterinei în Uniunea Europeană a fost extinsă în 2015 pentru a include pacienții cu vârsta cuprinsă între 0-4 ani, aducând gama de vârstă a tratamentului în conformitate cu cea din SUA și oferind o opțiune de tratament suplimentară pentru acei pacienți cu PKU care răspund sau parțial receptiv la tratamentul cu sapropterină. Ulterior, au fost publicate ghiduri europene privind diagnosticul și managementul pacienților cu PKU. Cu toate acestea, testarea pentru PKU poate fi solicitantă și necesită o expertiză specială. Am compilat îndrumări din lumea reală bazate pe experiență într-un format algoritmic pentru a completa liniile directoare publicate, cu scopul general de a realiza îngrijiri optimizate și individualizate pentru pacienții cu PKU.
Rezultate
Ghidul nostru acoperă aspecte cum ar fi cum să efectuați, să monitorizați și să interpretați măsurile biochimice adecvate pentru a obține un management eficient al pacientului și rezultatele dorite, cum să efectuați un test de încărcare a tetrahidrobiopterinei (BH4) pentru a evalua capacitatea de reacție la nou-născuți și cum să inițiați tratamentul cu sapropterină la pacienții din naștere. De asemenea, oferim opinia noastră de experți cu privire la începerea farmacoterapiei la pacienții care anterior erau tratați doar prin dietă.
Concluzii
Orientările din lumea reală sunt deosebit de importante în gestionarea strategiilor terapeutice la nou-născuții cu PKU pentru a obține rezultate optime pe termen lung și vor servi ca o completare a celorlalte linii directoare publicate.
Introducere
Fenilcetonuria (PKU) este o tulburare metabolică autozomală-recesivă rară în care o deficiență a enzimei hepatice fenilalanină hidroxilază (PAH) are ca rezultat incapacitatea completă sau parțială de a metaboliza fenilalanina (Phe) în tirozină [1]. Acest lucru poate duce la creșterea concentrațiilor de Phe din sânge care, dacă nu sunt tratate, pot traversa bariera hematoencefalică și pot provoca multe efecte dăunătoare, inclusiv întârzierea mentală profundă, convulsii și comportament autist [2]. Incidența generală a PKU variază foarte mult în întreaga lume, de la 1 la 2600 de nașteri în Turcia [3] la mai puțin de 1 la 100.000 de nașteri în Japonia [4, 5]; alte incidențe raportate sunt 1 din 4500 de nașteri în Irlanda [6, 7], 1 din 10.000 de nașteri în Regatul Unit [7, 8], 1 din 11.000 de nașteri în China [9, 10] și 1 din 15.000 de nașteri în Statele Unite [11].
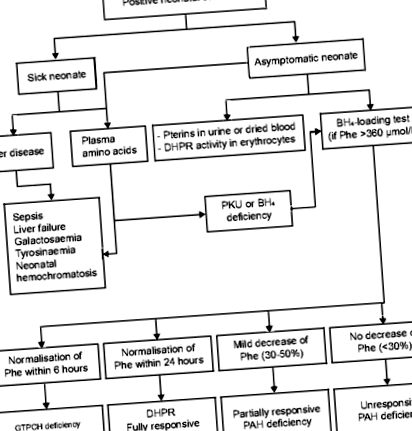
Evenimentele adverse raportate la copii tratați cu sapropterină au fost în esență aceleași cu cele raportate la adulți. În studiile clinice la copii cu vârsta de 4 ani și peste, evenimentele adverse cu o incidență ≥10% au fost cefaleea și rinoreea; cele care au o incidență ≥1% până la 120 μmol/L) și un raport crescut Phe/tirozină (> 3 dacă se utilizează spectrometria de masă în tandem) trebuie confirmate folosind o a doua probă de sânge [29]. Trebuie excluse toate cauzele HPA neonatale, inclusiv boli hepatice, deficit de PAH, defecte genetice în sinteza sau regenerarea BH4 sau DNAJC12. Investigații suplimentare și genotipare ar trebui efectuate și în perioada neonatală, pentru a evalua probabilitatea de reacție la BH4 și, prin urmare, a ghida opțiunile de tratament (Fig. 1) [28]. După cum sa menționat anterior, pacienții cu două mutații nule în trans poziția nu va răspunde la tratamentul cu BH4.
Algoritm de diagnostic al diferitelor tipuri de PKU. BH4: Tetrahidrobiopterină; DHPR: Dihidropteridin reductază; GTPCH: Guanozin trifosfat ciclohidrolază; HAP: fenilalanină hidroxilază; Phe: fenilalanină; PKU: Fenilcetonurie; PTPS: 6-piruvoiil-tetrahidropterin sintază. Recomandăm efectuarea unui grup complet de investigații, chiar și la pacienții cu genotip necunoscut care nu răspund la testul de încărcare BH4. Acest lucru va asigura că subtipul PKU poate fi identificat, ceea ce poate fi benefic pentru managementul continuu al pacientului
Efectuarea testului de încărcare BH4 la nou-născuți
Există mai multe avantaje în efectuarea testului de încărcare BH4 la nou-născuți (Tabelul 1). Testul trebuie efectuat cât mai curând posibil după testul pozitiv pentru HPA. În mod ideal, acest lucru ar trebui să se facă odată ce s-a stabilit că nou-născutul nu prezintă boli hepatice sau boli generale și dacă concentrațiile de Phe din sânge ating sau depășesc nivelul de 360 μmol/L. Nou-născutul trebuie să urmeze o dietă normală în timpul testului.
În test, a fost recoltată o probă de sânge capilară de bază pentru a măsura nivelul de Phe, urmată de administrarea de sapropterină 20 mg/kg (o singură doză) dizolvată în laptele matern sau formulele pentru sugari (Fișa suplimentară 1). După administrarea sapropterinei și pe tot parcursul testului, trebuie administrat la cerere un regim normal de hrănire (de exemplu, lapte matern sau formulă obișnuită pentru sugari) și nu trebuie administrată formulă medicală fără Phe. Probele de sânge capilar pentru măsurarea nivelurilor de Phe sunt prelevate la 4, 6, 8, 12, 16 și 24 de ore după administrarea sapropterinei (Dosar suplimentar 2). Testul trebuie făcut pe o perioadă de 24 de ore, deoarece nu este posibilă întârzierea tratamentului la nou-născuții cu PKU clasică, care nu va răspunde la BH4, mai mult de 24 de ore. Rezultatele trebuie să fie disponibile în termen de 24 de ore după terminarea testului, iar tratamentul poate fi apoi implementat; aceasta poate fi doar sapropterină dacă nivelul Phe scade în intervalul țintă (pacienți complet receptivi) sau o dietă cu restricție Phe (cu sau fără sapropterină) dacă concentrațiile de Phe din sânge rămân peste intervalul țintă.
Există unele date care sugerează că un test negativ BH4 ar putea să nu excludă reacția pe termen lung la BH4; prin urmare, cu excepția pacienților cu două mutații nule, poate exista un caz pentru retestarea capacității de reacție la BH4 atunci când copilul este mai mare [30].
Interpretarea rezultatelor testului de încărcare BH4
Exemple ilustrative de rezultate ale testului de încărcare BH4 neonatal. BH4: Tetrahidrobiopterină; HAP: fenilalanină hidroxilază; Phe: fenilalanină; PTPS: 6-piruvoiil-tetrahidropterin sintază
Studii de caz pentru a arăta răspunsul în timpul fazei de testare la opt pacienți receptivi la BH4. BH4: Tetrahidrobiopterină; Phe: fenilalanină. P1-8, pacienți 1-8
Este demn de remarcat faptul că pragul ≥30% este arbitrar; de aceea, pacienții cu o scădere mai mică a concentrației Phe pot prezenta în continuare o creștere semnificativă clinic a toleranței Phe în timpul unui studiu de terapie pe termen lung, în principal dacă testul de încărcare BH4 a fost efectuat în timp ce concentrațiile de Phe din sânge sunt scăzute. În schimb, pacienții care prezintă o reducere a concentrației de Phe din sânge de ≥ 30% s-ar putea să nu răspundă în mod satisfăcător la sapropterină în timpul unui studiu de terapie pe termen lung. Acesta este adesea cazul dacă reducerea este doar puțin mai mare de 30% sau este observată doar la un moment de testare. Prin urmare, un rezultat pozitiv al testului de încărcare BH4 ar trebui revizuit critic și confirmat printr-un studiu de terapie pe termen lung, cu un beneficiu semnificativ determinat în termeni de toleranță Phe. La pacienții care prezintă o scădere a Phe din sânge cu peste 30%, se poate efectua un studiu de 1 lună. Acest lucru se poate face doar cu sapropterină, dacă nivelul Phe a scăzut în intervalul țintă (pacienți complet receptivi) sau sapropterină combinată cu o dietă restricționată de Phe, dacă nivelurile de Phe din sânge rămân peste intervalul țintă. Pacienții care nu răspund trebuie să înceapă o dietă cu restricție Phe.
Tratamentul cu sapropterină pentru nou-născuții cu deficit de PAH receptiv la BH4
Două scenarii potențiale ar putea apărea după finalizarea testului de încărcare BH4. Dacă este posibil să se obțină rezultatele a doua zi după efectuarea testului de încărcare, tratamentul cu BH4 poate fi implementat imediat (în cazul unui răspuns complet). Dacă nu este posibil să se obțină rezultatele în acest interval de timp, trebuie să înceapă tratamentul dietetic, fie numai cu alimente medicale fără Phe dacă se poate administra valoarea de bază Phe> 600 μmol/L sau o dietă mixtă de lapte matern/formulă completă pentru sugari. dacă valoarea Phe inițială 360 μmol/L: reduceți aportul de Phe cu 10-30%, în funcție de gradul de creștere a valorii sanguine [21, 22, 34].
Poate dura câteva săptămâni pentru a discerne aportul maxim de Phe care poate fi tolerat, menținând concentrațiile de Phe din sânge în intervalul țintă. Prin urmare, algoritmul de mai sus trebuie utilizat cel puțin 4 săptămâni. Dacă s-a ales o doză inițială de 10 mg/kg/zi și efectul asupra toleranței la Phe din dietă nu a fost satisfăcător, ar trebui luată în considerare o creștere a dozei la 20 mg/kg/zi. După ce pacientul a atins aportul maxim normal de Phe, cu concentrații de Phe din sânge mai mici de 360 μmol/L, trebuie efectuată o evaluare critică a beneficiilor tratamentului cu sapropterină. Luarea în considerare a răspunsurilor la anumite întrebări poate fi utilă în această evaluare (Tabelul 2).
Cursul unui studiu de terapie de succes cu sapropterină la un nou-născut cu deficit de receptivitate BH4 este prezentat în Fig. 4.
Reprezentarea diagramă a cursului unui studiu de succes cu terapie cu sapropterină la un nou-născut cu deficit de PAH receptiv la BH4. BH4: Tetrahidrobiopterină; HAP: fenilalanină hidroxilază; Phe: fenilalanină; PKU: Fenilcetonurie
Tratamentul cu sapropterină pentru un copil cu vârsta mai mică de 4 ani cu tratament dietetic anterior
Atunci când se ia în considerare farmacoterapia pentru un copil cu vârsta mai mică de 4 ani cu un control alimentar anterior, algoritmul de tratament din Fig. 5 împreună cu următoarele întrebări sunt utile (Tabelul 3).
Dacă răspunsurile la oricare dintre întrebări sunt pozitive, ar trebui efectuate teste suplimentare pentru reacția la BH4. Trebuie remarcat faptul că înainte de aprobarea sapropterinei la copii cu vârsta cuprinsă între 0-4 ani, în majoritatea țărilor din Europa a fost posibilă autorizarea testului de încărcare BH4, dar nu și a tratamentului; prin urmare, a fost posibil să existe situația de test pozitiv cunoscut fără a fi tratat copilul. Dacă rezultatele unui test de încărcare BH4 nu sunt disponibile, genotiparea poate ajuta la estimarea probabilității de reacție la BH4 (Tabelul 4).
Trebuie remarcat faptul că nu este ușor să efectuați un test de încărcare BH4 la pacienții care sunt bine gestionați de dietă și, prin urmare, au concentrații scăzute de Phe în sânge (și acest lucru susține indirect efectuarea testului în perioada neonatală, când nivelul Phe este crescut în mod natural) . În aceste cazuri, se recomandă în schimb un studiu de tratament cu diclorhidrat de sapropterină. Dacă nu puteți efectua un studiu de tratament, trebuie efectuat un test de încărcare BH4. În acest caz, concentrația de Phe la începutul testului ar trebui să fie stabilă la> 360 μmol/L, ceea ce necesită în general o creștere a aportului de Phe. Acest lucru cauzează adesea dificultăți și trebuie făcut într-un management atent.
Efectuarea unui studiu de terapie cu sapropterină la un pacient mai mic de 4 ani administrat anterior doar prin dietă
Testele de terapie sunt împărțite în faze de screening și testare (Tabelul 5) și se utilizează un algoritm pentru ajustarea aportului alimentar de Phe.
Faza de screening
Pacientul ar trebui să fie liber de orice infecție sau boală la începutul testului. Dieta este inițial continuată ca de obicei, iar un jurnal alimentar este ținut timp de 1 săptămână. Din aceasta, se calculează toleranța Phe inițială (PheTol0) și cantitatea inițială de proteine din amestecul de aminoacizi (supliment de aminoacizi [AAS0]). Eșantioanele zilnice de sânge în post sunt colectate în prima săptămână și se determină concentrația medie de Phe din sânge (Phe0). Durata acestei faze poate fi mai mare de 1 săptămână în unele cazuri.
Faza de testare
Sapropterina se administrează dimineața la 10 mg/kg/zi sub formă de doză unică dizolvată în lapte (fișa suplimentară 1). Un jurnal alimentar este păstrat din nou timp de 1 săptămână și se calculează toleranța Phe curentă (PheTol1) și cantitatea de proteine din amestecul de aminoacizi (AAS1). Eșantioanele zilnice de sânge în post sunt colectate în timpul săptămânii și se determină concentrația medie de Phe din sânge (Phe1).
Confirmarea reacției BH4 de către algoritmul de admisie Phe
Algoritmul de mai jos definește modul de ajustare a aportului de Phe pe baza concentrațiilor de Phe din sânge.
Concentrația medie de Phe din sânge
360 μmol/L: nu modificați aportul de Phe.
Concentrația medie de Phe din sânge 360 μmol/L: reduce aportul de Phe cu 10-30%, în funcție de gradul de creștere a valorii sângelui [21, 22, 34].
După aceasta, se prelevează probe zilnice de sânge în repaus zilnic și se determină concentrațiile zilnice de Phe din sânge (Phe2 până la Phex). Am dori să subliniem că un număr mare de probe zilnice de sânge este util pentru a judeca controlul metabolic; cu toate acestea, dacă acest lucru nu este realizabil, frecvența prelevării de sânge poate fi redusă.
Durata fazei de testare
La o lună după începerea studiului, cantitatea de amestec de aminoacizi administrată (AAS1) este ajustată. Dacă există o creștere suplimentară a aportului de Phe și, prin urmare, a aportului de proteine naturale, se fac alte ajustări ulterior (AASx). Algoritmul buclei se repetă până la atingerea stării de echilibru (cu orice creștere suplimentară a aportului de Phe, concentrația de Phe din sânge este peste 360 μmol/L în două probe succesive). Aportul de Phe este apoi redus inițial cu 10%. Dacă concentrațiile de Phe din sânge în săptămâna următoare rămân în afara intervalului țintă, aportul de Phe este redus cu încă 10% (ilustrat în Fig. 4). Dacă efectul asupra toleranței Phe din dietă nu a fost satisfăcător la o doză de 10 mg/kg/zi, trebuie luată în considerare o creștere a dozei la 20 mg/kg/zi. La sfârșitul fazei de testare, sunt documentate următoarele valori: diferența dintre Phe0 și Phex; diferența dintre PheTol0 și PheTolx; și diferența dintre AAS0 și AASX.
Monitorizarea periodică a sângelui și evaluări dietetice și nutriționale sunt recomandate pacienților în timpul tratamentului de lungă durată cu sapropterină [29].
Evaluare
Odată ce valorile pentru concentrația de Phe din sânge, toleranța Phe și necesarul de aminoacizi sintetici au fost calculate, se efectuează o analiză a beneficiilor critice, mai întâi în cadrul echipei care tratează pacientul și apoi împreună cu familia pacientului. Beneficiul neechivoc din perspectivă medicală este considerat ca o creștere a toleranței Phe cu ≥100% și o reducere cu 50% a aportului de amestec de aminoacizi. Modificările minore trebuie evaluate individual în contextul clinic general. Pentru pacienții cu valori ale Phe în afara intervalului țintă, efectul terapeutic poate consta și într-o reducere substanțială a concentrației medii de Phe.
Concluzii
Abrevieri
Colegiul American de Genetică și Genomică Medicală
cantitatea de proteine din amestecul de aminoacizi
- Efectul intervenției dietetice și al tratamentului hipolipemiant asupra vasoreactivității brahiale la pacienți
- Eficacitatea oxibutininei pentru tratamentul hiperhidrozei la pacienții supraponderali și obezi -
- Recomandări privind dieta și stilul de viață pentru tratamentul tusei cronice și a bolilor cronice - PubMed
- Calitatea dietei ar putea fi o țintă cheie de tratament pentru pacienții cu depresie - consilier în psihiatrie
- Eficacitatea taurinei în tratamentul anginei de stres la pacienții cu postinfarct