Abstract
1. Peisajul celular și molecular al creierului în boala Alzheimer (AD)
Alte caracteristici ale peisajului Aβ și tau-creilat al creierului AD sunt reducerea numărului de sinapse și moartea neuronilor. Există mai multe linii de dovezi care indică sinapsele ca situri în care procesul neurodegenerativ începe în AD. APP este transportat axonal și se acumulează în terminale presinaptice, iar datele sugerează că Aβ este produs în cantități mari în terminalele sinaptice [9,10]. Sinapsele sunt deosebit de vulnerabile la disfuncții și daune permanente cauzate de Aβ, după cum s-a demonstrat în experimentele electrofiziologice în care expunerea feliilor de creier la Aβ afectează plasticitatea sinaptică [11,12] și studiile neuronilor cultivați și a terminalelor sinaptice izolate care au arătat că Aβ poate afecta transportoare de ioni și glucoză ale membranei sinaptice și pot perturba bioenergetica mitocondrială [13, 14]. Studiile recente de imagistică in vivo cu microscopie cu doi fotoni de înaltă rezoluție au arătat în mod clar o asociere fizică intimă între agregatele Aβ și degenerarea neuritei și sinapselor [15]. În plus, Aβ afectează transportul axonal care poate contribui la acumularea intraneuronală de Aβ, disfuncția rețelei neuronale și răspândirea transneuronală a procesului neurodegenerativ în AD [16, 17].
2. Creierul de îmbătrânire I: Stresul oxidativ și metabolic Compromis Neuronal Ca 2+ Manipulare
Însoțirea deteriorării oxidative a neuronilor în timpul îmbătrânirii creierului este o afectare progresivă a funcției mitocondriilor. Studiile de imagistică a metabolismului regional al energiei cerebrale la subiecții umani au demonstrat hipometabolism în hipocampus și în cortexul frontal în timpul îmbătrânirii, ceea ce prezice dezvoltarea ulterioară a tulburărilor cognitive și AD [32,33]. Studiile asupra mitocondriilor izolate din creierul rozătoarelor de diferite vârste au furnizat dovezi că capacitatea mitocondriilor de a genera ATP este compromisă odată cu înaintarea în vârstă și că mitocondriile din celulele vechi ale creierului prezintă leziuni crescute mediate de radicalii liberi [34]. Deficitul de metabolism al energiei celulare poate face neuronii vulnerabili la leziuni excitotoxice [35], în special atunci când neuronii se confruntă cu stresurile suplimentare ale acumulărilor de Aβ și tau [36].
Neuronii utilizează multe dintre aceleași mecanisme pentru semnalizarea Ca 2+ și restaurarea gradienților transmembranali Ca 2+ ca și alte tipuri de celule, inclusiv: canale Ca 2+ cu tensiune și o Ca 2+ -ATPază în membrana plasmatică; receptori pentru diferiți liganzi care sunt cuplați la hidroliza fosfolipidelor inozitolice și eliberarea de Ca 2+ din depozitele de reticul endoplasmatic IP3 (ER) Ca 2+; Canalele receptorilor de ryanodină ER care mediază eliberarea de Ca 2+ indusă de Ca 2+; și sistemele mitocondriale de captare și eliberare a Ca 2+ (a se vedea [37] și [38] pentru revizuire). În plus, neuronii posedă, de asemenea, sisteme unice pentru semnalizarea locală Ca 2+ la sinapse inclusiv; canale Ca 2+ cu tensiune presinaptică, cuplate la mașinile de fuziune cu membrană a veziculelor sinaptice [39]; canale de receptor glutamat excitator postsinaptic care fluxează fie Na + (receptori AMPA), fie Ca 2+ (receptori NMDA) [40,41]; și proteinele care leagă Ca 2+ [42].
Studiile asupra modelelor de cultură animală și celulară au arătat clar că capacitatea neuronilor de a regla nivelurile și dinamica celulară a Ca 2+ este compromisă în mod corespunzător atât de stresul oxidativ, cât și de metabolismul energiei celulare afectate [43]. Peroxidarea lipidelor membranare are efecte deosebit de perturbatoare asupra homeostaziei neuronale Ca 2+. Peroxidarea lipidelor apare în mod obișnuit atunci când nivelurile de radical anionic superoxid celular și peroxid de hidrogen sunt crescute în prezența unor urme egale de Fe 2+ sau Cu +, rezultând producerea de radical hidroxil [23]. Radicalul hidroxil atacă legăturile duble din lipidele din membrană, producând astfel o serie de aldehide. Produsul aldehidic al peroxidării lipidice 4-hidroxinonenale (HNE) poate juca un rol deosebit de important în perturbarea homeostaziei neuronale Ca 2+ în timpul îmbătrânirii și AD datorită capacității sale de a modifica covalent proteinele de pe reziduurile de cisteină, lizină și histidină. S-a demonstrat în modele experimentale că HNE afectează funcția a cel puțin 4 proteine despre care se știe că joacă roluri majore în semnalizarea neuronală Ca 2+: membrana plasmatică Na +/K + -ATPaza; membrana plasmatică Ca 2+ -ATPaza; transportorul neuronal de glucoză GLUT3; canale de Ca 2+ cu tensiune [44-46]; și transportorul de glutamat în astrocite [47].
Scăderile nivelurilor de ATP și NAD +, substraturile de energie primară din neuroni, sunt implicate în disfuncția cognitivă legată de vârstă și AD. Aceste substraturi energetice sunt deosebit de critice pentru funcționarea și supraviețuirea neuronilor, deoarece neuronii trebuie să consume cantități mari de energie pentru a restabili rapid gradienții ionici după activarea sinaptică și generarea potențialului de acțiune. Atunci când nivelurile de energie celulară sunt reduse în neuroni, așa cum se întâmplă dramatic în timpul unui accident vascular cerebral ischemic și mai insidios în timpul îmbătrânirii și în AD, nivelurile intracelulare de Ca 2+ rămân crescute ca urmare a unui aflux susținut prin canale de glutamat și tensiune în combinație cu activități de ATPază cu motive ionice afectate [48-50]. Epuizarea NAD + poate fi prevenită prin administrarea nicotinamidei, permițând astfel neuronilor să mențină nivelurile intracelulare de Ca 2+ suficient de scăzute pentru a preveni deteriorarea și moartea [51].
3. Îmbătrânirea creierului II: Abilități afectate de prevenire și reparare a daunelor celulare
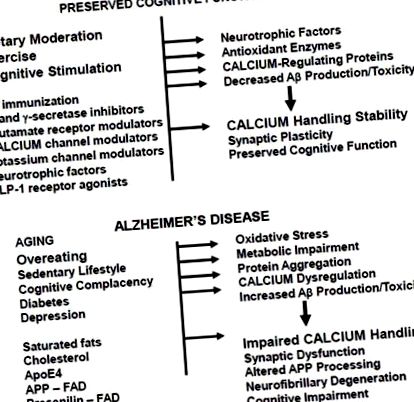
Care sunt mecanismele prin care exercițiile fizice și restricția energetică alimentară protejează creierul împotriva afectării cognitive legate de vârstă și AD? Mai multe studii au arătat că exercițiul [62] și restricția de energie [63,64] cresc producția de factor neurotrofic derivat din creier (BDNF). Acest lucru contribuie probabil la efectele benefice ale exercițiului fizic și restricționarea energiei asupra cogniției, deoarece BDNF joacă roluri importante în plasticitatea sinaptică și neurogeneză, iar BDNF poate proteja neuronii împotriva insultelor oxidative și metabolice (vezi [65, 66] pentru recenzie). Restricția energetică dietetică, exercițiile fizice și BDNF pot proteja neuronii împotriva disfuncției și decesului în modele experimentale în care afectarea neuronilor este mediată de Ca 2+, inclusiv convulsii excitotoxice, accident vascular cerebral ischemic și AD [60, 67-69]. Dovezi că semnalizarea BDNF este afectată în AD include: niveluri reduse de mARN și proteine BDNF în regiunile creierului vulnerabile ale pacienților cu AD comparativ cu subiecții martori egalați cu vârsta [70]; o asociere negativă între concentrația de lichid cefalorahidian BDNF și funcția cognitivă la subiecții vârstnici [71]; niveluri reduse de BDNF asociate cu starea de agregare Aβ în creier la modelele transgenice de șoarece de AD [72]; și Aβ afectează traficul/semnalizarea BDNF retrogradă [73].
AD și alte tulburări neurodegenerative majore legate de vârstă implică acumulări intracelulare anormale de proteine care diferă oarecum între tulburări: tau și Aβ în AD, α-sinucleină în boala Parkinson și hunttin în boala Huntington. Din ce în ce mai multe dovezi sugerează că mecanismele celulare de „eliminare a gunoiului” contribuie la acumularea de proteine anormale. Cele două sisteme majore de eliminare a gunoiului, proteazomul și aparatul de autofagie/lizozom, devin disfuncționale în AD [90, 91]. Creșteri excesive ale nivelurilor intracelulare de Ca 2+ pot afecta funcția proteazomului și autofagia [92, 93] pe de o parte, în timp ce afectarea activității proteazomului și a autofagiei poate duce la dereglarea homeostaziei celulare a Ca 2+ [94, 95] pe de altă parte.
4. Întreruperea homeostaziei neuronale Ca 2+ de către β-peptida amiloidă
Studiile asupra probelor de țesut cerebral postmortem de la pacienții cu AD și a modelelor animale de AD susțin un rol pentru întreruperea neuronală (în special sinaptică) a reglării Ca 2+ în acțiunea neurotoxică a Aβ. S-au raportat dovezi pentru hiperactivarea calpainelor (proteaze dependente de Ca 2+) la neuronii care suferă degenerescență neurfibrilară în AD [105, 106]. Imagistica depozitelor de Aβ și a nivelurilor intracelulare de Ca 2+ în neuroni în creierul șoarecilor mutanți APP au furnizat dovezi convingătoare că Aβ determină o creștere aberantă a nivelurilor de Ca 2+ la neurite [107]. Un studiu ulterior a furnizat dovezi că activarea fosfatazei dependente de Ca 2+ calcineurină mediază pierderea coloanei vertebrale indusă de Aβ și degenerarea dendritică [108]. S-a raportat că creșterile Ca 2+ mediate de receptorul glutamat cauzează modificări ale tau similare cu cele observate în încurcăturile neurofibrilare [109], sugerând un rol esențial pentru reglarea aberantă a Ca 2+ neuronală în procesul neurodegenerativ în AD.
5. Forma secretată derivată de α-secretază a APP stabilizează homeostazia neuronală a calciului
6. Mutațiile prezenilinei-1 și eliberarea Ca 2+ a reticulului endoplasmatic perturbat în AD
Au fost identificate numeroase familii în care AD cu debut precoce moștenit în mod predominant este cauzat de o mutație greșită a genei presenilin-1 [118]. Indivizii afectați devin de obicei simptomatici atunci când au 40 sau 50 de ani. Presenilin-1 este componenta enzimatică a complexului enzimatic γ-secretază care clivează APP pentru a genera Aβ, iar mutațiile cauzatoare de AD în presenilin-1 cresc producția de Aβ 42 [119]. Mutațiile prezenilinei-1 pot afecta negativ neuronii prin creșterea producției de Aβ 42 care perturba apoi reglarea neuronală Ca 2+ așa cum este descris în secțiunea 4 de mai sus. Cu toate acestea, dovezi considerabile sugerează că mutațiile cauzatoare de AD în presenilin-1 pot perturba o funcție diferită a presenilin-1, o funcție în reglarea homeostaziei Ca 2+ a reticulului endoplasmatic (ER).
Baza moleculară a manipulării perturbate a ER Ca 2+ cauzată de mutațiile presenilin-1 nu este încă stabilită, dar descoperirile recente sugerează că cel puțin unele mutații duc la pierderea unei funcții normale de manipulare a Ca 2+ a presenilinei-1 de tip sălbatic. Tu și colab. [132] a raportat că prezenilina-1 de tip sălbatic formează canale de scurgere Ca 2+ în membrana ER și că mutațiile prezenilinei-1 perturbă această funcție propusă a presenilinei-1. Această din urmă constatare pare să ofere o explicație pentru dovezile anterioare că rezerva ER Ca 2+ este anormal crescută în neuronii care exprimă presenilin-1 mutant. Alte studii au furnizat dovezi că presenilin-1 interacționează cu receptorul IP3 în ER și că mutațiile presenilin-1 modifică activitatea de porțiere a receptorului, astfel încât să sporească deschiderea și eliberarea de Ca 2+ din ER [133]. Rezultatele înregistrărilor electrofiziologice ale curenților receptorilor IP3 în limfoblaste derivate de la persoanele cu mutații prezenilin-1 cauzatoare de AD sau neuroni corticali de la șoareci mutanți presenilin-1 au demonstrat că mutațiile presenilin-1 cresc timpul în care canalele receptorului IP3 au fost într-un loc deschis Mod rafală Ca 2+ [134].
7. Implicarea tulburărilor mitocondriale în tratamentul neuronal aberant Ca 2+ în AD
8. Concluzii și implicații pentru noi abordări pentru prevenirea și tratamentul AD
Inhibitorii colinesterazei care pot oferi o îmbunătățire temporară a funcției cognitive sunt medicamentul cel mai larg prescris pentru pacienții cu AD. În prezent, accentul major al programelor de dezvoltare a medicamentelor în întreaga industrie farmaceutică și în mediul academic este pe prevenirea producției de Aβ prin țintirea γ- și β-secretazelor sau îmbunătățirea clearance-ului Aβ utilizând abordări de imunoterapie [8, 148]. Din păcate, totuși, un studiu clinic recent de fază III a unui inhibitor de γ-secretază nu numai că nu a avut un efect benefic, ci a accelerat declinul cognitiv la pacienții cu AD [149]. Studiile cu imunoterapie Aβ s-au dovedit, de asemenea, dezamăgitoare cu reacții adverse severe la mulți pacienți cu AD supuși imunizării active [150], iar într-un studiu recent de imunizare pasivă în care un anticorp monoclonal Aβ a fost administrat pacienților cu AD nu a existat niciun efect semnificativ al anticorpului Aβ în analiza principală a eficacității [151].
Mulțumiri
Acest articol a fost scris ca un articol original de recenzie/opinie și nu a fost destinat să fie o revizuire cuprinzătoare. Prin urmare, îi recunoaștem pe acei oameni de știință care au contribuit la acest domeniu de investigație, dintre care mulți sunt citați în alte articole de recenzie recente (a se vedea articolele de recenzie citate mai jos). Această lucrare a fost susținută de Programul de cercetare intramurală al Institutului Național pentru Îmbătrânire, NIH.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- 28 de sfaturi nutriționale digestibile pentru cei cu boală Alzheimer
- Boala Alzheimer Cele 7 etape ale bolii
- O dietă ketogenică experimentală pentru boala Alzheimer a fost densă din punct de vedere nutrițional și bogată în legume
- Calciul în miturile și realitățile bolilor cronice ale rinichilor Societatea Americană de Nefrologie
- Echilibrul calciului în bolile renale cronice