Abstract
Interesul pentru alimentația de control și a crescut ca urmare a epidemiei de obezitate și a incidenței crescânde a bolilor metabolice. Creierul detectează modificări în depozitele de energie și declanșează răspunsuri metabolice și comportamentale menite să mențină echilibrul energetic. Homeostazia energetică este controlată în principal de circuitele neuronale din hipotalamus și trunchiul cerebral, în timp ce aspectele de recompensare și motivație ale comportamentului alimentar sunt controlate de neuronii din regiunile limbice și cortexul cerebral. Acest articol oferă o perspectivă integrată asupra modului în care semnalele metabolice care provin din tractul gastrointestinal, țesutul adipos și alte organe periferice vizează creierul pentru a regla hrănirea, consumul de energie și hormonii. Cunoașterea acestor căi complexe este crucială pentru patogeneza și tratamentul obezității și anomaliile metabolismului glucozei și lipidelor.
Perspectiva istorica
Conexiunea intestin-creier
Conexiunea neuronală dintre intestin și creier a fost investigată utilizând abordări chirurgicale și chimice [11]. Stimularea vagală gastrică sau distensia balonului induc sațietate. Infuzia de soluții bogate în grăsimi, carbohidrați și proteine în intestinul subțire proximal reduce dimensiunea ulterioară a mesei. Acest efect este blocat de aplicarea neurotoxinei capsacinoase senzoriale pe vag sau de denervarea chirurgicală [11-13]. Întreruperea chirurgicală a fibrelor vagale senzoriale din intestin crește dimensiunea și durata mesei [12]. Blocarea transmiterii aferente vagale a trunchiului cerebral utilizând antagonistul receptorului N-metil-d-aspartat MK801 crește, de asemenea, dimensiunea mesei [14]. Împreună, aceste studii demonstrează un puternic control de feedback negativ al inervației aferente vagale la hrănire [11-13].
Tractul gastrointestinal secretă hormoni care controlează hrănirea. Aceste peptide accesează creierul parțial prin zona postrema, un organ circumventricular situat în acoperișul celui de-al IV-lea ventricul. Zona postrema este situată deasupra SNT, permițând astfel neuronilor să răspundă direct la hormonii circulați ai intestinului și să retransmită aceste semnale către circuitele neuronale din trunchiul cerebral și din creier.
Colecistochinina (CCK) a fost prima peptidă secretată în intestin care a fost identificată ca factor de sațietate [15]. CCK scade dimensiunea mesei [15, 16]. Antagoniștii receptorilor CCK1 blochează efectele de sațietate ale infuziilor de nutrienți în intestin și stimulează hrănirea animalelor hrănite [17]. Nervii vagali din intestin exprimă receptorii CCK1 și sunt stimulați de CCK. Vagotomia senzorială chimică sau chirurgicală a eliminat efectele de sațietate ale CCK la rozătoare [12, 15, 16]. În comparație cu șobolanii slabi Long-Evans Tokushima Otsuka (LETO), șoarecii Otsuka Long-Evans Tokushima Fatty (OLETF) lipsiți de receptori funcționali CCK1 au consumat excesiv o dietă bogată în grăsimi, care a dus la obezitate și diabet [17]. Hiperfagia la acest animal a fost asociată cu o expresie mai mare a neuropeptidei Y (NPY) în nucleul dorsomedial al hipotalamusului [17]. Spre deosebire de aceste rezultate la șobolanii OLETF, o dietă bogată în grăsimi a crescut aportul de alimente și a indus obezitatea în aceeași măsură atât la șoarecii knock-out de tip sălbatic, cât și la cei receptori CCK1 [17, 18]. Mai mult, spre deosebire de șobolanii OLETF, expresia genei NPY nu a crescut în nucleul dorsomedial la șoarecii cu deficit de receptor CCK1 [17]. Astfel, receptorii CCK1 au efecte diferite ale aportului de hrană și ale greutății la speciile de rozătoare.
Peptida asemănătoare glucagonului (GLP) -1 este scindată de proglucagon și eliberată din celulele L ale intestinului ca răspuns la mese [19]. Agoniștii receptorilor GLP-1 și GLP-1 cu acțiune mai lungă, cum ar fi exendina-4, scad aportul de alimente la rozătoare atunci când sunt injectați în creier sau periferic [19, 20]. Probabil, acești compuși vizează zona postrema, NTS și nucleul hipotalamic paraventricular [19, 20]. GLP-1 are un puternic efect de incretină asupra secreției de insulină, prin urmare, exenatida mimetică GLP-1 este utilizată ca agent antidiabetic [19, 20]. Mai mult, exenatida provoacă greață la unii pacienți. Deoarece GLP-1 este rapid inactivat de dipeptidil peptidază (DPP) în circulație, s-au dezvoltat inhibitori DPP-IV pentru a prelungi activitatea GLP-1 [19, 20]. Sitagliptin este utilizat în prezent pentru tratamentul diabetului. Spre deosebire de exenatidă, inhibarea DPP-IV nu afectează în mod substanțial aportul sau greutatea alimentelor. Oxyntomodulin este, de asemenea, derivat din proglucagon și co-secretat cu GLP-1 de către celulele L intestinale după ingestia de nutrienți [19, 20]. Oxyntomodulina induce sațietatea, crește consumul de energie și scade greutatea [20].
Peptida YY (PYY) 3−36 este forma circulantă majoră a PYY [20, 21]. PYY3−36 este co-secretat cu GLP-1 și oxyntomodulin. În studiile timpurii, s-a raportat că PYY3−36 scade aportul de alimente prin inhibarea neuronilor NPY/AGRP din nucleul arcuat hipotalamic prin intermediul receptorilor NPY-Y2 [21, 22]. Cu toate acestea, efectul de sațietate al PYY-36 poate fi minimizat de stres și nu a fost confirmat de alții [23, 24].
Amilina este co-secretată cu insulină din celulele β ale pancreasului și exercită un puternic efect antidiabetic [20]. Pramlintida, un analog al amilinei, îmbunătățește glicemia și, de asemenea, reduce pofta de mâncare și greutatea [20].
Grelina este o peptidă de 28 de aminoacizi sintetizată în principal în stomac [25, 26]. Peptida bioactivă are o grupare laterală octanoyl legată de O pe al treilea reziduu de serină. Această modificare este necesară pentru efectele grelinei asupra hrănirii. Nivelurile de grelină cresc în timpul lipsei de hrană la animale și înainte de mese la oameni și pot servi ca un semnal critic pentru a induce foamea în timpul postului. Administrarea periferică sau directă de grelină în creier stimulează hrănirea [26]. Locul de acțiune al grelinei la hrănire este considerat a fi hipotalamusul, unde receptorul secretagog al hormonului de creștere care mediază acțiunea celulară a grelinei se găsește în nucleele ventromediale și arcuate, în special neuronii care exprimă NPY și AGRP [25, 26]. Grelina induce plasticitate sinaptică în creierul mijlociu, precum și în hipocampus, unde grelina a fost implicată în învățare [27, 28]. Pe lângă stimularea consumului de alimente și promovarea creșterii în greutate, grelina a fost implicată în metabolismul glucozei [29, 30]. Ștergerea grelinei la șoareci a crescut nivelul de insulină bazală, a îmbunătățit secreția de insulină stimulată de glucoză și a îmbunătățit sensibilitatea la insulină periferică [29, 30]. De asemenea, antagoniștii receptorilor secretagogului hormonului de creștere au sporit secreția de insulină la rozătoare [31].
Peptidele derivate din intestin sunt ținte atractive pentru inducerea sațietății și limitarea dimensiunii meselor, dar potențialul de dezvoltare a medicamentelor este plin de dificultăți. Hormonii intestinali au un timp de înjumătățire scurt, prin urmare sunt necesari analogi stabili, cum este cazul exenatidei și inhibitorilor DPP-IV [20]. Hormoni intestinali, de ex. GLP-1 și CCK, pot induce greață și alte efecte secundare gastrointestinale care pot limita utilizarea lor terapeutică. Mai mult, din cauza mecanismelor neuronale și hormonale redundante din intestin, este îndoielnic că vizarea unui număr limitat de peptide este o abordare terapeutică viabilă. Într-adevăr, manipularea genetică a hormonilor intestinali anorexigenici rareori determină modificări evidente în hrănire, greutate și metabolism [29, 30, 32]. Cu toate acestea, modificările hormonilor intestinali pot explica efectele rapide ale operației de by-pass gastric Roux-en-Y pentru a reduce greutatea și a inversa diabetul [33, 34]. GLP-1 este crescut după o intervenție chirurgicală de by-pass gastric și poate inhiba apetitul și crește secreția de insulină [34]. Sunt depuse eforturi pentru a viza grelina pentru tratamentul anorexiei și cașexiei. Antagoniștii de grelină au potențialul pentru obezitate și terapia diabetului.
Interacțiunea leptină-creier
Semnificația neuropeptidelor hipotalamice în homeostazia energetică a fost constatată utilizând metode de ablație genică la șoareci [37-42]. Ablația NPY/AGRP în nucleul arcuit la adulți a provocat foamete rapidă [37, 38]. Ștergerea receptorilor MCH sau MCH-1 a dus la șoareci slabi hiperactivi [39, 40]. Pe de altă parte, lipsa POMC sau a receptorului funcțional melanocortin-4 a cauzat hiperfagie și obezitate [41, 42].
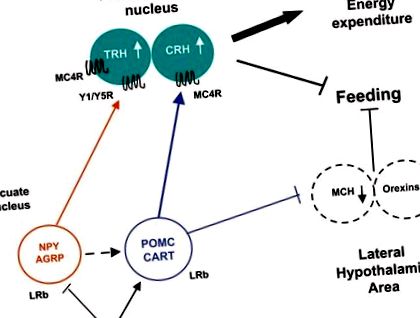
Leptina reglează neuronii hipotalamici arcuați direct prin legarea la LRb, activând semnalizarea JAK-STAT3 și reglând expresia neuropeptidelor (Fig. 1). Scăderea leptinei în timpul postului induce hiperfagie și scade cheltuielile de energie prin creșterea NPY/AGRP și suprimarea α-MSH și CART [35, 36]. Nivelurile reduse de leptină în timpul postului stimulează, de asemenea, MCH și orexine în zona hipotalamică laterală. În schimb, creșterea nivelului de leptină în stare hrănită inhibă consumul de alimente prin suprimarea NPY/AGRP și creșterea peptidelor anorexigenice, de ex. α-MSH și CRH [35]. Similar cu postul, deficiența semnalizării leptinei la șoarecii Lep ob/ob și la șoarecii Lepr db/db provoacă hiperfagie și termogeneza afectată, asociată cu expresia crescută a NPY, AGRP și MCH și expresia redusă a POMC [35].
Transducția semnalului leptinei hipotalamice. Leptina inhibă NPY/AGRP și stimulează POMC/CART, rezultând o creștere a intrării anorexigenice în nucleul paraventricular. Aceste modificări în expresia neuropeptidelor culminează cu sațietatea, stimularea cheltuielilor de energie și pierderea în greutate.
La fel ca și în cazul altor boli complexe, obezitatea este influențată de factori poligenici și de mediu, în special de alimente bogate în energie și de sedentarism. Indivizii obezi sunt de obicei hiperleptinemici, iar eșecul leptinei de a preveni creșterea în greutate a dus la sugestia „rezistenței la leptină” [36]. Obezitatea indusă de dietă la rozătoare se caracterizează prin creșterea nivelului de leptină, reducerea transportului leptinei prin bariera hematoencefalică și afectarea semnalării leptinei în hipotalamus, legată de inducerea SOCS3 [35, 36]. Ștergerea SOCS3 în neuronii receptivi la leptină din nucleul arcuit a îmbunătățit sensibilitatea leptinei și a fost protejată împotriva obezității și diabetului indus de dietă [43, 44].
Leptina exercită efecte rapide asupra neurotransmisiei [45]. Când a fost aplicat pe felii hipotalamice, leptina a crescut frecvența potențialelor de acțiune în neuronii anorexigenici POMC depolarizând un canal cationic nespecific, scăzând tonul inhibitor al acidului γ-aminobutiric (GABA) eliberat de terminalele NPY din nucleul arcuat și hiperpolarizând Neuronii NPY [45]. Foarte important, leptina a scăzut frecvența potențială de acțiune a șoarecilor de tip sălbatic la post și a șoarecilor Lep ob/ob în concordanță cu acțiunea sa anorexigenă puternică [46]. Fenotipul hiperfagic al șoarecilor Lep ob/ob se caracterizează printr-o creștere a raportului dintre sinapsele excitatorii: inhibitoare în hipotalamus [47]. Acest model a fost inversat rapid prin tratamentul cu leptină în decurs de 6 ore, sugerând că plasticitatea sinaptică mediată de leptină a precedat efectul hormonului de suprimare a apetitului [47]. Spre deosebire de leptină, efectul stimulator al grelinei asupra consumului de alimente a fost asociat cu o creștere netă a activității sinaptice în hipotalamus [27]. Aceste rezultate indică faptul că hormonii metabolici periferici pot modifica funcția creierului prin modularea funcției sinaptice [27, 47].
Studii recente au concentrat atenția asupra acțiunilor leptinei în creierul uman [48-50]. Rosenbaum și colab. au demonstrat modificări specifice ale leptinei în activitatea creierului ca răspuns la stimulii vizuali alimentari la pacienții obezi supuși reducerii greutății [48]. Restaurarea nivelurilor de leptină a menținut reducerea greutății, precum și tiparele normalizate de activitate cerebrală [48]. Deficitul congenital de leptină este asociat cu o activitate cerebrală redusă în regiunile legate de foamete și cu creșterea activității cerebrale în regiunile legate de sațietate [49, 50].
Alți factori periferici care controlează hrănirea și metabolismul
Discuție încrucișată între semnalizarea insulinei și a leptinei în hipotalamus. Insulina inhibă NPY/AGRP și induce POMC/CART prin activarea kinazei IRS și PI3. Leptina activează JAK2, care interacționează cu insulina prin IRS.
Sistemul endocannabinoid are efecte semnificative asupra apetitului și metabolismului [57]. Endocannabinoizii se leagă de receptorii canabinoizi de tip 1 și tip 2 (receptori CB1 și CB2). Receptorul CB1, un receptor cuplat cu proteina G, este exprimat pe scară largă în creier și în țesuturile periferice și se crede că mediază acțiunile metabolice ale endocannabinoizilor. Supranutriția activează sistemul endocannaboid, ceea ce duce la hiperfegie, reducerea cheltuielilor de energie și obezitate [57]. Activarea sistemului endocannabinoid poate contribui la dezvoltarea „sindromului metabolic”, caracterizat prin obezitate abdominală, rezistență la insulină, diabet de tip 2 și risc crescut de boli cardiovasculare. Stimularea receptorului CB1 cu anandamidă crește aportul de alimente și greutatea la rozătoare. În schimb, antagoniștii receptorilor CB1 suprimă hrănirea și scad greutatea [57]. Rimonabant, un blocant al receptorilor CB1, inhibă pofta de mâncare și scade greutatea la pacienții obezi [58]. În plus, rimonabantul scade glucoza și lipidele [58].
Excesul de glucocorticoizi crește hrănirea, greutatea și grăsimea [67]. Atunci când sunt administrați în creier, glucocorticoizii au o acțiune permisivă asupra transcrierii NPY în hipotalamus și, de asemenea, modulează nivelurile de monoamine în căile recompensei mezolimbice, pentru a crește consumul de alimente gustabile [67]. În schimb, suprarenalectomia reduce consumul și greutatea alimentelor, chiar și în cea mai severă formă de obezitate rezultată din deficitul de leptină [68]. Steroizii sexuali au efecte profunde asupra poftei de mâncare. Tratamentul cu estrogen periferic a îmbunătățit acțiunile anorexigenice ale leptinei și insulinei la șobolanii femele ovariectomizați, precum și la bărbații intacti [69]. Administrarea estradiolului direct în creierul șobolanilor femele a crescut sensibilitatea la leptina centrală, reducând în același timp sensibilitatea la insulină [69]. Estradiolul a acționat în creier pentru a crește grăsimea subcutanată [69]. Efectele estradiolului asupra apetitului și adipozității apar prin intermediul receptorului de estrogen (ER) -α (70).
Factorul neurotrofic ciliar (CNTF) induce pierderea în greutate. La rozătoare, CNTF inhibă consumul de alimente și crește consumul de energie, în parte prin suprimarea NPY [71]. Cu toate acestea, sațietatea și anti-obezitatea afectează CNTF persistă după încetarea tratamentului [71]. Este posibil ca CNTF să modifice „set-point-ul” echilibrului energetic prin schimbări pe termen lung ale funcției sinaptice [71]. CNTF induce, de asemenea, proliferarea celulară în hipotalamusul șoarecelui, iar mai multe dintre celulele nou formate sunt capabile să răspundă la leptină [72]. Astfel, neurogeneza indusă de CNTF poate afecta comportamentul de hrănire [72]. Citokinele proinflamatorii, cum ar fi factorul de necroză tumorală (TNF) α și interleukina (IL) -6, sunt implicate în patogeneza cașexiei asociate cu cancerul și infecțiile. Aceste citokine inhibă hrănirea și induc termogeneza, parțial prin modularea expresiei neurotransmițătorilor hipotalamici [73, 74].
Mecanisme hedonice care reglează pofta de mâncare și sațietatea
Mâncarea oferă substraturi energetice pentru metabolism, astfel este logic ca comportamentul alimentar să fie supus controalelor homeostatice descrise în secțiunile precedente. Cu toate acestea, apetitul este condus și de factori care depășesc nevoile fiziologice. Mâncarea oferă semnale puternice vizuale, mirosului și gustului, care pot depăși sațietatea și stimula hrănirea. Tindem să mâncăm în exces alimente dulci și sărate și consumăm mai puțin alimente amare sau acre. Gustul și mirosul alimentelor pot modifica profund comportamentul, astfel încât mâncarea plăcută este căutată, în timp ce alimentele neplăcute induc aversiune. O varietate de receptori ai gustului, inclusiv gusturile clasice dulci, sărate, acre, amare, sunt exprimate de celulele gustative în limbă și cavitatea bucală, care transmit informațiile către NTS și nucleul parabrahial din trunchiul cerebral. Senzația de gust este apoi transmisă către talamus și cortexul cerebral frontal lateral, nucleul central al amigdalei și zona hipotalamusului lateral. Neuropeptidele implicate în semnalizarea gustului includ substanța P, colecistokinina (CCK) și opioidele. Leptina este capabilă să moduleze percepția gustului, dovadă fiind un răspuns crescut la gustul dulce la șoarecii lipsiți de leptină [75]. În schimb, tratamentul cu leptină a scăzut semnalizarea gustului dulce la șoarecii Lep ob/ob [75].
Medicamentele psihotrope afectează hrănirea și greutatea [76]. Studiile efectuate pe animale au sugerat că recompensele medicamentoase și alimentare împărtășesc căi neuronale similare. De exemplu, capacitatea AGRP de a crește hrănirea este blocată de naloxonă, un antagonist opioid [77]. Deficitul de encefalină sau β-endorfină reduce motivația pentru comportamentul de presare a barei pentru a facilita recompensa alimentelor [78]. Injectarea antagonistului opioid μ și into în nucleul accumbens a inhibat hrănirea [76]. Agonistul serotoninei (receptorul 5-HT2C) inhibă aportul alimentar parțial prin activarea receptorilor melanocortinei 4 [79]. La șoareci, leptina inhibă motivația de a se hrăni activând neuronii care exprimă dopamină și GABA în calea mezolimbică [80, 81]. O acțiune similară a fost observată la pacienții cu deficit congenital de leptină, prin care activitatea creierului a crescut în striatul ventral și aceasta a fost asociată cu o creștere a dorinței de a mânca chiar și atunci când pacienții tocmai au mâncat [50]. Tratamentul cu leptină a inversat „tiparul hedonic” al activității creierului [50].
Concluzie
Comportamentul alimentar este esențial pentru achiziționarea de substraturi energetice. După cum sa discutat în această revizuire, axa intestin-creier controlează apetitul și sațietatea prin semnale neuronale și hormonale. Intrarea de substanțe nutritive în intestinul subțire stimulează eliberarea de peptide care acționează ca semnale de feedback negativ pentru a reduce dimensiunea mesei și a întrerupe alimentarea. Hormonii și citokinele secretate de organele periferice exercită efecte pe termen lung asupra echilibrului energetic controlând hrănirea și cheltuielile de energie. Neuronii implicați în reglarea homeostatică a hrănirii sunt localizați în principal în hipotalamus și trunchiul cerebral. În plus, circuitele neuronale din sistemul limbic mediază aspectele motivaționale și de recompensă ale hrănirii. Informații despre modul în care semnalele metabolice periferice interacționează cu creierul vor fi obținute din imagistica creierului și studiile metabolice la om și experimentarea preclinică pe modele animale, utilizând instrumente moleculare, genetice, fiziologice și comportamentale. Cunoașterea bazei neurobiologice a alimentației va promova înțelegerea și tratamentul rațional al tulburărilor homeostaziei energetice, cum ar fi obezitatea și cașexia.
Mulțumiri
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- 4 alimente pentru creșterea creierului pentru gândire
- 4 alimente pentru creier pentru copii, părinți
- Alimente dense în calorii pentru un apetit scăzut; Supraviețuitori; Masa
- 5 secrete pentru sațietate și pierderea în greutate - stil de viață întineritor
- 5 lucruri care pot cauza pierderea poftei de mâncare la câini CANIDAE®