1 Clinică de genetică medicală, Spitalul pentru copii Stollery, Edmonton, Alberta, Canada
2 Program în genetică și metabolism, Autoritatea regională de sănătate Winnipeg și Universitatea din Manitoba, Winnipeg, Manitoba, Canada
3 Departamentul de Biochimie și Genetică Medicală, Universitatea din Manitoba, Winnipeg, Manitoba, Canada
4 Departamentul de genetică medicală, Spitalul pentru copii din Montreal, Centrul de sănătate al Universității McGill, Montreal, Quebec, Canada
5 Departamentul de genetică medicală, Universitatea din Alberta, Edmonton, Alberta, Canada
* Autor corespondent: Shailly Jain
Clinica de genetică medicală, clădirea științelor medicale 8-53, spitalul Universității din Alberta
dmonton, AB, Canada T6G 2H7
Tel: 1- (780) 407-7333
E-mail: [e-mail protejat]
Citare: Ghai SJ, Skinner S și colab. Ștergerea genetică contiguă a cromozomului Xp în trei familii care cuprinde gene OTC, RPGR și TSPAN7. J Rare Dis Diagn Ther. 2015, 1: 1. doi: 10.21767/2380-7245.10003
Abstract
Deficitul de ornitină transcarbamilază (OTCD) este cea mai frecventă tulburare a ciclului ureei. Prezentarea clasică la bărbați este encefalopatia hiperamonemică în perioada neonatală timpurie. Având în vedere moștenirea legată de X a OTCD, prezentarea la femei este foarte variabilă. Prezentăm trei familii cu diferite deleții de gene contigue pe cromozomul Xp. Ștergerea RPGR, OTC și TSPAN7 este comună tuturor celor trei familii din seria noastră. Aceste cazuri evidențiază fenotipul variabil în manifestarea purtătorilor de sex feminin OTCD, complexitatea managementului OTCD și problemele complexe legate de opțiunea transplantului hepatic atunci când alți factori genetici joacă un rol.
Cuvinte cheie
Ornitină transcarbamilază; Deficitul de ornitină transcarbamilază; Ștergerea genetică contiguă; OTC, RPGR; TSPAN7
Abrevieri
CGH: Hibridizare genomică comparativă; CRRT: Terapie continuă de înlocuire renală; MLPA: Amplificare sondă dependentă de ligare multiplexă; OTCD: deficit de ornitină transcarbamilază; OTC: Ornitină Transcarbamilază SNP: Polimorfism unic nucleotidic
Introducere
Ciclul ureei funcționează pentru a transforma amoniacul, un produs secundar al descompunerii proteinelor, în uree, care poate fi excretată în siguranță de către organism. Cea mai frecventă tulburare a ciclului ureei, deficitul de ornitină transcarbamilază (OMIM 311250) (OTCD), este o afecțiune legată de X cu o incidență de 1: 14000 [1]. Majoritatea bărbaților cu TOC prezintă encefalopatie hiperamonemică neonatală precoce, care predispune la insulte neurologice și la moarte timpurie. Utilizarea hemodializei renale sau echivalente, a medicamentelor pentru eliminarea amoniacului, a formulei sintetice și a restricției dietetice a proteinelor pot permite supraviețuirea până la vârstă mică, moment în care poate fi luat în considerare transplantul de ficat. Pentru purtătorii heterozigoți de sex feminin, aproximativ 20% prezintă simptome, variind de la encefalopatia hiperamonemică neonatală până la modificările comportamentale la debutul adulților și întârzierile cognitive [2,3].
Combinația de hiperamonemie, glutamină plasmatică crescută și acid orotic urinar crescut, în plus față de o posibilă scădere a citrulinei plasmatice duce la suspiciunea de OTCD. Testul enzimei hepatice poate fi efectuat pentru confirmarea diagnosticului; cu toate acestea este dificil din punct de vedere tehnic. Astfel, confirmarea se realizează cel mai adesea prin analize moleculare; și este considerat standardul de aur al testelor la femei și în cazurile prenatale [4]. Mutațiile sunt detectate doar în aproximativ 80% din toate cazurile OTC [5]. Dintre acestea, peste 80% sunt mutații fără sens sau prostii [6], iar 10-15% se pot datora ștergerilor genetice parțiale sau complete [7]. Cu utilizarea matricei CGH, MLPA și matrice SNP de înaltă densitate, sunt descrise multe ștergeri de gene adiacente care implică gena OTC [4, 8-13].
Descriem trei familii fără legătură cu diferite deleții de gene contigue pe cromozomul Xp. Ștergerea RPGR, OTC și TSPAN7 este comună tuturor acestor familii. Evidențiem impactul ștergerilor de gene multiple care înconjoară locusul OTC asupra fenotipului OTCD final și gestionarea acestuia.
Raport clinic
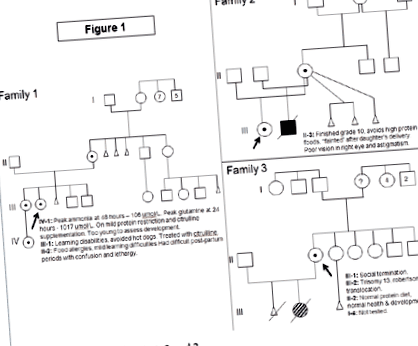
Familia 1 (figura 1)
Cazul index, feminin, a prezentat la vârsta de 12 ani cu delir, emeză, slăbiciune și scădere în greutate. Investigațiile la diagnostic au arătat: amoniac 242 umol/L (normal 5-35 umol/L), glutamină 2000 umol/L (normal: 450-750), citrulină 25 umol/L (1-40), ornitină 103 umol/L ( 50-100), dar acidul orotic nu a fost crescut. Istoricul medical trecut a arătat o întârziere a dezvoltării observată la vârsta de 8-12 luni. A avut o tendință spre vărsături recurente, dureri de cap, letargie și comportament anormal, care s-au îmbunătățit odată cu evitarea cărnii și a produselor lactate. Avea hipoplazie congenitală ușoară a nervului optic. La vârsta de 12 ani, ea funcționa la nivelul unui copil de 3-4 ani. RMN creierul a prezentat atrofie corticală în regiunea frontală stângă. De la diagnostic, tratamentul a constat în restricție dietetică proteică suplimentată cu formulă cyclinex, fenilbutirat de sodiu și L-citrulină. În prezent are 24 de ani, are întârzieri cognitive, îi lipsește funcționarea executivă și nu poate trăi independent. De la diagnostic, cel mai mare amoniac al ei a fost de 406 umol/L, dar glutamina nu a depășit niciodată 2000 umol/L. A avut mai multe internări din cauza encefalopatiei hiperamonemice, dar nu are alte complicații medicale.
figura 1 Pedigree pentru familia 1, 2 și 3.
Sora ei mai mare a avut dificultăți de învățare și a fost „gâfâită” în timpul perioadelor menstruale. Ea a evitat hot dog-urile care au provocat dureri de cap și vărsături, dar au tolerat (alte) alimente bogate în proteine. Investigațiile sale la diagnostic au arătat: amoniac 27 umol/L, glutamină 1100 umol/L, citrulină 6 umol/L, ornitină 125 umol/L. Suplimentarea cu L-citrulină a fost singurul ei tratament. De la diagnostic, amoniacul maxim a fost de 95 umol/L, iar glutamina nu a depășit niciodată 1100 umol/L. Ea a avut recent o sarcină și naștere fără evenimente, cu amoniac de vârf post-partum de 64 umol/L și glutamină de 852 umol/L.
Familia 2 (figura 1)
Cazul index, de sex feminin, a fost prezentat la vârsta de 7 luni, cu arcuire a spatelui și un EEG anormal. La diagnostic, amoniacul era 388 umol/L, ornitină 32 umol/L, citrulină nedetectabilă, glutamină 1112 umol/L cu un acid orotic crescut. Istoricul medical trecut a arătat episoade recurente de vărsături începând cu vârsta de două săptămâni, eșecul de a prospera și întârzierea dezvoltării. RMN creierul a prezentat mielinizare anormală cu microcefalie și atrofie. La vârsta de 10 ani, ea a fost convulsivă, dar are întârzieri semnificative în dezvoltare. De asemenea, are nistagmus, ambliopie, miopie și nervi optici subțiri bilaterali. Tratamentul ei actual constă în restricție proteică suplimentată cu formula Cyclinex, L-citrulină și fenilbutirat de sodiu.
Într-o sarcină ulterioară, mama ei a refuzat diagnosticul prenatal și a născut un băiat. Amoniacul său a crescut constant și a fost de 512 umol/L până în ziua 2 de viață, necesitând CRRT (dializă). Ulterior, el a fost menținut cu o dietă cu restricție de proteine, L-citrulină, fenilbutirat de sodiu și formula Cyclinex. El a dezvoltat eșecul de a prospera la vârsta de 4 luni, deoarece studiile privind creșterea proteinelor alimentare au dus la hiperamonemie. La 12 luni, a prezentat boli hepatice (hipoalbuminemie, edem, ascită și coagulopatie ușoară), hipotiroidism, necesitate recurentă de transfuzie pRBC, eșec de creștere, întârziere în dezvoltare (funcționat la un nivel de 2-3 luni) și erupții cutanate. În acest moment, studiile cu proteine mai mari (1 - 1,2 grame de proteine / kg/zi) au fost tolerate fără apariția hiperamonemiei, dar normalizarea stării proteinelor nu a condus la îmbunătățirea tabloului său clinic general. Nivelurile de amoniac nu au atins un nivel mai mare decât nivelul de la diagnostic. A devenit dependent de ventilație și nu a fost considerat un candidat pentru transplant de ficat. A murit din cauza insuficienței multi-organe la vârsta de 14 luni.
Familia 3 (figura 1)
Cazul index, o femeie de 24 de ani fără probleme de sănătate sau probleme de dezvoltare, a dat naștere unei fete. Acest bebeluș a avut Trisomia 13 din cauza unei translocări robertsoniene. Investigațiile citogenetice ale cazului index și ale partenerului ei au fost normale în ceea ce privește translocația, dar, incidental, a identificat o ștergere a cromozomului X pentru cazul indexului. La diagnostic, amoniacul ei era normal, cu glutamină 487 umol/L, citrulină 19 umol/L și arginină 74 umol/L. Ea nu a restricționat proteinele alimentare și nu a avut probleme de dezvoltare sau cognitive. Studia psihologia la Universitate.
Testarea genetică
Familia 1: Analiza moleculară pentru OTC nu era disponibilă în momentul diagnosticului inițial. Un cariotip pe cazul index a arătat o ștergere estimată de 5Mb a Xp21.1 (46, X, del (X) (p21.1p21.1)) la o rezoluție de 600 de benzi. Pentru a rafina punctele de întrerupere, matricea CGH a fost comandată în 2012. Testarea a identificat o pierdere a numărului de copii heterozigoți de 8,05 Mb pe Xp între nucleotidele 30,376,093-38,432,866 (NCBI36/hg18; CytoChip ISCA 8x60K v2.0), corespunzătoare unei locații citogenetice a Xp11 4-Xp21.2. Acest lucru se corelează cu o pierdere de 25 de gene care codifică proteina RefSeq.
Familia 2: Secvențierea genei OTC în cazul indicelui nu a reușit în mod repetat să amplifice orice produs genetic, sugerând o ștergere brută. O matrice CGH pe fratele cazului index a identificat o pierdere hemizigotă la Xp11.4 cu un interval minim de la nucleotide 38.068.450-38.810.601, corespunzător unei pierderi de 0.742 Mb (GRCh37/hg19, Oligo V8.1.1). Acest lucru se corelează cu o pierdere de 5 gene care codifică proteinele RefSeq.
Familia 3: În urma constatării cariotipului anormal, matricea CGH din cazul index a confirmat o pierdere a numărului de copii heterozigoți de 9,88 Mb între nucleotidele 33.798.269-43.675.842 corespunzătoare unei localizări citogenetice a Xp11.3-Xp21.1 (GRCh37/hg19). Acest lucru se corelează cu o pierdere de 35 de gene de codificare proteică Refseq. (Figura 2,tabelul 1)
Figura 2 Browserul genomului UCSC care descrie suprapunerea dintre microdelecțiile celor trei familii. Familia 1 = Familia solidă 2 = (stea-punct); Familia 3 = (punct solid). Gene șterse obișnuite = casetă
| Coordonatele cariotipului | Xp11.4-Xp21.2 | Xp11.4 | Xp11.3-Xp21.1 |
| Puncte de întrerupere ale ștergerii estimate (hg19) | chrX: 30.466.172-38.547.922 * | chrX: 38,068,450-38,810,601 | chrX: 33.798.269-43.675.842 |
| GK | Deficitul de glicerol kinază (300474) | ||
| DMD | Distrofie musculară Duchenne; Distrofie musculară Becker; cardiomiopatie dilatată (300377) | ||
| XK | Sindromul McLeod, cu sau fără boală granulomatoasă cronică (314850) | ||
| CYBB | Micobacterioză atipică familială/Boală granulomatoasă cronică (300481) | ||
| RPGR | Distrofia con-tijă; Degenerescenta maculara; Retinita pigmentara; Retinită pigmentară, infecții legate de X și sinorespiratorii, cu sau fără surditate (312610) | ||
| OTC | Deficitul de ornitină transcarbamilază (300461) | ||
| TSPAN7 | Întârziere mintală legată de X (300096) | ||
| BCOR | Sindromicmicroftalmie; sindromul oculo-facio-cardio-dentar (300166) | ||
| ATP6AP2 | Retard mintal legat de X, tip Hedera (300423) | ||
| USP9X | Retard mental, X-linked 99 (300919) | ||
| NYX | Orbire nocturnă, staționară congenitală (completă), 1A, legată la X (310500) | ||
| BUTOI | Sindromul FG 4 (300422); Întârziere mintală, cu sau fără nistagmus (300422); Întârziere mintală și microcefalie cu hipoplazie pontină și cerebeloasă (300749) | ||
| MAOA | Sindromul Brunner (300615) |
Tabelul 1: Ștergeri de gene adiacente și gene OMIM pentru cele trei familii.
Discuţie
S-a observat că cromozomul X este un punct fierbinte pentru rearanjarea genomică și este astfel predispus să copieze modificări ale numărului, cum ar fi ștergerile [14]. Explicațiile plauzibile pentru modificările numărului de copii ale regiunii Xp includ recombinarea omologă intramoleculară [15, 16] și/sau alunecarea ADN-ului [16]. Cu tehnologia actuală a CGH și a matricei SNP de înaltă densitate, a devenit posibilă identificarea microdelecțiilor care ar fi putut fi ratate anterior de cariotip și a devenit, de asemenea, mult mai ușor să se identifice gradul de ștergeri, atât mari, cât și mici. Acest lucru ne permite să înțelegem mai bine modificările fenotipice în condiții metabolice, cum ar fi OTCD.
Familiile 1 și 2 au raportat ambele avorturi spontane multiple și acest lucru crește posibilitatea letalității prenatale, probabil la bărbați, din cauza microdeletalizării. Acest lucru subliniază din nou că aberațiile numărului de copii ale acestei regiuni bogate în gene împiedică grav dezvoltarea sistemelor multiple de organe.
În concluzie, prezentăm trei familii cu ștergere contiguă Xp a regiunii care cuprinde OTC, RPGR și TSPAN7 cu mai mulți membri, toate afișând fenotipuri variabile. Cazuri ca acestea evidențiază necesitatea de a elucida pe deplin anomalia moleculară subiacentă, deoarece va altera tratamentul și posibilitatea candidaturii pentru transplant de ficat în OTCD. De asemenea, ne permite să înțelegem mai bine funcția genelor înconjurătoare și posibilele lor interacțiuni.
Conflict de interese
Autorii nu au niciun conflict de interese de dezvăluit
Confirmare
Recunoaștem familiilor și pacienților pentru acordarea acordului și sprijinul lor pentru acest proiect.
- Gene Gag domesticite cu text complet gratuit Gena de Drosophila LTR Retrotranspozonii este implicată în
- COVID-19 și industria funerară. Familiile au opțiuni să ia în considerare Manchester Ink Link
- COVID-19 schimbă funeraliile și modul în care familiile se întristează
- Efectul suplimentării de 8 săptămâni a micronutrienților dietetici asupra expresiei genetice în handbalul de elită
- FEAST Sprijin și resurse pentru familiile afectate de tulburări de alimentație