Antonio Paoli
1 Departamentul de Științe Biomedice, Universitatea din Padova, Via Marzolo 3, 35031 Padova, Italia
Antonino Bianco
2 Unitatea de cercetare a științelor sportului și exercițiului, Universitatea din Palermo, Via Eleonora Duse 2, 90146 Palermo, Italia
Ernesto Damiani
1 Departamentul de Științe Biomedice, Universitatea din Padova, Via Marzolo 3, 35031 Padova, Italia
Gerardo Bosco
1 Departamentul de Științe Biomedice, Universitatea din Padova, Via Marzolo 3, 35031 Padova, Italia
Abstract
Un număr tot mai mare de date demonstrează utilitatea dietelor ketogene într-o varietate de boli metabolice, cum ar fi obezitatea, sindromul metabolic și diabetul. În ceea ce privește tulburările neurologice, dieta ketogenică este recunoscută ca un tratament eficient pentru epilepsia farmacorezistentă, dar datele emergente sugerează că dieta ketogenică ar putea fi utilă și în scleroza laterală amiotrofică, Alzheimer, boala Parkinson și unele mitocondriopatii. Deși aceste boli au patogeneză și caracteristici diferite, există câteva mecanisme comune care ar putea explica efectele dietelor ketogene. Aceste mecanisme sunt de a oferi o sursă eficientă de energie pentru tratamentul anumitor tipuri de boli neurodegenerative caracterizate prin hipometabolism cerebral focal; pentru a reduce daunele oxidative asociate cu diferite tipuri de stres metabolic; creșterea căilor de biogeneză mitocondrială; și să profite de capacitatea cetonelor de a ocoli defectul în activitatea complexului I implicat în unele boli neurologice. Aceste mecanisme vor fi discutate în această revizuire.
1. Introducere
Se știe că nutrienții unici pot exercita efecte pozitive asupra sănătății mușchilor scheletici și, în plus, o combinație de nutrienți poate atenua semnele și simptomele unor boli neuromusculare. Pe de altă parte, se știe, de asemenea, că efectele dietei asupra sănătății sunt legate de raportul general al diferiților macro și micronutrienți, mai degrabă decât de fiecare componentă. Din acest punct de vedere, în ultimii ani a crescut un mare interes asupra dietei ketogene (KD).
Începând cu al treilea deceniu al secolului XX KD a fost utilizat pentru a trata pacienții cu rezistență farmacologică la epilepsie [1-3]. În perioade mai recente, KD a fost, de asemenea, susținută ca fiind utilă în alte boli total diferite, cum ar fi obezitatea [4], SOP [5], cancerul [1, 6, 7], diabetul [8] sau alte afecțiuni patologice [9- 11]. În timp ce multe studii au evidențiat efectele potențial pozitive ale KD asupra multor boli neurologice și neuromusculare, doar câteva cercetări au investigat mecanismele acestei abordări nutriționale promițătoare [12]. Scopul revizuirii noastre este de a discuta rolul KD în anumite boli care afectează sistemul nervos cu implicații asupra funcției musculare.
2. În interiorul dietei ketogene
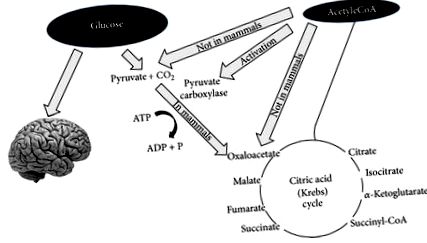
După câteva zile de post sau o reducere drastică a carbohidraților din dietă (sub 20 g pe zi), rezervele de glucoză devin insuficiente atât (1) pentru oxidarea normală a grăsimilor prin aportul de oxaloacetat în ciclul Krebs, cât și (2) pentru furnizarea de glucoză către SNC (sistemul nervos central) [13, 14] (Figura 1).
Glucoza este necesară nu numai pentru a furniza energie sistemului nervos central, ci și pentru a produce piruvat care poate fi transformat în oxaloacetat. Oxaloacetatul trebuie menținut la un nivel suficient pentru a permite funcționarea ciclului acidului citric (adică, condensarea dintre acetil-CoA și oxaloacetat). Oxaloacetatul este instabil și trebuie renovat (acest tip de reacții se numesc anaplerotice). Principala modalitate de a produce oxaloacetat este din piruvat care derivă din glucoză. La mamifere piruvatul nu poate fi produs din acetil-CoA așa cum se arată în figură.
În ceea ce privește punctul (1) oxaloacetat este relativ instabil la temperatura corpului și nu poate fi acumulat în matricea mitocondrială; astfel, în această condiție de „privare de glucoză”, este necesar să se furnizeze oxaloacetat pentru o funcționare eficientă a ciclului acidului tricarboxilic. Oxaloacetatul este furnizat prin intermediul ciclului anaplerotic care îl sintetizează din glucoză prin carboxilarea dependentă de ATP a acidului piruvic de piruvat carboxilaza [15].
În ceea ce privește punctul (2), deoarece SNC nu poate utiliza acizii grași (FFA) ca sursă de energie (FFA nu poate traversa bariera hematoencefalică), utilizează în mod normal glucoza. După 3-4 zile fără aport de carbohidrați, SNC trebuie să găsească surse alternative de energie, așa cum demonstrează experimentele clasice ale lui Felig și colab. [13, 14, 16, 17]. Această sursă alternativă de energie este corpul cetonilor (KB): acetoacetat (AcAc), 3-hidroxibutirat (3HB) și acetonă [18], derivat din supraproducția de acetil-CoA fără o producție concomitentă a unei cantități adecvate de acid oxaloacetic. Acest proces se numește ketogeneză și are loc în principal în matricea mitocondrială din ficat [19]. Este important să subliniem faptul că ficatul produce KB, dar, de asemenea, este incapabil să le utilizeze din cauza absenței enzimei succinil-CoA: 3-CoA transferază (SCOT) necesară pentru a converti acetoacetat în acetoacetil-CoA [18].
O disponibilitate redusă de carbohidrați alimentari duce la o creștere a producției hepatice de KB. Ficatul nu poate utiliza KB-uri deoarece nu are enzima mitocondrială succinil-CoA: 3-cetoacid (oxoacid) CoA transferază (SCOT) necesară activării acetoacetatului în acetoacetil-CoA. KB-urile sunt utilizate de țesuturi, în special de creier. KB-urile intră în ciclul acidului citric după ce au fost transformate în acetil-CoA de succinil-CoA: 3-CoA transferază (SCOT) și metilacetoacetil-CoA tiolază (MAT).
Un alt punct de evidențiat este, așa cum se arată în tabelul 1, că glicemia, chiar dacă redusă, rămâne în nivelurile fiziologice [26, 27], datorită principalelor două surse: (1) aminoacizi glucogeni și (2) glicerol eliberat prin liză din trigliceride [28, 29]. În timpul cetozei fiziologice (KD rapid sau foarte scăzut de calorii) cetonemia atinge niveluri maxime de 7/8 mmol/L fără modificări ale pH-ului, în timp ce în cetoacidoza diabetică necontrolată, aceasta poate depăși 20 mmol/L, cu o scădere concomitentă a pH-ului sanguin [16, 30 ] (Tabelul 1). Nivelurile sanguine de KB la persoanele sănătoase nu depășesc 8 mmol/L, deoarece sistemul nervos central (SNC) folosește eficient aceste molecule ca sursă de energie în locul glucozei [16].
- Dieta ketogenică și implementarea sa terapeutică bazată pe dovezi în bolile endocrine - PubMed
- Cum poate influența o dietă ketogenică Compoziția corpului Blog KetoDiet
- Recenzia lui Ivana (Zagreb, Croația) despre Keto Meal Prep 2018 The Essential Ketogenic Diet Meal Prep
- Scrisoare către editor despre „Compararea eficacității dietei ketogenice clasice și a dietei Atkins modificate
- Cum este dieta ketogenică Recenzii S și S Avocați