Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Departamentul de Biomedicină, Universitatea din Bergen, Bergen, Norvegia
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Cercetarea bolilor cardio-metabolice, Departamentul de biologie moleculară și celulară, Nippon Boehringer - Ingelheim, Kobe, Japonia
RIKEN Center for Molecular Imaging Sciences, Kobe, Japonia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Departamentul de Biologie, Universitatea din Copenhaga, Copenhaga, Danemarca
Departamentul de Biologie, Universitatea din Copenhaga, Copenhaga, Danemarca
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Departamentul de Biomedicină, Universitatea din Bergen, Bergen, Norvegia
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Cercetarea bolilor cardio-metabolice, Departamentul de biologie moleculară și celulară, Nippon Boehringer - Ingelheim, Kobe, Japonia
RIKEN Center for Molecular Imaging Sciences, Kobe, Japonia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Departamentul de Biologie, Universitatea din Copenhaga, Copenhaga, Danemarca
Departamentul de Biologie, Universitatea din Copenhaga, Copenhaga, Danemarca
Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia
Institutul Național pentru Abuzul de Alcool și Alcoolism, NIH, Bethesda, Maryland, SUA
Abstract
Introducere
Endocannabinoizii sunt mediatori endogeni ai lipidelor fabricate din acizi grași esențiali disponibili doar din surse dietetice. Cei mai bine caracterizați doi endocannabinoizi, 2 - AG și AEA, sunt ambii derivați metabolici ai unui singur precursor al acidului gras, acidul arahidonic ω - 6 (AA, 20: 4n - 6) din fosfolipide (AA - PL). Deoarece oamenii nu pot sintetiza AA de novo, concentrațiile de PL tisulare depind de concurența dintre aporturile alimentare de grăsimi ω - 6 și ω - 3 (5)): (i) acid linoleic (LA, 18: 2n - 6, precursorul AA), (ii) AA dietetică preformată, (iii) α - LA (18: 3n - 3, precursorul acidului eicosapentaenoic (EPA, 20: 5n - 3) și acid docosahexaenoic (DHA, 22: 6n - 3) și (iv) endocanabinoizii EPA dietetici preformați sunt format enzimatic la cerere din grupul de precursori ai membranei ω - 6 PL - acid gras ((6)). În timpul secolului al XX-lea, creșterile AA-PL au fost estimate din creșterea dramatică a LA dietetice rezultată dintr-o> 1.000 de ori creșterea consumului estimat pe cap de locuitor de ulei de soia de la 0,006 la 7,38% din energie ((7)) .Aici, am modelat aceste modificări dietetice ecologice la șoareci pentru a determina dacă creșterea LA ca variabilă dietetică controlată ar putea ridica compoziția AA - PL, crește nivelul endocannabinoidului și induce modificări metabolice și fenotipice în concordanță cu obezitatea.
Metode și proceduri
Declarație etică
Experimentul a fost realizat în conformitate cu protocolul (Propunerea de studiu animal nr. LMBB - JH - 01) aprobată de Comitetul de îngrijire și utilizare a animalelor din Institutul Național de Alcool și Alcoolism și a urmat Ghidul Institutelor Naționale de Sănătate pentru Îngrijirea și Utilizarea Laboratorului Animale.
Animale
Șoarecii însărcinați timp de 2 săptămâni (e 14) C57BL/6j; Laboratoarele Charles River, Stone Ridge, NY) au fost repartizați aleatoriu în diete experimentale (tabelul 1). Fiecare așternut (ajustat la șase pui în decurs de 48 de ore de la naștere) a fost menținut pe aceeași dietă cu mama sa respectivă. Animalele au fost întreținute pe un ciclu de lumină - întuneric 12:12 h. Trei până la patru pui de sex masculin din fiecare așternut au fost înțărcați după 23 de zile și au fost adăpostiți câte doi pe cușcă (doi puști din aceeași așternut). Un animal din fiecare cușcă a fost perforat la ureche și folosit pentru analiza datelor. Au fost înregistrate greutăți individuale pentru ambele animale de două ori pe săptămână.
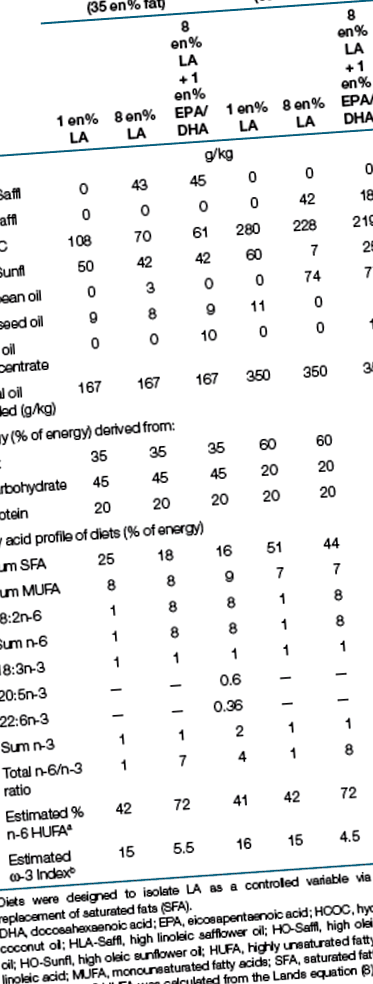 |
Dietele
Au fost disponibile alimente furnizate sub formă de pelete (diete cu conținut mediu de grăsimi) și paste (diete cu conținut ridicat de grăsimi) ad libitum timp de 14 săptămâni. Dyets (Bethlehem, PA) au pregătit toate dietele care conțin aceleași 20 en% proteină (cazeină) și (g/kg): zaharoză 75, celuloză 50, amestec mineral 47, amestec vitaminic 13,5, l-cisteină 3 și bitartrat de colină 2,5, etoxichin 0,06. Sursele de proteine și carbohidrați au fost alese astfel încât să aibă un conținut minim de grăsimi de fond. LA a fost izolată ca o variabilă independentă prin amestecarea a șapte uleiuri diferite pentru a menține cantități echivalente de α-LA și monoinsaturați (tabelul 1). Modificările în LA dietetice au fost compensate exclusiv cu modificări reciproce ale acizilor grași saturați. De exemplu, dietele cu 1 en% LA conțineau cu 7 en% mai multe grăsimi saturate comparativ cu dietele 8 en% LA. Dietele cu conținut mediu de grăsimi (35 en%) și cu conținut ridicat de grăsimi (60 en%) s-au diferențiat doar prin cantități mai mari de grăsimi saturate compensate de sursele de carbohidrați; dextrină, detroză și zaharoză. Aportul de alimente a fost măsurat la fiecare două zile prin cântărirea fiecărei cupe de alimente și deversare și scăderea greutății colectate anterior.
Analiza endocannabinoidelor
Analiza acizilor grași în PL
analiza ARNm și hormonii plasmatici
ARN-ul a fost purificat din ficat și țesuturi adipoase albe (12)) și transcripție inversă în timp real PCR (13)) efectuate pentru nivelurile de ARN mesager (ARNm) ale SREBP-1c, FAS, ACC1, AMPK a2 și AMPK a2. Nivelurile plasmatice ale leptinei, adiponectinei și insulinei au fost determinate folosind imunoanaliza enzimatică (ALPCO Diagnostics, Salem, NH).
Statistici
Toate datele sunt analizate folosind STATISTICA versiunea 8.0 (StatSoft, Tulsa, OK). Datele au fost analizate pentru omogenitatea varianței (testul lui Levene), care a fost nesemnificativ, cu excepția acizilor grași, 2 - AG, insulină și date ARNm care au fost astfel analizate folosind testul Mann - Whitney U -. Testarea multiplă a fost corectată prin ajustarea la P
Rezultate
LA dietetic a crescut țesutul LA-PL, AA-PL, 2-AG + 1-AG și AEA
Dietele de 8 en% LA au crescut semnificativ LA-PL și AA-PL în eritrocite (masa 2), ficatTabelul 3, Figura 1a, b) și hipotalamus (Tabelul 3) comparativ cu dietele 1 en% LA. În consecință, creșterea LA aproape a triplat ficatul 2 - AG + 1 - AG și AEA atât în dietele medii, cât și în cele cu conținut ridicat de grăsimi (Figura 1d, f). EPA a fost de aproape cinci ori mai mare atât în ficat (Figura 1c) și eritrocite (masa 2) în dietele de 1 en% comparativ cu dietele de 8 en% LA. Scăderea LA la 1 en% eritrocit crescut (masa 2) și DHA în ficat (Tabelul 3) la niveluri similare cu adăugarea de EPA și DHA preformate la 1%, pentru majoritatea dietelor.
Creșterea selectivă a LA dietetice crește precursorii AA și endocannabinoizii la șoareci alimentați cu diete cu conținut mediu de grăsimi (bare deschise) și cu diete bogate în grăsimi (bare grosiere). LA dietetic la 1 en% este indicat de bare albe, 8 en% LA de bare gri închis și 8 en% LA + 1 en% EPA/DHA de bare gri deschis. LA dietetic (8%) creșteA) ficat LA în fosfolipide (PL) (µg/mg) șib) ficat PL - AA (µg/mg). Comparativ cu 8 en% LA, dietele de 1 en% LA dietetice permit acumularea endogenă a (c) ficat PL - EPA (µg/mg), niveluri egale cu consumul direct 1 en% EPA/DHA. Creșterea LA dietetică de la 1% la 8% crește (d) ficat 1-AG + 2-AG (ng/mg) (de peste patru ori), (e) creier 1-AG + 2-AG (ng/mg) șif) ficat AEA (ng/ml). Adăugarea de 1% EPA/DHA reduce concentrația de precursori endocannabinoizi și concentrațiile tisulare de 2-AG și AEA. a, b, c, d Litere diferite indică P
LA dietetic a crescut aportul de alimente, greutatea corporală și adipozitatea
Dietele de 8 en% LA au crescut greutatea corporală (Figura 2e și Figurile suplimentare S1 și S2 online) și adipozitateFigura 2f și Figura 3) comparativ cu 1% din LA. Aportul alimentar a fost mai mic în dieta bogată în grăsimi de 1 en% LA, comparativ cu celelalte diete bogate în grăsimi, rezultând un aport caloric al dietei bogate în grăsimi de 1 en% LA similar cu dietele cu conținut mediu de grăsimiFigura 2a). Dietele de 8 en% LA au crescut eficiența hranei față de animalele hrănite 1%% LA (Figura 2b). Dietele cu conținut mediu de grăsimi au avut o eficiență alimentară mai mare comparativ cu dietele cu conținut ridicat de grăsimi (22,0 ± 0,5 mg/kcal și respectiv 18,8 ± 0,5 mg/kcal, P
LA dietetic induce adipozitatea la șoarecii hrăniți cu diete cu grăsimi medii (bare deschise) și cu diete bogate în grăsimi (bare grosiere). LA dietetic crește cu 8 en% (A) consumul de alimente în diete bogate în grăsimi (b) eficiența hranei pentru dietele cu conținut mediu de grăsimi (c) reduce adiponectina plasmatică (µg/ml/g țesut adipos) și creșted) leptina plasmatică (ng/ml). Comparativ cu o dietă de 1 en% LA, crește și 8 en% LA (e) greutatea corporală și (f) indicele adipozității. Adăugarea 1 en% EPA/DHA inversează efectele dietelor 8 en%. Eficiența alimentării; (creșterea în greutate corporală/aportul Mcal), indicele de adipozitate (subcutanat + retroperitoneal + tampoane de grăsime inghinală)/greutatea corporală eviscerată × 100). Nivelurile de adiponectină au fost ajustate pentru țesutul de grăsime gram disecat (tampoane de grăsime subcutanat + inghinal + retroperitoneal). a, b, c, d Litere diferite indică P
Reducerea LA dietetică la 1 en% previne acumularea țesutului adipos și inversează efectele obezogene ale unei diete bogate în grăsimi (60 en%). Animale hrănite 8 en% LA (b,e) a acumulat mai multe grăsimi decât animalele hrănite 1 en% LA (A,d). Adăugarea a 1 en% n - 3 EPA/DHA la 8 en% diete LA (c,f) a prevenit creșterea țesutului adipos observată la animalele hrănite cu 8% energie LA în b,e. Proprietățile obezogene ale unei diete bogate în grăsimi (60% în grăsimi) în e au fost inversate prin reducerea selectivă a LA de la 8% la 1% și înlocuirea cu grăsimi saturate mai mari în d. Animalele prezentate sunt reprezentative pentru animalele din fiecare tratament dietetic. Rândul superior; diete isocalorice cu grăsime medie de 35 en% grăsime, rând inferior; diete izocalorice bogate în grăsimi de 60% în grăsimi. Compoziția acizilor grași, nu caloriile totale ale grăsimilor, a determinat proprietățile obezogene ale dietelor. DHA, acid docosahexaenoic; EPA, acid eicosapentaenoic; LA, acid linoleic.
EPA și DHA dietetice au scăzut țesutul AA-PL, 2-AG + 1-AG, AEA și adipozitatea
Am căutat să determinăm dacă modificările fenotipurilor 2 - AG + 1 - AG și adipozității s-au datorat scăderii LA sau scăderii precursorului endocannabinoid AA - PL ca proporție a grupului de precursori PL (procentul de n - 6 acizi grași foarte nesaturați (HUFA) sau% n - 6 în HUFA). Adăugarea EPA și DHA (1 en%) în dieta LA de 8 en% a inversat creșterea AA - PL (Figura 1b), 2-AG + 1-AG (Figura 1d, e) și ficat AEA (Figura 1f) într-un model similar cu scăderea LA la 1 en%. Adăugarea de 1 en% EPA/DHA la dietele de 8 en% LA a împiedicat creșterea țesutului% n - 6 în HUFA (Tabelele 2 și 3) indusă de dieta de 8 en% LA și a scăzut atât eficiența hranei, cât și adipozitatea (Figura 2b, f). Ficat și creier 2-AG + 1-AG (Figura 1d, e), ficat AEA (Figura 1f) și leptina plasmatică (Figura 2d) nivelurile au avut tendința de a fi mai mici la animalele hrănite cu 8 en% LA + dietă EPA/DHA comparativ cu dietele 8 en% LA. Adăugarea de 1 en% EPA/DHA la dietele de 8 en% LA a crescut foarte mult indicele ω - 3 în eritrocite de la 4,5 la 16 (P
LA dietetic a crescut leptina și a scăzut adiponectina
Animalele hrănite cu diete de 8% LA au prezentat niveluri mai ridicate de leptină (Figura 2d) și niveluri mai mici de adiponectină (Figura 2c) în plasmă comparativ cu animalele hrănite 1 en% LA. Un model similar a fost observat cu adăugarea de 1 en% EPA și DHA la dietele de 8 en% LA. Nivelurile de insulină nu au diferit în funcție de dietă (Tabel suplimentar S1 pe net). Faptul că nivelurile de insulină nu s-au modificat poate sugera că, în ciuda dezvoltării obezității la acești șoareci, aceștia nu au fost hiperinsulinemici și poate nu au atins o stare de dereglare metabolică tipică complicațiilor observate în sindromul metabolic.
LA dietetic nu a crescut expresia genelor lipogene
Diferențele în expresia ARNm au fost mai afectate de cantitatea totală de grăsimi și cantitatea totală de acizi grași polinesaturați (PUFA) din dietă decât diferențele în conținutul de LA și EPA/DHA și nu respectă modelele de adipozitate și endocannabinoid induse de dietă. niveluri (Figurile suplimentare S3 și S4 pe net). După cum era de așteptat, dietele bogate în grăsimi au avut tendința de a suprima expresia ARNm pentru SREBP-1c, FAS, ACC1, AMPKa1 și AMPKa2 în comparație cu dietele cu conținut mediu de grăsimi (Figura suplimentară S3 pe net). În cadrul dietelor bogate în grăsimi, o cantitate mai mare de PUFA totală, ca în dieta bogată în grăsimi 8 en% LA + 1 en% EPA/DHA, a avut tendința de a suprima expresia ficatului și a țesutului adipos alb de SREBP-1c, FAS, ACC1, adiponectină, rezistină și AMPKa1 sau AMPKa2.
Comparație ecologică
Am selectat diete de rozătoare de 1% și 8%% pentru a reflecta creșterea aportului alimentar pentru această grăsime în Statele Unite în secolul XX (7). Am postulat că, dacă LA a indus hiperactivitatea endocannabinoidă în mod similar la om, atunci consumul crescut de ulei de soia s-ar corela cu creșterea ratei de prevalență a obezității în această perioadă de timp (Figura 4). Uleiul de boabe de soia are aproximativ 50% LA din greutate și este cel mai mare contribuitor al creșterii LA în ultimul secol. Consumul estimat pe cap de locuitor de produse alimentare și disponibilitatea acizilor grași esențiali din 273 de produse alimentare a fost calculat așa cum s-a descris anterior ((7)) utilizând datele despre disparițiile economice pentru fiecare an din 1909 până în 1999. Am comparat schimbarea disponibilității alimentare a mărfuri și substanțe nutritive în aprovizionarea cu alimente din SUA a ratelor de prevalență ajustate în funcție de vârstă ale obezității (> 30 IMC) pentru bărbații cu vârsta cuprinsă între 40 și 59 de ani în rândul veteranilor armatei din Uniunea SUA în 1900 15)) și cohorte Framingham ((16)). Disponibilitatea alimentară a LA a fost calculată nu numai din ulei de soia, ci a fost însumată din 273 de produse alimentare. Consum crescut de LA (en%)r 2 = 0,68, P 2 = 0,83, P 2 = 0,94, P 2 = 0,86, P 2 = 0,37, P
Grăsimile esențiale dietetice și metabolismul endocannabinoizilor. Endocannabinoizii 2 - AG și anandamida (AEA) sunt sintetizați la cerere din acidul gras esențial acid arahidonic (AA) (20: 4n - 6) din fosfolipidele de membrană (AA - PL). AA în grupul de precursori fosfolipidici poate fi crescut de acidul linoleic dietetic (LA) (18: 2n - 6) sau de consumul redus de acizi grași omega-3, în special acid eicosapentaenoic (EPA) și acid docosahexaenoic (DHA). Activarea receptorilor canabinoizi (CB1 și CB2) de către endocannabinoizi derivați AA-PL, AEA și 2-AG, atât la nivel central, cât și periferic, favorizează procesele metabolice care stimulează apetitul, cresc aportul de alimente, activează căile de depozitare a grăsimilor, promovează inflamația adipocitelor și reglează în jos catabolism care are ca rezultat acumularea adipoasă. Figura indică schimbarea uleiului de semințe disponibil și modificările compozițiilor tisulare estimate ale n-6 acizi grași foarte nesaturați descriși în Blasbalg și colab. 2010 ((10)). Săgețile orizontale indică ipoteza că aceste schimbări în dietă și nivelurile endocannabinoide rezultate pot contribui la creșterea prevalenței obezității în Statele Unite în secolul XX. 2-AG, 2-arahidonoilglicerol; HUFA, acizi grași foarte nesaturați; NAT, N-acetiltransferază; PLA2, fosfolipază A2; PLC, fosfolipază C.
Surse dietetice de acid linoleic (LA) și creșterea ratei de prevalență a obezității masculine în Statele Unite în secolul XX. Prevalența obezității masculine (40-59 ani, IMC> 30) în fiecare an este indicată de sursa: UA - Uniunea Veteranilor Armatei, cohorte F - Framingham, cohorte N - NHANES. Scattergramele și liniile de regresie liniare univariate sunt indicate în fiecare panou. Rata crescută de prevalență a obezității masculine este corelată pozitiv cu consumul aparent de surse alimentare de LA, indicat în (A) păsări de curte un procent de energie (en%), (r 2 = 0,94, P 2 = 0,82, P 2 = 0,86, P 2 = 0,37, P 2 = 0,27, P 2 = 0,49, P
Discuţie
Comparativ cu dietele de 8 en% LA, suplimentarea dietelor 8 en% LA cu 1 en% EPA/DHA a condus la niveluri mai mici de adipozitate și endocannabinoizi. Dietele pe bază de ulei de pește au redus grăsimile în obezitatea indusă de dietă (25) și suplimentarea cu 0,8 en% EPA/DHA a dus la niveluri mai scăzute de endocannabinoizi și la depunerea redusă a grăsimilor ectopice (17). Puii de la mame hrănite cu ulei de pește aveau greutate corporală mai mică, țesut adipos mai mic și 2 - AG mai scăzut în hipocampus decât puii de la mame hrănite cu ulei vegetal hidrogenat (26). Deși suplimentarea dietelor EPA/DHA la 8 en% LA a împiedicat creșterea AA - PL, EPA/DHA într-o dietă 8 en% LA nu a fost la fel de eficientă ca 1 en% LA în prevenirea producției excesive de endocannabinoizi și nici în restabilirea tulburărilor metabolice. Adăugarea de DHA și AA la o dietă occidentalizată bogată în LA (10,7%) nu a susținut aceeași compoziție de acizi grași din cortexul frontal ca și o dietă săracă în LA (1,2%%) (21). Prin urmare, pentru a îmbunătăți concentrațiile de EPA și DHA ale țesuturilor și pentru a preveni semnalizarea endocannabinoidă excesivă, accentul ar trebui pus pe scăderea LA dietetică în plus față de suplimentarea dietetică cu EPA și DHA.
Confirmare
Studiul a fost susținut de programul de cercetare intramurală al Institutului Național pentru Abuzul de Alcool și Alcoolism, NIH, Institutul Național de Cercetare în Nutriție și Fructe de Mare (NIFES), Bergen, Norvegia și Consiliul de Cercetare din Norvegia 186908/l10. Concentratul de ulei de pește a fost furnizat de Axellus, Norvegia. Finanțatorii nu au avut nici un rol în proiectarea studiului, colectarea și analiza datelor, decizia de publicare sau pregătirea manuscrisului.
Dezvăluire
Autorii nu au declarat niciun conflict de interese.
- Acidul linoleic dietetic crește endogenul 2-AG și anandamida și induce obezitatea
- Acidul linoleic dietetic crește endocanabinoizii 2-AG și anandamida și favorizează creșterea în greutate
- Încărcarea cu acid dietetic și aportul de potasiu se asociază cu prevalența tensiunii arteriale și a hipertensiunii în
- Insuficiența alimentară folică și suplimentarea cu acid folic afectează în mod similar metabolismul și
- Încărcarea acidului alimentar, tensiunea arterială, glicemia în repaus alimentar și biomarkerii rezistenței la insulină
