Abstract
fundal
Deficitul de testosteron la bărbați este asociat clinic cu dezvoltarea sindromului metabolic, care se manifestă ca obezitate, steatoză hepatică și diabet de tip 2. Am investigat efectele deficitului de testosteron indus de castrare asupra adipozității corpului și a expresiei genelor legate de metabolismul lipidic și de absorbția glucozei și de semnalizare a androgenilor la șobolanii masculi hrăniți cu o dietă normală (ND) sau cu o dietă bogată în grăsimi (HFD).
Metode
Modificările metabolismului lipidelor și glucozei și ale semnalizării androgenilor au fost investigate la niveluri fiziologice și moleculare la nivelul mușchilor, ficatului și țesuturilor adipoase ale șobolanilor necastrați și castrați sub hrănire ND sau HFD.
Rezultate
Deficitul de testosteron indus de castrare a predispus animalele pe ND la dezvoltarea timpurie a ficatului gras prin activarea sintezei acizilor grași (FA), în timp ce HFD a activat absorbția FA hepatică CD36 expresie, ducând la dezvoltarea steatozei hepatice. La șobolanii hrăniți cu ND, castrarea a indus acumularea de grăsime musculară prin activare CD36 expresie. În grăsimea subcutanată a șobolanilor hrăniți cu ND, castrarea a crescut adipozitatea și expresia genelor legate de sinteza FA, dar a scăzut expresia genei transportoare de glucoză. În grăsimea abdominală a șobolanilor hrăniți cu ND, castrarea a crescut adipozitatea prin reglarea în sus a genelor legate de sinteza FA, iar HFD a promovat adipozitatea prin inducerea captării FA, a transportorului de glucoză și a expresiei genei legate de sinteza FA. La șobolanii hrăniți cu ND, castrarea a scăzut creșterea corporală și greutatea musculară și a reglementat în jos expresia semnalizării genelor androgeni în mușchiul longissimus dorsi.
Concluzii
Deficitul de testosteron crește adipozitatea într-un mod specific țesutului și dependent de dietă. Deficitul de testosteron scade greutățile corporale și musculare și reglează în jos semnalizarea androgenului.
Introducere
Testosteronul joacă un rol important în metabolismul lipidelor și glucozei [1]. Kelly și colab. [2] a sugerat că testosteronul reduce depunerea grăsimii corporale prin reglarea expresiei genelor legate de metabolismul lipidelor și glucozei. Un nivel scăzut de testosteron sau deficit de testosteron dereglează metabolismul lipidelor și glucozei, rezultând o adipozitate crescută în ficat și țesuturile periferice [2,3,4,5]. Deficitul de testosteron este asociat cu creșterea adipozității viscerale [6]. Un nivel scăzut de testosteron este predictiv pentru dezvoltarea sindromului metabolic, care se manifestă ca obezitate, boli hepatice grase nealcoolice și diabet de tip 2 la bărbați [1, 7] și la animale de laborator [2, 5]. Efectele deficitului de testosteron asupra adipozității și metabolismului lipidelor/glucozei sunt controversate. De exemplu, deficitul de androgeni în combinație cu o dietă bogată în grăsimi (HFD) a exacerbat adipozitatea și rezistența la insulină la șoarecii masculi [5]. În schimb, nivelurile serice de glucoză și insulină la șobolanii masculi nu au fost afectate de deficitul de testosteron și de HFD [8]. Prin urmare, efectele deficitului de testosteron asupra metabolismului lipidelor și glucozei necesită investigații suplimentare.
Depunerea grăsimii corporale este modulată de căile metabolice lipidice care mediază absorbția, sinteza și degradarea acidului gras (FA) [9,10,11]. Transportorul FA CD36 mediază absorbția FA și joacă un rol important în steatoza hepatică [12]. Sunt disponibile informații limitate cu privire la rolul CD36 în depunerea grăsimilor la șobolanii cu deficit de testosteron. Kelly și colab. [2] au raportat diferențe în efectul testosteronului asupra funcției țesutului adipos subcutanat (sc) față de țesutul adipos visceral: șoarecii testicular-feminizați (cu un receptor de androgen nefuncțional [AR] și un nivel scăzut de testosteron) au prezentat reduceri GLUT4 expresie în sc, dar nu țesut adipos visceral. Sunt necesare studii suplimentare privind efectele deficitului de testosteron asupra expresiei genelor legate de metabolismul lipidelor și glucozei în țesuturile periferice (inclusiv ficatul și mușchiul scheletic) și depozitele de grăsime (sc și țesuturile abdominale [ab] adipoase) pentru a înțelege mecanismele prin care adipozitate este reglementată.
Deficitul de testosteron scade creșterea și masa musculară la șoareci orhidectomici și knockout [5] și reduce masa musculară la omul masculin [13]. Aceste descoperiri sugerează importanța testosteronului pentru creșterea corpului și a mușchilor. Semnalizarea testosteronului este mediată de calea de semnalizare AR [14, 15] și, prin urmare, este necesară investigarea efectului deficitului de testosteron asupra semnalizării AR.
Alimentarea cu HFD a rozătoarelor le modifică metabolismul lipidelor și glucozei [16, 17] și este adesea folosit pentru a studia sindromul metabolic, cum ar fi adipozitatea viscerală, hiperlipidemia și rezistența la insulină [18]. Efectul combinației de deficit de testosteron și un HFD trebuie astfel clarificat. Am emis ipoteza că deficitul de testosteron dereglează diferențiat expresia genelor legate de metabolismul lipidelor și de absorbția glucozei într-o manieră specifică țesutului, predispunând la sindromul metabolic. De asemenea, am emis ipoteza că un HFD exacerbează modificările induse de deficitul de testosteron în metabolismul lipidelor și glucozei. Pentru a testa aceste ipoteze, am examinat efectul castrării asupra creșterii, adipozității, masei musculare scheletice, parametrilor sanguini și nivelurile de expresie ale genelor legate de metabolismul lipidelor și absorbția glucozei în ficat, mușchi și depozitele de grăsimi sc și ab la șobolanii masculi. a hrănit o dietă normală (ND) sau un HFD timp de 9 săptămâni.
Materiale și metode
Animale, castrare și diete
Toate procedurile experimentale care implică animale au fost aprobate de Comitetul instituțional de utilizare și îngrijire a animalelor de la Universitatea Națională Chonnam (CNU) (numărul permisului CNU IACUC-YB-R-2010-13). Toate procedurile de gestionare a animalelor au urmat protocoalele standard de operare ale CNU. Șobolanii masculi Sprague - Dawley au fost cumpărați de la Orient Bio (Gyeonggi-Do, Republica Coreea) și au fost menținuți la o temperatură (22 ± 1 ° C) - și umiditate (45-65%) - cameră controlată sub 12/12 h ciclu lumină/întuneric cu acces ad libitum la alimente și apă.
Șobolanii au fost castrați la vârsta de 6 săptămâni, moment în care greutatea lor corporală medie a fost de 213 g. Toate instrumentele chirurgicale au fost pre-sterilizate prin metode acceptabile, inclusiv sterilizarea cu abur. Șobolanii masculi au fost anesteziați prin injecție intramusculară de Zoletil ™ 50 (5 mg/kg greutate corporală, Virbac, Franța) și așezați pe un tampon de încălzire. Scrotul șobolanilor a fost ras și curățat folosind etanol 70%. O mică incizie a liniei medii (1 cm) a fost făcută prin pielea scrotului, iar testiculele au fost localizate, stoarse ușor și îndepărtate. Apoi, vasele deferente, grăsimile și vasele de sânge au fost readuse la poziția inițială în sacul scrotal, iar vasele deferente și vasele de sânge au fost ligate folosind suturi de mătase (Ailee, Seoul, Coreea). Stratul muscular și pielea au fost închise cu suturi, după care șobolanii au fost readuși în cuști și recuperarea lor a fost monitorizată. Șobolanii de control al intervenției chirurgicale simulate au fost supuși unei proceduri identice cu șobolanii castrați, cu excepția lipsei eliminării testiculelor.
După aclimatizare timp de 1 săptămână după castrarea cu hrănire cu ND, șobolanii au fost împărțiți în următoarele patru grupuri (8 pe grup): șobolani martor acționați cu hrană ND sau HFD și șobolani castrați hrăniți cu ND sau HFD. Dieta normală AIN93-G (D10012G) și HFD (D12451) au fost achiziționate de la Research Diets, Inc. (New Brunswick, NJ, SUA); compozițiile lor sunt prezentate în tabelele suport S1-S3. Pe scurt, în HFD versus ND, 45% față de 16% din energie provenea din grăsimi, 35% față de 64% din carbohidrați și, respectiv, 20% față de 20% din proteine. Aportul alimentar al șobolanilor a fost înregistrat zilnic la aceeași oră a zilei, iar greutatea corporală a acestora a fost măsurată săptămânal.
Colectarea sângelui și a țesuturilor
La sfârșitul perioadei de hrănire de 9 săptămâni, șobolanii (cu vârsta de 16 săptămâni) au fost postite 8 ore. Șobolanii au fost anesteziați cu CO2 și probele de sânge au fost colectate prin puncție cardiacă, transferate într-un tub ET fără anticoagulant și depozitate la 4 ° C. Probele de sânge au fost centrifugate la 2000 ×g timp de 20 min la 4 ° C pentru a colecta serul, care a fost păstrat la - 80 ° C până la analiză. După anestezierea cu CO2, șobolanii au fost eutanasiați prin decapitare, iar ficatul, țesuturile adipoase (ab și sc) și țesuturile musculare scheletice (longissimus dorsi, gastrocnemius și soleus) au fost îndepărtate și cântărite imediat. Țesuturile au fost înghețate în azot lichid și depozitate la - 80 ° C pentru determinarea ulterioară a nivelurilor totale de lipide, ARNm și proteine.
Analize serice și tisulare
Parametrii serici au fost analizați după cum sa raportat anterior [19, 20]. Pe scurt, nivelul seric al glucozei a fost analizat folosind reactivi hexokinazici (Green Cross Reference Laboratory, Seoul, Coreea). Nivelul seric al trigliceridelor a fost analizat prin analiza spectrofotometrică enzimatică (Green Cross Reference Laboratory). Nivelurile serice de testosteron și insulină au fost analizate prin test imunosorbent legat de enzime. Nivelul seric al FA-urilor libere a fost analizat prin metoda acil-coenzimă A (CoA) sintază - acil-CoA oxidază. Nivelurile serice ale colesterolului total, lipoproteinelor cu densitate mare (HDL) și lipoproteinei cu densitate mică (LDL) au fost analizate prin teste colorimetrice enzimatice.
Țesuturile musculare au fost disecate și plasate în azot lichid. Lipidele totale au fost extrase din aproximativ 50 mg țesut muscular prin metoda Folch [21].
Histologie
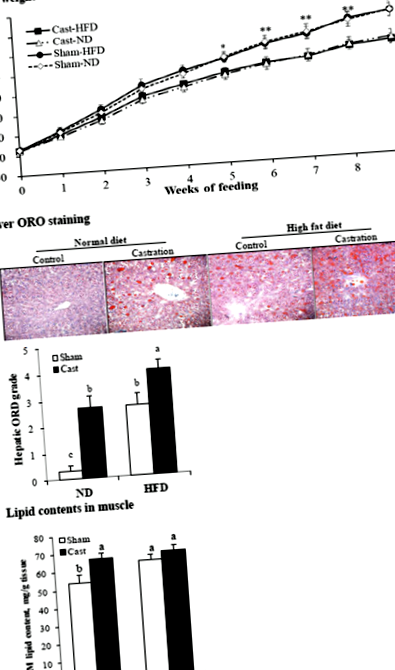
Pentru analiza histologică, ficatul a fost disecat și eliberat de orice grăsime și sânge vizibile. Analiza histologică și colorarea roșu ulei O (ORO) a țesuturilor au fost efectuate așa cum sa raportat anterior [20]. Pe scurt, specimenele de ficat au fost fixate în formalină 10%, echilibrate în zaharoză 20%, încorporate în compusul optim de temperatură de tăiere și tăiate în secțiuni cu grosimea de 7 μm folosind un criostat la - 20 ° C. Pentru a evalua depunerea grăsimii, secțiunile înghețate au fost fixate în 10% formalină, colorate cu 0,5% ORO și examinate la microscop. Gradul de colorare a ficatului ORO a fost determinat și gradat de la 0 la 5 (de la cel mai mic la cel mai mare).
Reacție în lanț în timp real a polimerazei
ARN-ul total a fost izolat folosind reactiv TRIzol (Molecular Research Center, Cincinnati, OH, SUA) conform instrucțiunilor producătorului. ARN-ul total a fost cuantificat prin măsurarea absorbanței la 260 nm, iar integritatea sa a fost evaluată prin electroforeză pe gel de agaroză și colorare cu bromură de etidiu a benzilor de ARN 28S și 18S. Sinteza ADNc și analizele reacției în lanț ale polimerazei în timp real au fost efectuate așa cum s-a descris anterior [19]. Primerii au fost proiectați utilizând Tehnologia ADN-ului integrat (Coralville, IA, SUA) și software-ul Primer 3 bazat pe secvențe în GenBank și au fost sintetizați de Bioneer (Daejeon, Coreea). Informațiile despre grunduri sunt prezentate în tabelul de susținere S4. Metoda 2 −ΔΔCT a fost utilizată pentru a determina modificările relative ale pliurilor în nivelurile de expresie genică normalizate la gena menajului adecvat (gliceraldehidă-3-fosfat dehidrogenază pentru ficat, β-actină pentru mușchi și fosfoproteină ribozomală acidă P0 pentru țesutul adipos).
Western blot
Analize statistice
Datele sunt prezentate ca mijloace ± eroare standard (SE). Datele au fost analizate utilizând procedura modelului liniar general în SAS (SAS Institute Inc., Cary, NC, SUA). Modelul a inclus efectele castrării, dietei (ND sau HFD) și interacțiunii castrării × dietei. Când interacțiunile au fost semnificative, opțiunea PDIFF a LSMEANS în SAS a fost utilizată pentru a efectua comparații individuale ale mediilor. Diferențele au fost considerate semnificative atunci când P valoarea a fost mai mică de 0,05.
Rezultate
Castrarea a scăzut greutatea corporală și musculară, dar a crescut adipozitatea corporală
Șobolanii castrați din grupurile ND și HFD au avut un nivel mai scăzut (P FIG. 1
Castrarea a crescut (P Tabelul 2 Parametrii serici ai șobolanilor mascați (martori) și castrați, hrăniți fie cu dietă normală, fie cu dietă bogată în grăsimi, la starea de post de 8 ore
Castrarea și un HFD modulează expresia genelor legate de metabolismul lipidelor și de absorbția glucozei
Castrarea a modulat expresia genelor legate de metabolismul lipidelor într-o manieră specifică țesutului. Castrare reglată în sus (P FIG. 2
Castrarea nu a afectat Expresia GLUT2 în ficat sau GLUT4 exprimare în mușchi în ambele grupuri de dietă (Fig. 2c). În schimb, castrarea a reglementat în jos (P
Discuţie
Deficitul de testosteron crește adipozitatea corporală și dereglează expresia genelor legate de metabolismul lipidelor și de absorbția glucozei în moduri specifice țesuturilor și dependente de dietă
În acest studiu, am constatat că deficitul de testosteron indus de castrare a crescut adipozitatea în ficat, mușchi și sc și grăsime ab la șobolanii hrăniți cu ND și, de asemenea, a crescut adipozitatea în ficat și sc și ab grăsime, dar nu și în mușchi, în șobolanii hrăneau un HFD. În concordanță cu rezultatele noastre, un nivel scăzut de testosteron sau o deficiență de testosteron crește adipozitatea în ficat și în mai multe țesuturi periferice [2, 3, 5], iar un HFD crește adipozitatea țesutului [4, 5, 18].
Am examinat nivelurile de expresie ale genelor implicate în absorbția și sinteza FA pentru a evalua mecanismele moleculare care stau la baza efectelor deficitului de testosteron și ale tipului de dietă asupra adipozității. Castrarea a crescut expresia CD36 în ficat și sc și ab grăsime în grupul HFD, dar nu în grupul ND și în mușchiul în grupul ND, dar nu în grupul HFD. Activarea CD36 este implicată în steatoza hepatică indusă de dietă [23, 24] și este legată de boala hepatică grasă nealcoolică la om [25]. Cu toate acestea, activarea CD36 expresia în celulele adipoase nu este clară. Descoperirile noastre indică faptul că HFD a indus o suprareglare a CD36 expresia este asociată cu creșterea sc și ab adipozitate pe lângă steatoza hepatică. Castrarea a crescut expresia ACC și FASN în ficat în grupul ND dar în mușchi în grupul HFD. În grăsimea sc și ab, castrarea a crescut expresia ACC și/sau FASN în ambele grupuri de dietă; a crescut FASN expresia în grăsimea sc este în concordanță cu un studiu anterior care a implicat șoareci [5].
Castrarea a modulat, de asemenea, expresia genelor legate de absorbția glucozei. În sc grăsime, castrarea a redus semnificativ expresia GLUT4 în grupurile ND și HFD. În schimb, castrarea nu a afectat expresia genelor legate de absorbția glucozei în ficat sau mușchi din grupul ND sau HFD. În grăsimea ab, castrarea a crescut expresia GLUT4 în grupul HFD, dar nu și în ND. În mod similar, Kelley și colab. [2] a raportat că GLUT4 expresia a fost scăzută în grăsimea sc dar nu în grăsimea ab la femininele testiculare comparativ cu șoarecii normali. În acest studiu, concentrația de glucoză circulantă a fost crescută la șobolanii castrați hrăniți cu ND, dar nu și la cei hrăniți cu HFD. Concentrațiile crescute de glucoză se pot datora efectelor combinate ale scăderii expresiei genei GLUT4 în sc grăsime și scăderii masei musculare observate la animalele castrate.
Rezultatele noastre sugerează, de asemenea, că un nivel scăzut de testosteron este asociat cu un risc crescut de diabet de tip 2, deoarece șobolanii castrați au prezentat o expresie redusă a genelor legate de absorbția glucozei în sc grăsime, precum și o concentrație crescută de glucoză în circulație. După castrare, am constatat creșterea nivelului de colesterol din sânge, care poate fi cauzată de scăderea absorbției colesterolului în ficat și mușchi, ca expresie a LDLr în ficat și mușchi a scăzut prin castrarea șobolanilor.
Deficitul de testosteron scade greutățile corporale și musculare și reglează în jos semnalizarea androgenului
Am constatat că castrarea a scăzut greutatea corpului, longissimus dorsi și gastrocnemius la șobolani. Castrarea a scăzut, de asemenea STAT5a și AR expresie în mușchiul longissimus dorsi și AR expresia a fost scăzută în continuare de HFD. Astfel, deficitul de testosteron indus de castrare dereglează semnalizarea AR și este necesar un nivel normal de testosteron pentru semnalizarea AR. Mai mult, HFD a mărit scăderea masei musculare indusă de castrare și AR expresie. Prin urmare, o alimentație adecvată este importantă pentru menținerea masei musculare în prezența unui nivel scăzut de testosteron, deoarece un nivel scăzut de testosteron poate agrava scăderea masei musculare indusă de HFD. Scăderea masei musculare poate reduce utilizarea glucozei de către mușchi, ducând la hiperglicemie și dereglarea homeostaziei glucozei. Acest lucru poate explica parțial creșterea adipozității ab sub deficit de testosteron în grupurile ND și HFD.
Zirkin și Tenover [27] au raportat că nivelul testosteronului circulant scade de obicei odată cu vârsta. Într-adevăr, tratamentul bărbaților în vârstă cu hormon de creștere și testosteron le-a îmbunătățit masa corporală slabă [28]. Deficitul de testosteron, care poate fi cauzat de hipogonadism, obezitate centrală sau lipsa de androgeni la pacienții cu cancer de prostată, este asociat cu sindroame metabolice, inclusiv rezistența la insulină și diabetul de tip 2 [29]. La animale, un HFD influențează în mod diferit metabolismul corporal și bolile metabolice odată cu vârsta. Hrănirea cu HFD a dus la creșteri mai mari ale greutății corporale și ale nivelului seric al colesterolului și glucozei totale la șoarecii mai în vârstă, comparativ cu șoarecii mai tineri [30]. Studiul nostru sugerează că consumul de HFD de către bărbații vârstnici, care au în general un nivel scăzut de testosteron, poate promova dezvoltarea sindromului metabolic.
În acest studiu, șobolanii au fost castrați la vârsta de 6 săptămâni, când erau imaturi. În consecință, castrarea ar fi putut afecta dezvoltarea generală a animalelor și a contribuit la diferențe fiziologice în raport cu animalele necastrate. La bărbați, nivelul de testosteron scade de obicei la bătrânețe. Prin urmare, poate exista o limitare a implicării directe a descoperirilor noastre la bărbați, deoarece șobolanii au fost castrați la vârste imature.
Un studiu de suplimentare a testosteronului la șobolani castrați ar putea valida modelul de deficit de testosteron prin castrare, deși nu am efectuat experimentul.
Concluzii
- Efectul vârstei și al dietei asupra sintezei proteinelor celulare a ficatului micilor șoareci SpringerLink
- Ce trebuie să știe sportivii despre deficiența de fier care rupe musculatura
- Efectul Guarana (Paullinia cupana) asupra parametrilor metabolici și inflamatori la bărbații adulți
- Tabelul 2 Obezitate cu debut precoce cauzată de tulburări monogene SpringerLink
- Studiul condus de Vanderbilt arată că dieta bogată în sare scade setea, crește foamea VUMC Reporter