Abstract
Obiectiv
Pentru a investiga relația specifică dintre alodinia cutanată (CA) și procentele de grăsime corporală (BF) și grăsime abdominală la migrenoși. În plus, am comparat nivelurile serice ale biomarkerilor inflamatori la pacienții cu și fără CA.
fundal
Excesul de grăsime abdominală ar putea facilita modificările progresive ale pragurilor nociceptive, provocând o sensibilizare centrală, reflectată clinic ca CA, care ar putea determina progresia migrenei.
Metode
Acest studiu prospectiv de cohortă a inclus 80 de pacienți cu migrenă (vârsta medie de 39 de ani, 81,2% femei) și 39 de controale fără migrenă. Am analizat înălțimea fiecărui participant, greutatea corporală și indicele de masă corporală (IMC). Cantitatea și distribuția BF au fost, de asemenea, evaluate prin pletismografie cu deplasare a aerului (ADP) și, respectiv, ViScan. Am analizat nivelurile serice ale markerilor inflamației, în perioadele interictale.
Rezultate
Am studiat 52 de pacienți cu migrenă episodică (EM) și 28 cu migrenă cronică (CM). Dintre cei 80 de pacienți, 53 (53,8%) aveau CA. Migrenoizii cu CA au avut o proporție mai mare de valori ale grăsimii abdominale decât pacienții fără CA (p = 0,04). Factorii de risc independenți pentru CA au fost utilizarea profilaxiei migrenei [OR 3,26, 95% CI [1,14-9,32]; p = 0,03), proporția de grăsime abdominală [OR 1,13, 95% CI [1,01 până la 1,27]; p = 0,04) și prezența tulburărilor de somn (OR 1,13, 95% CI [00,01 până la 1,27]; p = 0,04). Coeficientul de corelație a concordanței dintre măsurătorile ADP și IMC a fost de 0,51 (0,3681 până la 0,6247). CA nu a fost corelată cu nivelurile plasmatice medii ale biomarkerilor inflamatori.
Concluzii
Există o relație între excesul de grăsime abdominală și CA. Obezitatea abdominală ar putea contribui la dezvoltarea sensibilizării centrale la migrenoși, ducând la cronificarea migrenei.
fundal
Migrena poate evolua de la o formă episodică la o cronică la o rată de aproximativ 3% pe an [1], iar obezitatea este unul dintre cei mai relevanți factori de risc modificabili pentru cronificare [2,3,4]. Mecanismele care stau la baza asocierii dintre obezitate și progresia migrenei nu sunt încă complet clare, dar mai multe linii de dovezi sugerează că obezitatea poate facilita modificările progresive ale pragurilor nociceptive, provocând o sensibilizare centrală și ducând la cronificarea migrenei [2, 3, 5].
Excesul de greutate și obezitatea, potrivit Organizației Mondiale a Sănătății (OMS), sunt definite ca acumulare anormală sau excesivă de grăsime care prezintă un risc pentru sănătate. S-a sugerat că cantitatea și distribuția țesutului adipos sunt cruciale pentru înțelegerea asocierii dintre obezitate, definită ca exces de grăsime corporală (BF) și progresia migrenei [6, 7]. Indicele de masă corporală (IMC) este utilizat în mod tradițional pentru estimarea BF, deși această tehnică de măsurare nu este capabilă să facă distincția între grăsimea slabă și masa grasă și nu oferă informații despre distribuția țesutului adipos [8,9,10,11]. Cu toate acestea, poate fi posibil să se evalueze cu precizie BF și distribuția acestuia prin pletismografie cu deplasare a aerului (ADP) și respectiv ViScan [7, 12]. În plus, obezitatea (și în special excesul de grăsime abdominală) este asociată cu o creștere a inflamației sistemice cronice [13] care poate contribui la sensibilizarea centrală [11, 14, 15]. Prin urmare, studierea măsurătorilor compoziției corpului și a mediatorilor inflamatori circulanți la migrenoși poate oferi o mai bună înțelegere a relației dintre obezitate și migrenă [6, 11].
Se consideră că o sensibilizare centrală îmbunătățită indică un risc crescut de cronificare a migrenei [4]. Alodinia cutanată (CA) este considerată un marker clinic al sensibilizării centrale și este considerată ca percepția durerii ca răspuns la stimularea pielii non-nocive [12]. Prezența CA poate fi evaluată cu un chestionar validat simplu, Allodynia Symptom Checklist-12 sau ASC-12 [16]. Mai mulți factori au fost asociați cu un risc crescut de CA la pacienții cu migrenă, inclusiv sexul feminin, valori mari ale IMC, numărul zilelor de migrenă, depresia comorbidă și abuzul de medicamente [4, 12, 16, 17]. Cu toate acestea, nu sunt disponibile informații despre influența BF, în special a creșterii grăsimii abdominale, asupra CA.
Astfel, am emis ipoteza că excesul de grăsime abdominală ar putea juca un rol în cronificarea migrenei prin inducerea sensibilizării centrale, care se reflectă clinic ca CA. Acest studiu a avut ca scop investigarea relației BF și a grăsimii abdominale cu CA la pacienții cu migrenă. În plus, am comparat nivelurile serice ale biomarkerilor inflamatori la pacienții cu și fără CA.
Pacienți și metode
Design de studiu
Acesta a fost un studiu prospectiv de cohortă. Am recrutat o cohortă de indivizi cu migrenă și i-am asortat cu controalele non-migrenă și amândoi au fost examinați pentru diferențele de grăsime legate de prezența sau absența alodiniei și a nivelurilor de biomarkeri inflamatori selectați.
Participanți
Măsurători antropometrice și ale compoziției corpului
Toate măsurătorile antropometrice și ale compoziției corpului au fost obținute în aceeași zi. Înălțimea a fost măsurată la cel mai apropiat 0,1 cm cu un stadiometru Holtain (Holtain Ltd., Crymych, Marea Britanie) și greutatea corporală a fost măsurată la cel mai apropiat 0,1 kg cu un cântar electronic ADP calibrat. IMC-ul fiecărui participant a fost calculat conform recomandărilor OMS [21, 22].
Adipozitatea viscerală și abdominală a fost cuantificată cu un dispozitiv abdominal BIA ViScan (Tanita AB-140, Tanita Corp., Tokyo, Japonia). Acest dispozitiv măsoară adipozitatea abdominală totală (procent de grăsime abdominală [interval: 0 până la 75%]), inclusiv țesutul adipos subcutanat abdominal și intraabdominal exprimat ca „grăsime viscerală” (interval: 1 până la 59 de unități arbitrare [a.u.]). După cum a afirmat producătorul, grăsimea viscerală a.u. obținut prin ViScan înmulțit cu 10 corespund țesutului adipos intraabdominal măsurat prin tomografie computerizată în cm 2 .
Densitatea corpului a fost calculată de ADP (Bod-Pod®, Life Measurements, Concord, California, SUA), pentru a estima masa fără grăsime și masa grasă. Procentul de BF (% BF) a fost calculat din densitatea corpului folosind ecuația Siri. Pe baza celor mai frecvent utilizate criterii din literatura de specialitate [23], punctele limită% BF utilizate pentru a defini persoanele care erau supraponderale au fost: 20,1% la 24,9% pentru bărbați și 30,1% la 34,9% pentru femei; pentru participanții obezi a fost: 25,0% sau mai mult pentru bărbați și 35,0% sau mai mult pentru femei. Adevărata obezitate a fost determinată ca proporție a masei adipoase abdominale, care s-a distins de masa adipoasă periferică și apendiculară ca măsură a adipozității abdominale.
Determinări de sânge
Probele de ser de sânge venos au fost recoltate în eprubete chimice dimineața după un post peste noapte pentru a evita influențele potențiale de confuzie rezultate din ritmicitatea hormonală, centrifugate la 3000 g timp de 15 minute și congelate imediat și depozitate la 80 ° C. Kituri ELISA disponibile comercial au fost utilizate pentru a evalua nivelurile circulante de citokine pro-inflamatorii, inclusiv interleukina (IL-6; RayBiotech, Inc., Norcross, GA), și factorul de necroză tumorală-alfa (TNF-α; R&D Systems, Abingdon, Marea Britanie) conform instrucțiunilor producătorului. Coeficienții de variație intra și inter-test au fost: mai puțin de 10% și 12% pentru IL-6 și, respectiv, 5,4% și 8,3% pentru TNF-α. Toate probele și controalele calibratorului au fost efectuate în duplicat și valorile medii au fost calculate orbite față de datele clinice.
Evaluarea alodiniei cutanate
ASC-12, care include 12 întrebări despre frecvența simptomelor alodiniei în asociere cu atacurile de cefalee, a fost utilizat pentru a evalua CA [16]. Răspunsurile au fost punctate de la 0 la 2, unde: 0 = „niciodată”, „rar” sau „nu se aplică pentru mine”; 1 = „mai puțin de jumătate din timp”; și 2 = „jumătate din timp sau mai mult”. ASC-12 produce scoruri generale cuprinse între 0 și 24 și definește următoarele categorii: fără alodinie (0 până la 2 puncte), alodinie ușoară (3 până la 5 puncte), alodinie moderată (6 până la 8 puncte) și alodinie severă (9 puncte sau mai multe). Analiza de validare anterioară a sugerat că AC are trei factori: termic, static mecanic și dinamic mecanic [16]. Factorul termic, reflectă sensibilitatea la durere la căldură și frig și include cinci elemente (bărbierirea feței, dușul, odihnirea feței sau a capului pe o pernă, expunerea la căldură și expunerea la frig). Factorul static mecanic este compus din cinci articole (purtarea de ochelari, purtarea lentilelor de contact, purtarea cerceilor, purtarea unui colier și îmbrăcămintea strânsă) și reflectă presiunea în punct fix. Factorul dinamic mecanic cuprinde două elemente (pieptănarea părului și tragerea părului înapoi) și reflectă o presiune mai dinamică pe o zonă a pielii [16].
Statistici
Înainte de a începe studiul, am stabilit că, presupunând o proporție migraineur/control de 2: 1, o abatere standard de 7,5 în ambele grupuri, un nivel de semnificație de 0,05 și o putere de 0,90, un eșantion de cel puțin 73 de pacienți în grupul de migrenă și 37 de pacienți din grupul de control ar trebui să detecteze o diferență medie mai mare sau egală cu 5 unități de grăsime abdominală. Pentru a ține cont de potențialul abandon, am inclus 80 de pacienți cu migrenă și 39 de voluntari fără migrenă.
Toate analizele statistice au fost efectuate utilizând software-ul SPSS, versiunea 15.0.1 (SPSS, Chicago, IL, SUA) și p-valori mai mici de 0,05 au fost considerate semnificative statistic. Datele au fost rezumate utilizând numărul de frecvențe și statistici descriptive și prezentate ca medie ± SD. Scorurile ASC au fost evaluate conform indicațiilor de mai sus. Testul Kolmogorov - Smirnov a fost folosit pentru a testa normalitatea distribuțiilor. Mijloacele eșantioanelor independente distribuite în mod normal au fost comparate folosind Student's cu două cozi t-Test. Datele distribuite în mod normal au fost comparate cu testele U Mann-Whitney. Variabilele categorice au fost comparate folosind testul Chi-pătrat și testul exact al lui Fisher, după cum este necesar.
Am comparat corelația și concordanța clasificării% BF cu clasificarea IMC utilizând coeficienții de concordanță ai lui Lin (ρc). Am folosit coeficientul de corelație al lui Lin în locul celui al lui Pearson, deoarece acesta din urmă estimează asocierea liniară generală și nu asocierea specifică liniei de echivalență [24]. Reproductibilitatea ρc a fost considerată aproape perfectă (substanțială) atunci când valorile au depășit 0,99; valori între 0,95 și 0,99 au fost moderate; iar cei sub 0,90 erau săraci [11].
Un model de regresie logistică pentru analiza univariată și modelul de regresie multiplă multivariat pentru analizele multivariate au fost utilizate pentru a testa asocierea dintre CA, ca variabilă dependentă, și diferite variabile de studiu. Variabilele au fost introduse în model prin strategia inversă. Analiza multivariată a inclus factori asociați cu succesul în analiza univariată la p ≤ 0,1. Mai mult, s-a efectuat o analiză suplimentară cu citokinele pro-inflamatorii și o altă substituire a valorilor grăsimii abdominale cu obezitatea și valorile grăsimii corporale. Modelul a fost ajustat în funcție de vârstă, rezultatele MIDAS, rezultatele HIT-6 și anii cu migrenă. Pentru a ne asigura că colinearitatea nu a fost o problemă în analiza de regresie, am folosit factorul de inflație a varianței.
Rezultate
Un total de 119 indivizi caucazieni au fost incluși în analizele noastre: 80 de pacienți cu migrenă (52 cu EM și 28 cu CM) și 39 de controale fără migrenă. Vârsta medie a migrenoșilor a fost de 39 ± 10 ani, iar 81,2% au fost femei (37 ± 8 ani pentru EM și 41 ± 12 ani pentru CM, respectiv 78,8% și 85,7% femei). Vârsta medie a controalelor non-migrene a fost de 41 ± 10 ani, iar 79,5% au fost femei. Nu a existat nicio diferență semnificativă în vârstă, sex, IMC sau compoziție corporală între pacienți și martori (Tabelul 1).
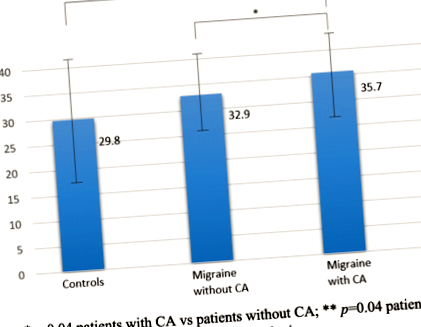
În această cohortă, 43 de pacienți cu migrenă (53,8%) au avut CA în timpul atacurilor de migrenă. Pacienții cu CA au avut grăsime abdominală subcutanată mai mare (35,7 ± 8,7), comparativ cu pacienții fără CA (32,9 ± 7,5, p = 0,04) și controale (29,8 ± 12,2, p = 0,04) (Fig. 1). Cu toate acestea, nu au existat diferențe semnificative în grăsimea abdominală subcutanată între întregul eșantion de pacienți cu migrenă și martori (p = 0,09). Apariția CA la migraineurs a fost, de asemenea, asociată cu vârsta mai mare (p = 0,05), HIT-6 mai mare (62 ± 7 vs. 58 ± 9; p = 0,03) și scorurile MIDAS (54 ± 57 vs. 29 ± 40; p = 0,05), o creștere a consumului de analgezic (11 ± 8 vs. 7 ± 7; p = 0,03), utilizarea profilaxiei migrenei (59,5% vs. 32,4%; p = 0,02) și tulburări de somn (69,8% vs. 43,2%, p = 0,02; Masa 2). Analiza Bod-Pod a indicat o tendință către scoruri% BF mai mari la pacienții cu alodinie. Niciuna dintre variabilele analizate nu a diferit semnificativ în raport cu tipul sau intensitatea CA. Astfel, factorii de risc independenți pentru dezvoltarea CA au fost utilizarea profilaxiei migrenei (OR 3,26, 95% CI] [1,14-9,32]: p = 0,03), grăsime abdominală [OR 1,13, 95% CI [1,01 până la 1,27]: p = 0,04) și tulburări de somn [OR 1,13, 95% CI [0,01 până la 1,27]: p = 0,04).
Grăsimea abdominală la pacienții cu sau fără alodinie cutanată. *p = 0,04 pacienți cu CA versus pacienți fără CA; ** p = 0,04 pacienți cu CA vs martori; CA: Alodinie cutanată
Coeficientul de concordanță între% BF și măsurătorile IMC a fost de 0,51 (0,3681 până la 0,6247) cu un coeficient de corelație Pearson de 0,72 (0,57 până la 0,82; p
Discuţie
Mecanismele care stau la baza asocierii dintre creșterea grăsimii abdominale și CA la pacienții cu migrenă nu sunt încă bine înțelese. O posibilă explicație este că excesul de FB abdominal, care este metabolizat mai activ, poate promova inflamația cronică sistemică de grad scăzut [11]. Astfel, eliberarea diferiților mediatori inflamatori ar putea scădea pragul pentru apariția unui atac de migrenă și ar contribui la sensibilizarea centrală [14, 30,31,32,33]. Am constatat că nivelurile serice din sânge ale doar TNF-α, dar nu și IL-6, au fost semnificativ mai mari la pacienții cu migrenă decât la martori. Aceste descoperiri pot sugera că creșterea BF poate intensifica răspunsul inflamator neurovascular în migrenă, promovând sensibilizarea neuronilor centrali cu un risc crescut de progresie, așa cum sugerează Di Renzo L și colab. [11]. Astfel, pe lângă inflamație, disfuncția în căile orexinei și eliberarea neuropeptidelor asociate cu transmiterea durerii (cum ar fi peptida legată de gena calcitoninei-CGRP-) ar putea fi implicată în dezvoltarea sensibilizării centrale și a progresiei migrenei [34].
De asemenea, am constatat că CA a fost asociată atât cu utilizarea medicamentelor preventive, cât și cu tulburarea somnului, dar nu și cu utilizarea excesivă a medicamentelor. Utilizarea profilaxiei migrenei reflectă probabil faptul că acești pacienți au avut atacuri de migrenă mai frecvente și explică această asociere. Deși creșterea în greutate indusă de medicament este un efect secundar asociat cu unele dintre medicamentele prescrise pentru profilaxia migrenei, în această cohortă, pacienții au fost tratați cu diferite medicamente preventive, inclusiv topiramat care este asociat cu pierderea în greutate. Luate împreună, constatările noastre, în concordanță cu observațiile anterioare [27], nu sugerează că utilizarea profilaxiei migrenei influențează distribuția țesutului adipos. Într-adevăr, datele noastre sunt de acord cu publicațiile anterioare în care frecvența cefaleei [4, 12, 35] și calitatea slabă a somnului [36] au fost ambele asociate cu CA la pacienții care au avut migrene. Utilizarea excesivă a medicamentelor antimigrenă poate induce o sensibilizare centrală [17]. În eșantionul nostru, prezența abuzului de medicamente a fost mai frecventă la pacienții cu CA, dar diferența nu a atins semnificația statistică (Tabelul 2).
CA este, de asemenea, mai frecventă la pacienții cu cefalee cu depresie majoră și la diferite populații de migrenoși, depresia a fost asociată independent cu CA [12, 37,38,39]. În cohorta noastră, depresia a fost mai frecventă la pacienții cu CA, dar diferența nu a atins semnificația statistică.
Descoperirile noastre pot avea implicații clinice. Excesul de grăsime abdominală, chiar și la pacienții cu un IMC normal, este asociat cu un risc mai mare de sensibilizare centrală, susținând recomandarea pierderii de grăsime la astfel de indivizi. Cercetările epidemiologice arată o legătură între obezitate și riscul de migrenă [40] sau progresia migrenei [2, 3, 41]. Diferite studii au demonstrat o scădere a frecvenței migrenei după scăderea în greutate, fie prin modificări dietetice [42, 43], fie prin intervenții chirurgicale bariatrice [44, 45]. Ca atare, pierdere în greutate este, în general, recomandat pacienților cu migrenă obeză și supraponderală [27, 46]. Dacă excesul de grăsime abdominală este principalul motor al progresiei migrenei, sunt necesare studii suplimentare pentru a testa impactul reducerii grăsimii abdominale asupra frecvenței migrenei și a reducerii CA.
Concluzii
În cohorta noastră, am constatat că excesul de grăsime abdominală este asociat cu CA, un marker al sensibilizării centrale la pacienții cu migrenă. Distribuția țesutului adipos pare să influențeze puternic asocierea dintre obezitate și riscul cronificării migrenei. Sunt necesare cercetări suplimentare asupra relației dintre distribuția BF și riscul de progresie a migrenei.
Disponibilitatea datelor și a materialelor
Seturile de date utilizate și/sau analizate în timpul studiului curent sunt disponibile de la autorul relevant la o cerere rezonabilă.
- Căile metabolice de frontiere ale triptofanului sunt alterate în obezitate și sunt asociate cu sistemice
- Frontiere Microparticule derivate din trombocite de la indivizi obezi Caracterizarea numărului, mărimii,
- Gastrită cronică Tulburări abdominale Forums Pacient
- Participarea la biserică asociată cu studiul obezității - Chicago Tribune
- Impactul distinct al adipozității viscerale abdominale asupra simptomelor astmului adult Respirator european