Svenja Heischmann
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Lindsey B. Gano
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Kevin Quinn
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Li-Ping Liang
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Jacek Klepacki
iC42 Cercetare și dezvoltare clinică, † Anschutz Medical Campus, Universitatea din Colorado Denver, Aurora, CO, 80045
Uwe creștini
iC42 Cercetare și dezvoltare clinică, † Anschutz Medical Campus, Universitatea din Colorado Denver, Aurora, CO, 80045
Nichole Reisdorph
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Manisha Patel
Departamentul de Științe Farmaceutice, Școala de Farmacie * Universitatea din Colorado Denver, Aurora, CO, 80045
Date asociate
Abstract
Dietele ketogenice (KD) sunt din ce în ce mai utilizate ca tratamente pentru epilepsie, alte boli neurologice și cancer. În ciuda istoriei lor îndelungate în suprimarea convulsiilor, mecanismele moleculare distincte de acțiune a KD sunt încă în mare parte necunoscute. Scopul acestui studiu a fost de a identifica metaboliții cheie și căile modificate în hipocampus și plasma șobolanilor hrăniți cu o dietă KD versus control (CD) fie ad libitum, fie restricționată caloric la 90% din aportul recomandat. Acest lucru a fost realizat folosind o combinație de metode vizate și analize metabolomice bazate pe MS nedestinate. Diferiți metaboliți ai căii de degradare a triptofanului (TRP), cum ar fi kinurenina (KYN), acidul cinurenic, precum și cofactorii enzimatici, au prezentat modificări semnificative între grupurile hrănite cu diete diferite și/sau cantități de calorii în plasmă și/sau hipocamp. KYN a fost semnificativ reglat în ambele matrice la animale din grupurile cu restricție calorică CD, KD-ad libitum și KD-restricționate caloric, comparativ cu grupul CD-ad libitum. Datele noastre sugerează că calea degradării TRP este o țintă cheie a KD.
Abordările metabolomice, adică evaluarea modificărilor moleculelor mici, pot sugera metaboliți specifici, grupuri de metaboliți și căi care sunt modificate într-un anumit cadru. Un metabolom specific, de exemplu din plasmă, țesut sau urină, poate reflecta modificările induse de boli, tratament sau genetică. Datorită copilăriei câmpului, datele metabolomice trebuie evaluate cu atenție nu numai prin instrumente software, ci și manual, pentru a se asigura că metaboliții cheie și căile metabolice afectate într-un cadru experimental sunt identificate cu acuratețe. Experimentele de urmărire folosind metode direcționate pot ajuta la asigurarea încrederii în identificare, completarea lacunelor și validarea ipotezelor. Din aceste motive, abordări specifice care îi ajută pe anchetatori să obțină o înțelegere mai detaliată a modulației căii sunt, în general, necesare în urma unor studii metabolomice mai puțin specifice. Prin urmare, acest studiu cuprinde o combinație de analize direcționate și nevizate, atât în plasmă, cât și în țesutul hipocampic, pentru a oferi o înțelegere cuprinzătoare a modului în care modificările modelului de molecule mici în plasmă și hipocampus se raportează la o KD.
Plasma reflectă în general schimbări sistemice; cu toate acestea, poate sugera modificări ale metaboliților și ale căilor metabolice în țesuturi specifice, de exemplu, anumite regiuni ale creierului în cazul tulburărilor neurologice/epileptice. Cu toate acestea, compartimentarea trebuie luată în considerare; de exemplu, nu orice compus traversează cu ușurință bariera hematoencefalică. În cazul multor epilepsii, o regiune a creierului cu un interes deosebit este hipocampul, deoarece se știe că aici apar numeroase modificări semnificative legate de boală (12-14). Scopul acestui studiu a fost de a elucida mecanismele prin care KD și restricția calorică își pot exercita efectele anti-convulsive și care modificări sunt induse de aceste regimuri în general. Profilarea metabolomică în plasmă și țesutul hipocampic al șobolanilor hrăniți cu KD sau dietă de control (CD) fie ad libitum (AL) sau restricționată caloric (CR) la 90% din aportul recomandat a sugerat modificări ale căii de degradare TRP/KYN. Modificările nivelurilor de metaboliți ai căii au fost investigate în continuare prin analize specifice; acestea au inclus HPLC-MS/MS și HPLC cuplate cu detecție electrochimică (ECD), dezvăluind modificări subtile ale căilor specifice, în principal în plasmă.
MATERIALE ȘI METODE
Studiu pe animale
Studiile pe animale au fost aprobate și monitorizate de Comitetul de îngrijire și utilizare a animalelor de la Universitatea din Colorado Denver (Aurora, CO) și efectuate în conformitate cu liniile directoare aprobate. Cercetarea a fost concepută pe baza studiilor anterioare efectuate în laboratorul nostru și efectuate așa cum s-a descris anterior [CD-restricționat caloric (CCR), KD-restricționat caloric (KCR)] (12, 13). În plus, grupuri de animale cu acces nerestricționat la alimente au fost studiate pentru a obține informații detaliate despre efectele restricției calorice ușoare versus hrănirea AL a dietelor respective [CD-ad libitum (CAL), KD-ad libitum (KAL)]. Șobolanii Sprague Dawley masculi (P28 la începutul studiului) au fost hrăniți cu KD (# F3666; BioServ, Flemington, NJ) sau cu un CD (# F3517; BioServ) fie AL, fie restricționat caloriic la 90% din necesarul zilnic recomandat pentru o durată de 3 săptămâni (n = 6 per grup). Șobolanii au fost eutanasiați după 3 săptămâni prin decapitare sub anestezie cu CO2 și au fost colectate probe de țesut și plasmă.
pregătirea unei mostre
Analiza metabolomicii HPLC-MS.
O sută de microlitri de omogenat de plasmă sau țesut (1:10 țesut: apă cu 0,1% acetat de amoniu și 0,03% hidroxitoluen butilat) au fost utilizate pe probă pentru analiză, așa cum s-a descris anterior (15). Pe scurt, au fost adăugate standarde interne ca controale de calitate pentru extracția metabolitului, adică creatinină-d3, D-glucoză-13 C6, valină-d8, testosteron-d2, ceramidă C17, FA nesaturată C19: 1, acid heptadecenoic și cis-10 -acid nonadecenoic. S-a folosit o extracție lichid-lichid modificată în două etape a metil-terț-butil eterului pe baza metodei de extracție Bligh-Dyer pentru a extrage metaboliți și lipide apoase din probe de plasmă și țesut.
Test HPLC-MS/MS pentru evaluarea cantitativă țintită a căii de degradare TRP/KYN.
Cincizeci de microlitri de omogenat de plasmă sau țesut au fost diluați 1: 1 cu 0,2% acid acetic conținând standarde interne marcate cu izotopi. S-au adăugat o sută de microlitri de acetonitril, probele au fost agitate timp de 5 minute și centrifugate la 13.000 g timp de 10 minute. Supernatantele au fost diluate 1: 1 cu acid acetic 0,2%. O curbă de calibrare conținând toți analiții în intervalul 1-10.000 ng/ml în soluție salină tamponată cu fosfat a fost pregătită în consecință.
Test HPLC-ECD pentru evaluarea cantitativă țintită a căilor de degradare TRP/KYN.
Hipocampii congelați au fost sonicați în acid percloric 0,1 N rece ca gheața, centrifugați la 13.000 g la 4 ° C timp de 15 minute și supernatanții au fost colectați.
Analiză instrumentală, de date și statistică
Analiza metabolomicii HPLC-MS.
Lipidele au fost separate pe un sistem Agilent 1290 UHPLC folosind o coloană Agilent Zorbax RRHD SB-C18, 1,8 μm, 2,1 × 100 mm coloană cu 60: 36: 4 izopropanol: acetonitril: apă + 0,1% acid formic și apă + 0,1% acid formic ca faze mobile. Metaboliții apoși au fost separați pe un sistem Agilent 1200 HPLC folosind un Phenomenex Kinetex HILIC, 2,6 μm, 2,1 × 50 mm coloană și 90% acetonitril cu pH acetic 5,85 mM acid și 50% acetonitril cu pH 5,85 mM acid acetic ca faze mobile. Masele de referință au fost infuzate folosind o pompă izocratică cu un splitter.
Probele au fost analizate prin HPLC-MS pe instrumentele Agilent TOF (model 6210 TOF, lipide; model 6510 Q-TOF, fracție apoasă) cu sursă de electrospray în modul de ionizare pozitivă și negativă cu următorii parametri: temperatura gazului: 300 ° C; gaz de uscare: 12 litri/min; nebulizator: 30 psig; VCap: 4.000 V; intervalul de masă: m/z 50–1700; spectre: două pe secundă; fragmentor: 120 V.
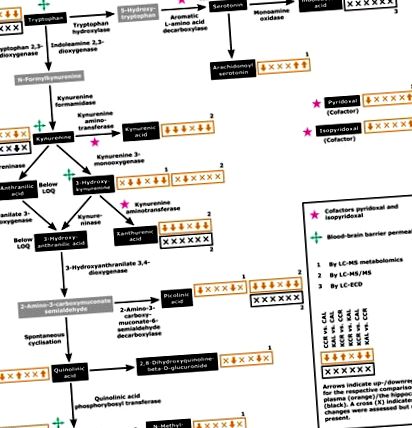
Elemente cheie ale căii KYN și metaboliții asociați. Săgețile din casetele portocalii (plasmă) și negre (hipocampus) arată reglarea metaboliților respectivi pentru cele șase comparații în următoarea ordine: CCR versus CAL, KAL versus CAL, KCR versus CCR, KCR versus KAL, KCR versus CAL și KAL versus CCR. Numerele indică metodele respective de evaluare: 1, analiză metabolomică LC-MS; 2, LC-MS/MS; 3, LC-ECD. Concentrațiile de metaboliți prezentate în cutii gri nu au fost evaluate. Graficele concentrațiilor de metaboliți cu comparație statistică detaliată sunt prezentate în Fig. 2. LOQ, limita de cuantificare.
Modificări ale metaboliților sau (posibil) legați de calea KYN în plasmă (loturi gri) și hipocampi (loturi negre) la șobolani hrăniți în conformitate cu cele patru regimuri dietetice, CAL, CCR, KAL și KCR. Datele sunt prezentate ca medie + eroare standard a mediei (n = 6). A: Modificări evaluate prin analiza metabolomicii HPLC-MS. B: Modificări evaluate prin HPLC-MS/MS. C: Modificări evaluate prin HPLC-ECD. Valorile P pentru comparație cu ANOVA bidirecțională sunt raportate în tabelul suplimentar S3. Pentru comparații între grupuri, s-au utilizat testele post hoc ale lui Tukey (* P Fig. 1), în timp ce reglarea căii KYN nu a diferit între animalele AL din grupurile respective (a patra săgeată/simbol, KCR versus KAL; Fig. 1). În general, modelele de reglare din Fig. 1 prezintă o cale KYN plasmatică în cea mai mare parte reglată sub un KD în comparație cu un CD (a doua și a treia săgeată din fiecare casetă, KAL vs. CAL și KCR vs. CCR; Fig. 1). Compararea animalelor KCR versus CAL și KAL versus CCR arată în principal o reglare ascendentă a căii sub un CD (a cincea săgeată, KCR vs. CAL; Fig. 1) și nici o diferență între regimuri, respectiv (a șasea săgeată, KAL vs. CCR; Fig. 1).
DISCUŢIE
Calea KYN și metaboliții înrudiți
Deși majoritatea metaboliților căii sunt afectați, modificările induse de KD sau CD în calea KYN nu au fost raportate anterior cu o singură excepție: s-a raportat că β-hidroxibutiratul crește sinteza KA in vitro in creștere (felii corticale cerebrale și glial primar culturi) (20). Această constatare este incompatibilă cu rezultatele noastre in vivo care au arătat o reglare descendentă a KA plasmatic sub un regim ketogen. Această discrepanță se poate datora diferențelor în preparate (studii in vitro versus studii in vivo) sau diferitelor regiuni ale creierului examinate.
Un studiu recent a raportat o activitate crescută a indoleaminei 2,3-dioxigenazei (responsabilă pentru conversia TRP în precursorul KYN N-formilchinurenina) la pacienții cu epilepsie generalizată idiopatică (36). S-a raportat că indoleamina 2,3-dioxigenază microglială și 3-monooxigenaza kinureninei au fost induse într-un model de șoarece de epilepsie a lobului temporal (37). Inducerea/activitatea crescută a acestor enzime poate duce la producția sporită de 3-HK și alți metaboliți ai căii în condiții patologice. În timp ce o discuție cu privire la modificările metabolitului observate în studiul nostru față de modificările enzimelor individuale, activitățile acestora și metaboliții asociați pe baza rezultatelor acestor studii pot fi speculative, este plauzibil ca o reglare descendentă a căii, așa cum s-a văzut în studiul nostru, să aibă un efect terapeutic. efecte și pot contracara modificările inducției/activităților enzimatice.
Așa cum s-a menționat mai sus, concentrațiile metabolitului căii KYN (de exemplu, KA și QA) și indicii neuroprotectori din cele patru grupuri dietetice prezintă deseori modele opuse așa cum ne-am aștepta pentru efortul neuroprotecției. Un motiv pentru care interpretarea datelor este dificilă este că relația dintre căile KYN periferice și centrale este complexă (40). Concentrațiile plasmatice evaluate în studiul nostru pot să nu reflecte concentrațiile hipocampice ale metaboliților, așa cum se observă pentru unii dintre metaboliții măsurați în plasmă, precum și hipocampus, adică TRP, XA, acid picolinic și nicotinamidă (Fig. 2). Cu toate acestea, modificările căii KYN sunt adesea descrise în sânge sau în alte biofluide (comparativ cu creierul), iar rapoartele pot servi la prezicerea și indicarea modificărilor căii în țesuturile de interes, așa cum se vede în studiul nostru. Un alt motiv pentru discrepanța rezultatelor măsurate față de rezultatele așteptate în ceea ce privește terapia cu epilepsie ar putea fi că calea KYN nu este ținta principală a dietelor examinate.
Reducerea concentrațiilor de metaboliți ai căii KYN în plasmă de către KD, așa cum se arată în Fig. 1 este în concordanță cu o reglare descendentă a căii, împreună cu restricția calorică, deoarece ambele scheme dietetice au prezentat răspunsuri similare în ceea ce privește efectele neuroprotecției și anti-convulsive (1). Deși metaboliții, cum ar fi KA, care sunt considerați neuroprotectori, au fost, de asemenea, reglementați în jos, beneficiile terapeutice ale unei reglări generale a căii KYN de către KD și/sau restricție calorică pot depăși dezavantajele concentrațiilor scăzute de potențiali neuroprotectori. În general, este necesar să reținem că datele noastre au fost generate la animale sănătoase/neepileptice; o restricție calorică și/sau calorică poate prezenta efecte diferite atunci când acționează asupra unui creier patologic/epileptic.
În general, nivelurile plasmatice ale metaboliților căii KYN au fost influențate de KD și/sau restricție calorică ușoară, în timp ce nivelurile de metaboliți din hipocampus păreau neafectate (cu excepția KYN). Aceste rezultate au fost în concordanță cu restul datelor noastre despre metabolomică (Heischmann și colab., Observații nepublicate), care au confirmat că mai mulți metaboliți s-au schimbat în plasmă decât în hipocampus și că modificările nivelurilor de metaboliți în hipocampus s-au produs într-un interval mic (în principal AL dietă de control CAL ad-libitum dietă de control CCR dietă de control CD restricționată caloric CR restricționată caloric ECD detecție electrochimică 3-HK 3-hidroxinurenină KA acid kinurenic KAL dietă ketogenică-ad libitum KCR dietă ketogenică-restricționată caloric Dieta ketogenică KYN kurenurenină QA acid chinolinic TRP triptofan XA acid xanturenic
- Enteropatia care pierde proteinele ca o complicație a dietei ketogene - PubMed
- Prurigo Pigmentos după o dietă ketogenică strictă - Michaels - 2015 - Dermatologie pediatrică - Wiley
- Dieta ketogenică simplă pentru începători Ghid ușor de sfaturi Keto
- Dieta Slim Mints previne creșterea energiei; Metabolism îmbunătățit! de către cumpărători Recenzii Medium
- MTOR, metabolism și reglarea diferențierii și funcției celulelor T - Waickman - 2012 -