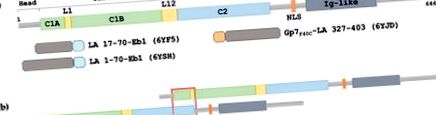
(a) Reprezentarea schematică a structurii primare a laminului A. C1A, bobina1A; L1, linker 1; C1B, bobina1B; L12, linker 2; C2, bobină2; NLS, semnal de localizare nucleară; Domeniu asemănător Ig, imunoglobulină. Fragmentele himerice utilizate aici pentru studii cristalografice sunt prezentate mai jos. Motivele de acoperire Eb1 și Gp7F40C sunt colorate cyan și respectiv grâu. (b) Schema ansamblului laminat longitudinal care se bazează pe interacțiunea ACN.
(a) Structura cristalină a Gp7F40C-LA 327-403. Regiunea LA 327-403 și capacul Gp7F40C sunt colorate în albastru deschis, respectiv grâu. Atomii de sulf utilizați pentru determinarea structurii sunt de culoare portocalie (cisteină) și galben (metionină). Ionul atomului greu legat suplimentar (Ni) este colorat în albastru intens. (b) Suprapunerea structurii Gp7F40C-LA 327-403 cu reziduurile 327–386 din structura LA 305-387 (cod PDB 1X8Y, violet) în două vederi perpendiculare. Bâlbâiala (reziduurile 327-330) este indicată de săgeți roșii.
(a) Structura cristalină a LA 17-70-Eb1. Reziduurile de cap, bobina 1A și primele trei reziduuri ale linkerului L1 sunt colorate în gri, verde pal și respectiv galben. Capacul Eb1 este de culoare cyan pal. Două molecule de apă implicate în punțile de legătură H la vârful α-elicoidal sunt prezentate sub formă de sfere roșii. Lanțurile laterale de reziduuri în pozițiile „a” (negru colorat) și „d” (măslin colorat) începând cu Leu35, adică reziduurile care formează miezul hidrofob al CC sunt prezentate ca niște bețe. (b) Vedere de sus a capătului N-terminal al dimerului cu o blocare β antiparalelă stabilizată de două legături H (linii punctate cyan) între reziduurile Ile26. Se arată legătura H dintre oxigenul din lanțul lateral al Thr27 și azotul din lanțul principal al Gln30 (linie galbenă punctată). (c) Măriți strâmbătura α-elicoidală prezentă în lanțul A. Sunt prezentate modelul regulat de legare a hidrogenului din lanțul principal, precum și două punți de legare H pe bază de apă (linii punctate galbene). Poziția unghiulară suboptimală a legăturii H dintre oxigenul din lanțul principal al reziduului Lys32 și azotul reziduului Gln36 este prezentat ca o linie punctată purpurie.
Structura cristalină a dimerului LA 1-70-Eb1 cu bobina1A în verde, regiunea L1 în galben și capacul Eb1 în cian. În plus, un mate de simetrie de cristal este prezentat în negru (partea laminată) și gri (capac Eb1). Zona mărită ilustrează interacțiunile responsabile de suprapunerea antiparalelă a părților N-terminale. Lanțurile laterale care formează miezul hidrofob comun (auriu colorat), precum și reziduurile Glu37 și Arg41 care formează punți sărate (colorate în gri deschis) sunt prezentate.
Analiza deschiderii dimerului bobinei 1A în diferite structuri (codurile PDB sunt prezentate între paranteze). (a) Suprapunerea segmentelor bobinei 1A observate în LA 17-70-Eb1 (verde), LA 1-70-Eb1 (auriu) și fragment de vimentină 102-138 cu mutație Y117L (roz; cod PDB 3G1E [30]). Reziduurile din pozițiile „a” și „d” care formează nucleul hidrofob sunt prezentate ca niște bețe. (b) Raza CC reprezentată grafic în funcție de numărul reziduurilor (conform secvenței LA) pentru regiunile bobinei 1A din cele trei structuri, determinate folosind TWISTER [58].
(a) Analiza SEC-MALS a complexului LA 17-70-Eb1/Gp7F40C-LA 327-403 (raport 1: 1), LA 22-70-Eb1 și complex Gp7F40C-LA 327-403 (raport 1: 1), constructia Gp7F40C-LA 327-403 si constructia LA 17-70-Eb1. Complexul LA 17-70-Eb1/Gp7F40C-LA 327-403 și ambele construcții individuale au fost rulate în tampon NaCl 150 mM, 10 mM Hepes (pH 7,5). Al doilea complex a fost rulat în NaCl 150 mM, tampon TEA 10 mM (pH 7). Liniile continue arată profilurile indexului de refracție normalizat. Liniile punctate arată valorile greutății moleculare bazate pe MALS pe vârfuri. (b) SDS-PAGE a fracțiilor cromatografice corespunzătoare vârfului principal al complexului LA 17-70-Eb1/Gp7F40C-LA 327-403 din (a). Săgețile albastre și verzi indică Gp7F40C-LA 327-403 și respectiv LA 17-70-Eb1.
Reducerea analizei SDS-PAGE a LA 22-70-Eb1, Gp7F40C-LA 327-403 și a complexului purificat de SEC al acestor două fragmente fără reticulare (fără XL) și după reticulare cu DSG, DSBU și EDC. Cea mai probabilă stoichiometrie a benzilor diferite este dată în partea dreaptă a fiecărui gel, unde literele N și C indică fragmentele N- și respectiv C-terminale. Masele teoretice ale tuturor benzilor sunt date în panoul lateral.
Modelarea tetramerului ACN. (a) Model molecular final al tetramerului ACN. Gp7F40C-LA 327-403 este grâu colorat (Gp7F40C) și albastru (LA 327-403). LA 17-70-Eb1 este colorat verde/galben (LA 17-70) și cyan (Eb1). (b) Modelul molecular final al tetramerului ACN cu toate cele 31 de legături încrucișate care erau compatibile cu modelul. Legăturile transversale intermediare sunt colorate în verde. Legăturile încrucișate cu tetramer sunt etichetate și colorate în roșu (DSBU, DSPU și DSG) și magenta (EDC). (c) Vedere rotită a modelului cu reziduurile de miez hidrofobe prezentate ca bețișoare (pozițiile „a” și „d” în negru și, respectiv, măslin).
Abstract
(a) Reprezentarea schematică a structurii primare a laminului A. C1A, bobina1A; L1, linker 1; C1B, bobina1B; L12, linker 2; C2, bobină2; NLS, semnal de localizare nucleară; Domeniu asemănător Ig, imunoglobulină. Fragmentele himerice utilizate aici pentru studii cristalografice sunt prezentate mai jos. Motivele de acoperire Eb1 și Gp7F40C sunt colorate cyan și, respectiv, grâu. (b) Schema ansamblului laminat longitudinal care se bazează pe interacțiunea ACN.
(a) Structura cristalină a Gp7F40C-LA 327-403. Regiunea LA 327-403 și capacul Gp7F40C sunt colorate în albastru deschis, respectiv grâu. Atomii de sulf utilizați pentru determinarea structurii sunt de culoare portocalie (cisteină) și galben (metionină). Ionul atomului greu legat suplimentar (Ni) este colorat în albastru intens. (b) Suprapunerea structurii Gp7F40C-LA 327-403 cu reziduurile 327–386 din structura LA 305-387 (cod PDB 1X8Y, violet) în două vederi perpendiculare. Bâlbâiala (reziduurile 327-330) este indicată de săgeți roșii.
(a) Structura cristalină a LA 17-70-Eb1. Reziduurile de cap, bobina 1A și primele trei reziduuri ale linkerului L1 sunt colorate în gri, verde pal și respectiv galben. Capacul Eb1 este de culoare cyan pal. Două molecule de apă implicate în punțile de legătură H la vârful α-elicoidal sunt prezentate sub formă de sfere roșii. Lanțurile laterale de reziduuri în pozițiile „a” (negru colorat) și „d” (măslin colorat) începând cu Leu35, adică reziduurile care formează miezul hidrofob al CC sunt prezentate ca niște bețe. (b) Vedere de sus a capătului N-terminal al dimerului cu o blocare β antiparalelă stabilizată de două legături H (linii punctate cyan) între reziduurile Ile26. Se arată legătura H dintre oxigenul din lanțul lateral al Thr27 și azotul din lanțul principal al Gln30 (linie galbenă punctată). (c) Măriți strâmbul α-elicoidal prezent în lanțul A. Sunt prezentate modelul regulat de legare a hidrogenului din lanțul principal, precum și două punți de legare H pe bază de apă (linii punctate galbene). Poziția unghiulară suboptimală a legăturii H dintre oxigenul din lanțul principal al reziduului Lys32 și azotul reziduului Gln36 este prezentat ca o linie punctată purpurie.
Structura cristalină a dimerului LA 1-70-Eb1 cu bobina1A în verde, regiunea L1 în galben și capacul Eb1 în cian. În plus, o pereche de simetrie cristalină este prezentată în negru (partea laminată) și gri (capac Eb1). Zona mărită ilustrează interacțiunile responsabile de suprapunerea antiparalelă a părților N-terminale. Lanțurile laterale care formează miezul hidrofob comun (auriu colorat), precum și reziduurile Glu37 și Arg41 care formează punți de sare (colorate în gri deschis) sunt prezentate.
Analiza deschiderii dimerului bobinei 1A în diferite structuri (codurile PDB sunt prezentate între paranteze). (a) Suprapunerea segmentelor bobinei 1A văzute în LA 17-70-Eb1 (verde), LA 1-70-Eb1 (auriu) și fragment de vimentină 102-138 cu mutație Y117L (roz; cod PDB 3G1E [30]). Reziduurile din pozițiile „a” și „d” care formează nucleul hidrofob sunt prezentate ca niște bețe. (b) Raza CC reprezentată grafic în funcție de numărul reziduurilor (conform secvenței LA) pentru regiunile bobinei 1A din cele trei structuri, determinate folosind TWISTER [58].
(a) Analiza SEC-MALS a complexului LA 17-70-Eb1/Gp7F40C-LA 327-403 (raport 1: 1), LA 22-70-Eb1 și complex Gp7F40C-LA 327-403 (raport 1: 1), constructia Gp7F40C-LA 327-403 si constructia LA 17-70-Eb1. Complexul LA 17-70-Eb1/Gp7F40C-LA 327-403 și ambele construcții individuale au fost rulate în tampon NaCl 150 mM, 10 mM Hepes (pH 7,5). Al doilea complex a fost rulat în NaCl 150 mM, tampon TEA 10 mM (pH 7). Liniile continue arată profilurile indexului de refracție normalizat. Liniile punctate arată valorile greutății moleculare bazate pe MALS pe vârfuri. (b) SDS-PAGE a fracțiilor cromatografice corespunzătoare vârfului principal al complexului LA 17-70-Eb1/Gp7F40C-LA 327-403 din (a). Săgețile albastre și verzi indică respectiv Gp7F40C-LA 327-403 și LA 17-70-Eb1.
Reducerea analizei SDS-PAGE a LA 22-70-Eb1, Gp7F40C-LA 327-403 și a complexului purificat de SEC al acestor două fragmente fără reticulare (fără XL) și după reticulare cu DSG, DSBU și EDC. Cea mai probabilă stoichiometrie a benzilor diferite este dată în partea dreaptă a fiecărui gel, unde literele N și C indică fragmentele N- și respectiv C-terminale. Masele teoretice ale tuturor benzilor sunt date în panoul lateral.
Modelarea tetramerului ACN. (a) Model molecular final al tetramerului ACN. Gp7F40C-LA 327-403 este grâu colorat (Gp7F40C) și albastru (LA 327-403). LA 17-70-Eb1 este colorat verde/galben (LA 17-70) și cyan (Eb1). (b) Modelul molecular final al tetramerului ACN cu toate cele 31 de legături încrucișate care erau compatibile cu modelul. Legăturile transversale intermediare sunt colorate în verde. Legăturile încrucișate cu tetramer sunt etichetate și colorate în roșu (DSBU, DSPU și DSG) și magenta (EDC). (c) Vedere rotită a modelului cu reziduurile de miez hidrofobe prezentate ca bețișoare (pozițiile „a” și „d” în negru și, respectiv, măslin).
- Celule Interactom gratuit pentru gazdă full-text-HIV-1 O căutare pentru o nouă intervenție terapeutică HTML
- Profilarea ARN-urilor mici, fără codificare, cu text complet, identifică miR-181a-5p ca mediator al
- Text complet, gratuit, diversitate O ansamblu de genom întreg, bazat pe mai multe referințe, pentru obligat
- Dezvoltarea gratuită a textului complet al pădurilor de stejar și muguri de carpen european după subțierea HTML
- Influența textului complet al alimentelor, gratuit, a incluziunii castanului (Castanea sativa Miller) în