Scott A. Fields
o Imunologie și Boli Infecțioase, Divizia Biosciences, SRI International, Menlo Park, California, SUA
Gaurav Bhatia
b Tehnologii farmaceutice și chimice, Divizia Biosciences, SRI International, Menlo Park, California, SUA
Julie M. Fong
o Imunologie și Boli Infecțioase, Divizia Biosciences, SRI International, Menlo Park, California, SUA
Mingtao Liu
b Tehnologii farmaceutice și chimice, Divizia Biosciences, SRI International, Menlo Park, California, SUA
Gita N. Shankar
b Tehnologii farmaceutice și chimice, Divizia Biosciences, SRI International, Menlo Park, California, SUA
Abstract
INTRODUCERE
Microbicidele vaginale topice împotriva virusurilor precum HIV și HSV-2 au fost evaluate în studii clinice, cu rezultate mixte. Candidații precum nonoxinol-9, sulfatul de celuloză și C31G nu numai că nu au reușit să protejeze împotriva HIV sau HSV-2, ci au dus, de fapt, la un risc crescut de a dobândi viruși (16, –19). În schimb, gelul microbicid tenofovir a condus la o protecție de 31% împotriva HIV și a arătat în mod surprinzător 51% de protecție împotriva HSV-2 (20). Acesta a fost un beneficiu neașteptat, având în vedere că tenofovirul nu a demonstrat nicio protecție în testele pe bază de celule, dar sugerează că, in vivo, tenofovirul ar putea fi un tratament antiviral dual. Aciclovirul este urmărit în prezent ca candidat la microbicid vaginal (21), dar poate fi necesar să fie utilizat împreună cu tenofovir pentru a fi eficient atât împotriva HIV cât și împotriva HSV-2. Mai recent, un studiu clinic de fază III cu gel de tenofovir singur, în care gelul urma să fie administrat 12 ore înainte de sex și 12 ore după sex, nu a arătat niciun beneficiu față de placebo în protejarea femeilor de HIV (http: // www. conrad.org/news-pressreleases-107.html). Acest lucru pare a fi din cauza lipsei de aderare la protocolul de studiu al unei aplicații de două ori pe zi.
Dezvoltăm o formulare de gel microbicid vaginal multiviral (HSV-2 și HIV) folosind un sistem bicomponent. Un component este 10% aciclovir (greutate/greutate) suspendat într-o soluție de 2% (greutate/greutate) de Pluronic F-127 (un polimer termoreponsiv), iar cel de-al doilea component este tenofovir 2% (greutate/greutate) suspendat într-un 2 Soluție% (greutate/greutate) de Noveon AA-1 (un policarbofil care răspunde la pH). Noutatea acestei formulări (denumită aici SR-2P) este că cele două componente pot fi amestecate împreună înainte de a fi administrate în cavitatea vaginală. Odată ce microbicidul se află în vagin, mediul cu pH scăzut, împreună cu creșterea temperaturii furnizate de corp determină amestecul să formeze un gel aderent care se lipeste de epiteliul vaginal (22, –24). Când sunt legate de mucoasa vaginală, medicamentele sunt eliberate încet în țesuturile în care virusurile se reproduc.
Am demonstrat anterior că formularea antivirală SR-2P placebo este bine tolerată într-un model de iritație vaginală la șoarece (24) și că atât aciclovirul, cât și tenofovirul au fost eliberate în țesuturile vaginale la niveluri terapeutice până la 24 de ore după tratament (G. Bhatia, SA Fields, JM Fong, M. Liu și GN Shankar, trimise spre publicare). În plus, am demonstrat în studii preliminare eficacitatea SR-2P împotriva infecției cu HSV-2 la șoareci, unde 30% dintre șoareci pretratați cu SR-2P la 1 oră înainte de infecție au prezentat supraviețuire împotriva unei provocări letale a virusului (24) . Aici vom arăta că dozele profilactice repetate sau unice de SR-2P oferă protecție marginală împotriva HSV-2, în timp ce un regim de o doză pe zi timp de 10 zile postinfecție combinat cu doza profilactică oferă o protecție aproape completă împotriva virusului la șoareci.
MATERIALE ȘI METODE
Linii celulare și viruși.
Pregătirea SR-2P.
Poloxamer 407 NF și aciclovir au fost cumpărate de la Spectrum Chemicals Manufacturing Company (Gardena, CA), tenofovirul a fost achiziționat de la Hangzhou Starshine Pharmaceutical (Shanghai, China), iar policarbofilul USP a primit cadou de la Lubrizol (Wickliffe, OH, SUA). SR-2P conținând 5% aciclovir și 1% tenofovir, cu și fără conservanți, a fost preparat așa cum s-a descris anterior (24). Pe scurt, compușii au fost preparați în soluții apoase conținând poloxamer 407 NF (1,0% [greutate/greutate]) și policarbofil USP (1,0% [greutate/greutate]). Tenofovirul a fost inclus la 2% (greutate/greutate) în componenta poloxamer 407 NF, iar aciclovirul a fost inclus la 10% (greutate/greutate) în componenta policarbofilă USP. Componentele individuale au fost alimentate în două seringi separate de 10 ml, seringile au fost conectate și cele două componente au fost amestecate prin împingerea și retragerea seringilor până când amestecul a fost omogen. SR-2P combinat a fost depozitat într-o singură seringă la 4 ° C timp de până la 5 zile înainte de utilizare.
Animale.
Toate experimentele pe animale au fost revizuite și aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor (IACUC) la SRI International și au fost efectuate în conformitate cu liniile directoare și reglementările relevante într-o unitate acreditată de Asociația pentru evaluarea și acreditarea laboratorului de îngrijire a animalelor (AAALAC ).
Determinarea ID50 a HSV-2 la șoareci.
Șoarecii femele BALB/c au fost achiziționați de la Harlan Laboratories (Livermore, CA) și au fost adăpostiți în cuști de microizolatori cu așternut din așchii din lemn de esență tare; Purina rozătoare chow 5002 și apa purificată cu osmoză inversă au fost furnizate ad libitum. Toți șoarecii (cu vârsta cuprinsă între 7 și 9 săptămâni) au fost sincronizați hormonal cu o doză subcutanată de 3 mg acetat de medroxiprogesteron în ziua −8. Șoarecii au fost randomizați în grupuri de tratament formate din 10 șoareci per grup pe studiu și au fost dozați intravaginal folosind un vârf de pipetă p200 cu 30 μl de virus curat sau cu o diluție 1: 5, o diluție 1:25 sau o diluție 1: 125 de virus. Șoarecii au fost evaluați pentru modificări ale greutății corporale și observații clinice (roșeață și umflare a organelor genitale, descărcare de gestiune, blană ciufulită, postură încovoiată sau pierderea funcționalității membrelor). Șoarecii care au pierdut mai mult de 20% din greutatea corporală inițială sau au prezentat simptome clinice extreme au fost eutanasiați uman și au fost considerați sacrificii moribunde în ziua următoare. O diluție 1: 5 a virusului nostru stoc (6,75 × 10 4 PFU total) a dus la letalitate completă (datele nu sunt prezentate) și a fost utilizată pentru toate studiile descrise mai jos.
Testarea eficacității SR-2P la șoareci.
TABELUL 1
Detalii despre proiectarea studiului și grupurile de tratament pentru experimentele de eficacitate SR-2P a
| Studiu numai profilactic | |||||
| 1 | Fără gel/neinfectat | NT | NT | NT | NT |
| 2 | Placebo | Ziua 0 (1 oră înainte de infecție) | Ziua 0 | NT | NT |
| 3 | SR-2P | Ziua 0 (1 oră înainte de infecție) | Ziua 0 | NT | NT |
| 4 | SR2-P | Ziua -1 (24 de ore înainte de infecție) | Ziua 0 | NT | NT |
| 5 | SR-2P | Ziua -2, ziua -1, ziua 0 (1 oră înainte de infecție) | Ziua 0 | NT | NT |
| Studiu profilactic/post-expunere | |||||
| 6 | Fără gel/neinfectat | NT | Ziua 0 | NT | NT |
| 7 | Fără gel/infectat | NT | Ziua 0 | NT | NT |
| 8 | Placebo | Ziua -2, ziua -1, ziua 0 (1 oră înainte de infecție) | Ziua 0 | Ziua 1 | Ziua 2 până în ziua 10, o dată pe zi |
| 9 | SR-2P | Ziua -2, ziua -1, ziua 0 (1 oră înainte de infecție) | Ziua 0 | Ziua 1 | Ziua 2 până în ziua 10, o dată pe zi |
| 10 | Placebo | Ziua 0 (1 oră înainte de infecție) | Ziua 0 | Ziua 1 | Ziua 2 până în ziua 10, o dată pe zi |
| 11 | SR-2P | Ziua 0 (1 oră înainte de infecție) | Ziua 0 | Ziua 1 | Ziua 2 până în ziua 10, o dată pe zi |
Studiile profilactice/post-expunere au inclus șoareci netratați și neinfectați (grupa 6) sau șoareci infectați, dar netratați (grupa 7). În plus, două grupuri au constat din șoareci cărora li s-a administrat tratament profilactic în ziua -2, ziua -1 și 1 oră înainte de infecție, urmate de 10 zile de tratament după infecția cu placebo sau SR-2P (grupurile 8 și respectiv 9). Ultimele două grupuri au fost șoarecii tratați cu o oră înainte de infecție și o dată pe zi, postinfecție timp de 10 zile cu placebo sau SR-2P (grupurile 10 și respectiv 11).
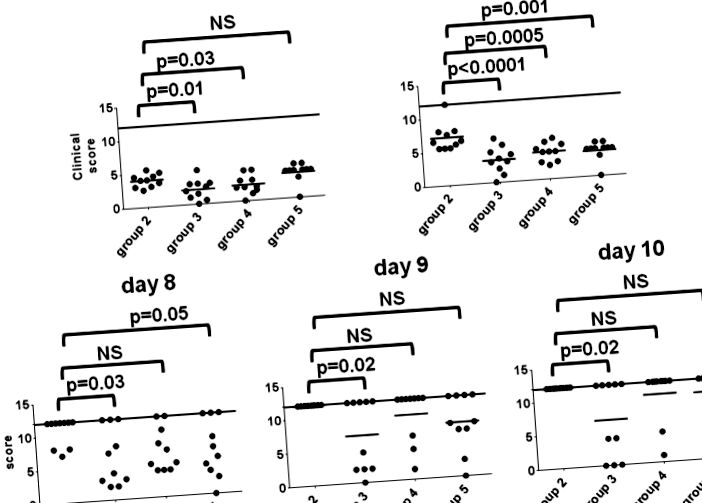
Șoarecii au fost evaluați zilnic pentru modificări ale greutății corporale și observații clinice (roșeață și umflare a organelor genitale, descărcare de gestiune, blană ciufulită, postură încovoiată sau pierderea funcționalității membrelor). Roșeața și umflarea au fost notate pe o scară de la 0 la 4, unde 0 nu a indicat simptome și 4 au indicat simptome severe. Prezența descărcării, blana zburlită, postura încovoiată și pierderea funcționalității membrelor nu au permis gradarea și au primit un scor de 1 fiecare. Șoarecii care au pierdut mai mult de 20% din greutatea corporală inițială sau au prezentat simptome clinice extreme au fost eutanasiați uman, au fost considerați sacrificii moribondi, au fost înregistrați morți a doua zi și au atribuit un scor de observație clinică de 12 pentru ziua respectivă. Graficele de supraviețuire, graficele procentuale ale modificării greutății corporale și graficele scorului clinic total au fost generate utilizând software-ul GraphPad Pro 4.
Colecție de tampon vaginal pentru analiza titrului viral.
Șoarecii utilizați exclusiv pentru brațele profilactice ale acestui studiu nu au fost tamponate pentru titruri virale, deoarece ne-a îngrijorat eliminarea oricărui compus activ din doza unică de SR-2P. Cu toate acestea, 4 șoareci aleși aleatoriu din fiecare grup au fost tamponați pentru analiza titrului viral în grupurile de tratament profilactic/terapeutic. Pe scurt, tampoane de bumbac sterile (Puritan Medical, Guilford, ME) au fost scufundate în PBS steril, introduse aproximativ 0,8 cm în cavitatea vaginală și mișcate într-o mișcare circulară pentru a tampona mucoasa vaginală. Vârful tamponului a fost plasat în 200 μl de 1 × MEM steril, vortexat și congelat la -80 ° C până când a fost utilizat într-un test de placă care a fost efectuat așa cum a fost descris mai sus.
analize statistice.
Valorile P au fost calculate utilizând analiza unică a varianței obișnuită (ANOVA), scor de comparație multiplă pentru fiecare dintre grupurile de tratament față de controalele placebo. Valorile P de ≤0,05 au fost considerate semnificative.
REZULTATE
Eficacitatea tratamentului profilactic SR-2P împotriva infecției HSV-2 intravaginale la șoareci.
Scoruri de observație clinică pentru studiul profilactic la șoareci. Șoarecii au fost tratați cu 20 μl de placebo sau SR-2P înainte de infecție cu 6,75 × 104 PFU total de HSV-2. Grupurile de șoareci sunt după cum urmează: grupa 2, controale placebo; grupul 3, șoareci pretractați SR-2P care au fost infectați 1 oră după administrarea medicamentului; grupul 4, șoareci care au fost pretratați timp de 24 de ore înainte de infecție; grupul 5, șoareci care au fost pretratați în ziua -2, ziua -1 și 1 oră înainte de infecție în ziua 0. Șoarecii au fost observați zilnic pentru simptome clinice, incluzând roșeață și umflături (fiecare a fost evaluat pe o scară de 0, fără simptome la 4 pentru simptome extreme), secreție vaginală, blană zburlită, postură încovoiată și pierderea funcționalității membrelor posterioare (fiecare a primit un scor de 1 dacă este prezent). Șoarecii care fie au fost găsiți morți, fie au fost sacrificii moribunde au primit un scor de 12 (linie continuă). Valorile P reprezintă scoruri de comparație multiple ANOVA unidirecționale obișnuite pentru fiecare dintre grupurile de tratament față de controalele placebo. Valorile P de ≤0,05 sunt considerate semnificative. NS, nu semnificativ.
Modificări ale greutății corporale pentru studiul profilactic la șoareci. Grupurile de șoareci au fost controale placebo care au primit tratament cu 1 oră înainte de infecția cu HSV-2 (grupa 2), au fost pretratate cu SR-2P timp de 1 oră înainte de infecție (grupul 3), au fost pretratate cu SR-2P timp de 24 de ore înainte de infecție (grupul 4) sau au fost pretratate în ziua -2, ziua -1 și 1 oră înainte de infecție în ziua 0 (grupa 5). Greutățile corporale au fost urmărite timp de 21 de zile la șoareci care au supraviețuit până la sfârșitul studiului.
Curba de supraviețuire pentru studiul profilactic la șoareci. Șoarecii au fost fie neinfectați (grupul 1), controalele placebo au fost tratați cu 1 oră înainte de infecția cu HSV-2 (grupa 2), pretratate cu SR-2P timp de 1 oră înainte de infecție (grupul 3), pretratate cu SR-2P timp de 24 de ore înainte de infecție (grupul 4) sau pretratat în ziua -2, ziua -1 și 1 oră înainte de infecție în ziua 0 (grupa 5). Valorile P au fost calculate folosind testul log rank (Mantel-Cox).
Eficacitatea terapiei profilactice/post-expunere SR-2P împotriva infecției HSV-2 intravaginale la șoareci.
Modificări ale greutății corporale pentru studiul terapeutic profilactic/post-expunere la șoareci. Grupurile de șoareci sunt după cum urmează: grupa 7, controale infectate, dar netratate; grupul 8, șoareci care au primit placebo în ziua -2, ziua -1 și 1 oră înainte de infecție în ziua 0; grupul 9, șoareci care au primit SR-2P în ziua -2, ziua -1 și 1 oră înainte de infecție în ziua 0; grupul 10, șoareci care au primit placebo cu 1 oră înainte de infecție în ziua 0; grupul 11, șoareci care au primit SR-2P cu 1 oră înainte de infecție în ziua 0. Grupurile 8-11 au continuat să primească placebo sau SR-2P timp de 10 zile după infecție.
DISCUŢIE
Aciclovirul, o componentă a SR-2P, este un inhibitor nucleozidic analog al HSV-2, care funcționează numai în interiorul celulelor infectate, deoarece se bazează pe o kinază virală pentru ao converti în forma activă trifosfat. Odată activat, acesta se încorporează în ADN-ul viral alungitor în timpul replicării și pune capăt alungirii lanțului, blocând eficient răspândirea virusului (26). Acest lucru face ca SR-2P să fie un candidat ideal pentru un microbicid vaginal și are avantajul suplimentar de a conține, de asemenea, tenofovir, un puternic inhibitor al transcriptazei inverse HIV. Studiile viitoare vor include o examinare a eficacității SR-2P împotriva HSV-2 în modelul de cobai mai relevant clinic și testarea eficacității împotriva HIV în modelul de șoarece al sistemului imunitar umanizat.
MULȚUMIRI
Cercetările raportate în această publicație au fost susținute de Institutul Național de Alergii și Boli Infecțioase al Institutelor Naționale de Sănătate sub numerele de atribuire R21AI098658 și R33.
Conținutul acestei publicații nu reflectă neapărat opiniile sau politicile Departamentului de Sănătate și Servicii Umane și nici menționarea denumirilor comerciale, a produselor comerciale sau a organizațiilor nu implică aprobarea de către S.U.A. Guvern.
Nu avem conflicte de interese de declarat.
- Cremă de protecție solară SPF 30 SMART SLIMMING
- Oferă cea mai bună băutură subțire Plexus Efecte secundare Pierdere în greutate Professional - ARK JOURNAL
- Farmacie online - Probiotice Eva BioLact intermediare în ovule vaginale
- Analiza de simulare OSA și pregătirea unui filtru de protecție laser cu densitate optică mare
- Rezultatul nașterii vaginale după operația cezariană în timpul celui de-al doilea ordin de naștere din Vest