Abstract
fundal
O proteină este o macromoleculă formată de obicei din douăzeci de aminoacizi (AA) diferiți legați prin legături peptidice. Selenoproteinele conțin selenocisteină ca un AA rar, dar nu există selenocisteină liberă în celulele animale. Proteinele sunt o componentă majoră a țesuturilor animale (de exemplu, mușchiul scheletic, glandele mamare, ficatul și intestinul subțire) și produsele (de exemplu, carne, lapte, ou și lână). De exemplu, conținutul de proteine din mușchiul scheletic al bovinelor sau porcinelor în creștere este de aproximativ 70% pe bază de substanță uscată [1]. Astfel, aportul adecvat de proteine alimentare este esențial pentru creșterea maximă, performanța producției și eficiența hranei pentru animale, păsări și pești. După ce au fost consumate într-o masă de către animale, proteinele din ingredientele furajere (de exemplu, făină de sânge, făină de carne și oase, pudră de intestine-mucoasă, făină de pește, făină de soia, făină de arahide și făină de bumbac) sunt hidrolizate în peptide mici - și tri-peptide) și AA libere de către proteaze și oligopeptidaze în intestinul subțire [2]; cu toate acestea, tipurile de peptide rezultate pot varia foarte mult în funcție de condițiile fiziologice ale animalelor și de compoziția dietelor lor. Pentru fabricarea consecventă a peptidelor din proteine din surse animale și vegetale, au fost utilizate metode chimice robuste, enzimatice sau microbiene înainte de hrănire pentru a îmbunătăți calitatea nutrițională a acestora și pentru a reduce factorii anti-nutriționali asociați. Ultimele două metode pot îmbunătăți, de asemenea, solubilitatea, vâscozitatea, emulsificarea și gelificarea peptidelor.
În producția animală, proteinele de înaltă calitate nu sunt hidrolizate ca aditivi furajeri. Numai subprodusele animale, subprodusele fabricii de bere și ingredientele vegetale care conțin factori anti-nutriționali sunt hidrolizate pentru a produce peptide pentru hrana animalelor. Proteazele izolate din diverse surse (inclusiv bacterii, plante și drojdie) sunt utilizate pentru metoda enzimatică, în timp ce microorganismele intacte sunt utilizate pentru cultură în abordarea microbiană. Până în prezent, hidrolizatele de proteine au fost aplicate în domenii atât de diverse precum medicina, nutriția (inclusiv nutriția animalelor) și biotehnologia [5]. Obiectivele majore ale acestui articol sunt de a evidenția tehnicile bazate pe enzime și fermentație pentru prepararea industrială a hidrolizaților de proteine și pentru a discuta despre semnificația nutrițională și funcțională a peptidelor lor bioactive în hrana animalelor.
Definiții ale aminoacizilor, peptidelor și proteinelor
Aminoacizii sunt substanțe organice care conțin atât grupe amino, cât și acizi. Toate AA proteinogenice au o grupă α-amino și, cu excepția glicinei, apar ca izomeri L la animale și furaje. O peptidă este definită ca o moleculă organică formată din două sau mai multe reziduuri AA legate prin legături peptidice [2]. Formarea unei legături peptidice are ca rezultat îndepărtarea unei molecule de apă. În majoritatea peptidelor, legăturile tipice peptidice sunt formate din grupările α-amino și α-carboxil ale AA adiacente. Peptidele pot fi clasificate în funcție de numărul de reziduuri AA. O oligopeptidă este alcătuită din 2 până la 20 de resturi AA. Acei oligopeptide care conțin ≤ 10 reziduuri AA sunt numite oligopeptide mici (sau peptide mici), în timp ce acele oligopeptide care conțin 10-20 reziduuri AA sunt numite oligopeptide mari (sau peptide mari). O peptidă, care conține ≥ 21 reziduuri AA și nu are o structură tridimensională, este denumită polipeptidă [6]. O proteină constă din una sau mai multe polipeptide cu greutate moleculară mare.
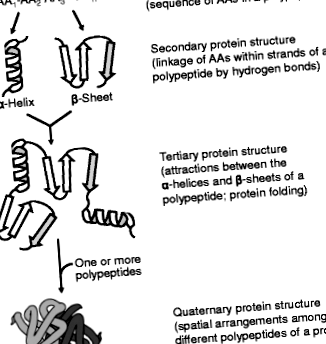
Cele patru ordine ale structurilor proteice. O proteină are (1): o structură primară (secvența AA-urilor de-a lungul lanțului polipeptidic;) (2) o structură secundară (conformația coloanei vertebrale a polipeptidei); (3) o structură terțiară (dispunerea tridimensională a proteinei) și (4) o structură cuaternară (dispunerea spațială a subunităților polipeptidice). Secvența primară de AA într-o proteină determină structurile sale secundare, terțiare și cuaternare, precum și funcțiile sale biologice
Acidul tricloracetic (TCA; concentrația finală de 5%) sau acidul percloric (PCA; concentrația finală de 0,2 mol/L) pot precipita pe deplin proteine, dar nu peptide, din țesuturile animale, celule, plasmă și alte fluide fiziologice, rumen, fluide alantoice, amniotice, lumen intestinale și digestive) [9, 10]. Etanolul (concentrația finală de 80%) poate precipita în mod eficient atât proteine, cât și acizi nucleici din soluții apoase [11]. Această metodă poate fi utilă pentru îndepărtarea compușilor anorganici solubili în apă (de exemplu, aluminiu) din hidrolizați de proteine. De remarcat, acid tungstic 1% poate precipita atât proteine, cât și peptide cu ≥ 4 reziduuri AA [10]. Astfel, PCA sau TCA pot fi utilizate împreună cu acidul tungstic pentru a distinge peptidele mici și mari.
Producția industrială de hidrolizați de proteine
Considerații generale despre hidroliza proteinelor
Proceduri generale pentru producerea de peptide din proteine animale și vegetale. Peptidele (inclusiv peptidele bioactive) pot fi produse din proteine prezente în produsele de origine animală (inclusiv subproduse) sau din materialul furajelor de origine vegetală (de exemplu, soia și grâul) prin hidroliză chimică, enzimatică sau microbiană. Este posibil să fie necesar ca aceste proceduri generale să fie modificate pentru producția de peptide, în funcție de sursele de proteine și specificațiile produsului
Gradul de hidroliză
Hidrolizatele de proteine includ AA libere, peptide mici și peptide mari. Proporțiile acestor produse variază în funcție de sursele de proteine, de calitatea apei, de tipul de proteaze și de speciile de microbi. Gradul de hidroliză, adică măsura în care proteina este hidrolizată, este măsurat prin numărul de legături peptidice scindate, împărțit la numărul total de legături peptidice dintr-o proteină și înmulțit cu 100 [3]. Numărul de legături peptidice clivate se măsoară prin moli de AA libere plus moli de peptide solubile în TCA sau PCA. Datorită lipsei de standarde pentru toate peptidele generate de hidroliza proteinelor, este dificil din punct de vedere tehnic să cuantificăm peptidele eliberate din surse de proteine animale, vegetale sau microbiene. Procentul de AA sub formă liberă sau sub formă de peptidă se calculează după cum urmează:
Atunci când catabolismul AA este limitat (ca în hidroliza enzimatică), procentul AA în peptide este calculat ca (AA total în AA fără proteine)/AA total în proteine x 100%. Cromatografia lichidă de înaltă performanță (HPLC) este utilizată pe scară largă pentru determinarea AA-urilor libere [12]. HPLC și alte tehnici analitice (de exemplu, spectroscopia de rezonanță magnetică nucleară, ionizarea prin matrice a ionizării cu laser prin spectrometrie de masă de zbor, cartografierea peptidelor și cromatografia cu schimb de ioni) sunt adesea folosite pentru a caracteriza peptidele din hidrolizate de proteine [13, 14]. Când sunt disponibile standarde, HPLC poate fi utilizat pentru a analiza peptidele.
Metode pentru hidroliza proteinelor
Hidroliza acidă a proteinelor
Hidroliza acidă a unei proteine (gelatină) la o temperatură ridicată a fost raportată pentru prima dată de chimistul francez H. Braconnot în 1920. Se stabilește acum că hidroliza completă a unei proteine în 6 mol/L HCl are loc la 110 ° C timp de 24 de ore [12]. O perioadă de timp mult mai scurtă (de exemplu, 2 până la 6 ore) este utilizată pentru a produce peptide [3]. După hidroliză, produsul este evaporat, pasteurizat și uscat prin pulverizare. Majoritatea hidrolizaților de proteine acide sunt folosiți ca agenți de îmbunătățire a aromei (de exemplu, produse aromatizante, cum ar fi proteine vegetale hidrolizate) [5]. Metoda de hidroliză acidă a unei proteine oferă avantajul unui cost redus. Cu toate acestea, acest proces are ca rezultat distrugerea completă a triptofanului, pierderea parțială a metioninei și conversia glutaminei în glutamat și a asparaginei în aspartat [5].
Hidroliza alcalină a proteinelor
Agenții alcalini, cum ar fi hidroxidul de calciu, sodiu sau potasiu (de exemplu, 4 mol/L), pot fi utilizați la o temperatură ridicată (de exemplu, 105 ° C) timp de 20 de ore pentru a hidroliza complet proteina [12, 15]. Temperaturi mai scăzute (de exemplu, 27 până la 55 ° C) și o perioadă mai scurtă a timpului de hidroliză (de exemplu, 4 până la 8 ore) sunt deseori de dorit pentru generarea peptidelor în industria alimentară [5]. După hidroliză, produsul este evaporat, pasteurizat și uscat prin pulverizare. La fel ca hidroliza acidă a proteinelor, hidroliza alcalină a proteinelor oferă avantajul unui cost redus și poate avea o rată de recuperare de 100% a triptofanului [12]. Cu toate acestea, acest proces are ca rezultat distrugerea completă a majorității AA (de exemplu, pierderi de 100%). Astfel, deși hidroliza alcalină este adesea utilizată pentru producerea agenților de spumare (de exemplu, înlocuitori ai proteinelor din ouă) și a spumelor de stingere a incendiilor, nu este utilizată pe scară largă în industria alimentară.
Proteaze fără celule
Legăturile peptidice ale proteinelor pot fi descompuse prin multe tipuri diferite de proteaze, care pot fi clasificate ca exopeptidaze și endopeptidaze pe baza tipului de reacție, și anume hidroliza unei legături peptidice în regiunea terminală (o exopeptidază) sau într-o regiune internă (o endopeptidază) a unei proteine [2]. Unele proteaze hidrolizează dipeptidele (dipeptidaze), în timp ce altele elimină reziduurile AA terminale care sunt substituite, ciclizate sau legate prin legături izopeptidice (și anume legături peptidice, altele decât cele ale grupărilor α-carboxil cu α-amino; de exemplu, ω-peptidaze). Când o protează prezintă o preferință marcată pentru o legătură peptidică formată dintr-un anumit reziduu de AA, numele acestui AA este utilizat pentru a forma un calificativ (de exemplu, „leucina” aminopeptidază și „prolină” endopeptidază). În schimb, pentru enzimele cu specificitate foarte complexă sau largă, sunt utilizate nume de serie alfabetice sau numerice (de exemplu, peptidil-dipeptidază A, peptidil-dipeptidază B, dipeptidil-peptidază I și dipeptidil-peptidază II) pentru hidroliza proteinelor. Unele proteaze pot avea atât proprietăți exopeptidază, cât și endopeptidază (de exemplu, catepsine B și H). Hidroliza enzimatică are loc în condiții ușoare (de exemplu, pH 6-8 și 30-60 ° C) și minimizează reacțiile secundare.
Hidroliza microbiană a proteinelor
Microorganismele eliberează proteaze pentru a hidroliza proteinele extracelulare în peptide mari, peptide mici și AA libere. Peptidele mici pot fi preluate de microbi pentru a fi supuse hidrolizei intracelulare, producând AA libere. Microorganismele produc, de asemenea, alte enzime decât proteaze pentru a degrada carbohidrații și lipidele complexe [22]. Fermentarea proteinelor este clasificată într-un tip lichid sau solid. Fermentarea în stare lichidă se realizează cu substraturi proteice în condiții de fermentare cu umiditate ridicată, în timp ce fermentarea în stare solidă se efectuează în condiții de fermentare cu umiditate scăzută. Nivelul scăzut de umiditate al fermentației în stare solidă poate ajuta la reducerea timpului de uscare a hidrolizatelor de proteine.
Peptide bioactive în hidrolizate de proteine
Definiție
Peptidele bioactive sunt definite ca fragmente de secvențe AA într-o proteină care conferă funcții biologice dincolo de valoarea lor nutrițională [25]. Au activități antimicrobiene, antioxidante, antihipertensive și imunomodulatoare. Aceste peptide bioactive au de obicei 2-20 reziduuri AA în lungime, dar unele pot fi formate din> 20 reziduuri AA [23]. Multe dintre ele prezintă proprietăți structurale comune, cum ar fi un număr relativ mic de AA, o abundență ridicată de reziduuri AA hidrofobe și prezența reziduurilor Arg, Lys și Pro [24]. La animale, peptidele endogene îndeplinesc funcții fiziologice sau de reglare cruciale. De exemplu, PEC-60 activează Na/K ATPaza în intestinul subțire și în alte țesuturi [26]. În plus, multe peptide intestinale (secretate de celulele Paneth) au o funcție antimicrobiană [27]. Mai mult, creierul eliberează numeroase peptide pentru a regla starea endocrină, consumul de alimente și comportamentul la animale [28].
Transportul peptidelor mici în intestinul subțire
În intestinul subțire, transportorul peptidic 1 (PepT1) este responsabil pentru transportul condus de protoni al di- și tri-peptidelor extracelulare prin membrana apicală a enterocitului în celulă [29]. Cu toate acestea, datorită activității ridicate a peptidazelor intracelulare în intestinul subțire [2], este puțin probabil ca o cantitate semnificativă din punct de vedere nutrițional de peptide din lumenul intestinului să poată pătrunde în vena portă sau în circulația limfatică. Este posibil ca o cantitate limitată, dar semnificativă din punct de vedere fiziologic, de peptide (în special cele care conțin un iminoacid) să poată fi absorbită intactă din conținutul luminal în sânge prin celule M, exosomi și enterocite prin transportul celulelor transepiteliale [30, 31] . Peptidele derivate din dietă își pot exercita acțiunile bioactive (de exemplu, fiziologice și de reglare) la nivelul intestinului subțire, iar semnalele generate intestinal pot fi transmise creierului, sistemului endocrin și sistemului imunitar al organismului pentru a avea un impact benefic asupra tot corpul.
Inhibitori ai peptidelor ECA
Prima peptidă bioactivă derivată din alimente, care a îmbunătățit calcificarea osoasă independentă de vitamina D la sugarii rahitici, a fost produsă din cazeină [32]. Până în prezent, multe lapte sau carne au generat multe peptide inhibitoare ale enzimei de conversie a angiotensinei-I (ECA) (Tabelul 2). ACE elimină dipeptida C-terminală His-Leu din angiotensina I (Ang I) pentru a forma Ang II (o peptidă vasoconstrictoare puternică), conferind astfel efectele lor antihipertensive [33]. Cele mai bune exemple pentru peptidele inhibitorului ECA sunt Ile-Pro-Pro (IPP) și Val-Pro-Pro (VPP), ambele derivate din proteina din lapte prin hidroliza proteazei neutre, a proteazei alcaline sau a papainei [34]. Există dovezi că aceste două peptide bogate în prolină pot scăpa parțial de hidroliza gastro-intestinală și pot fi transportate peste epiteliul intestinal în circulația sângelui [35]. În mod similar, hidroliza proteinelor din carne [36] și gălbenuș de ou [37] generează, de asemenea, inhibitori ECA puternici.
Peptide antioxidante și antimicrobiene
Multe peptide mici din produse de origine animală (de exemplu, pește și carne) (Tabelul 3) și furaje din surse vegetale [25] au funcții anti-oxidative prin eliminarea radicalilor liberi și/sau inhibarea producției de oxidanți și citokine pro-inflamatorii [38- 41]. Aceste peptide mici pot reduce producția de oxidanți de către intestinul subțire, îmbunătățind în același timp îndepărtarea oxidanților, rezultând o scădere a concentrațiilor intracelulare și ameliorarea stresului oxidativ (Fig. 3). Multe dintre peptidele bioactive au atât efecte inhibitoare ECA, cât și efecte anti-oxidative [36, 37]. În plus, unele peptide din proteine-hidrolizate animale (Tabelul 4) și vegetale [25] au, de asemenea, efecte antimicrobiene, după cum sa raportat pentru anumite peptide endogene din intestinul subțire [27]. Aceste peptide antimicrobiene își exercită acțiunile prin deteriorarea membranei celulare a bacteriilor, interferând cu funcțiile proteinelor lor intracelulare, inducând agregarea proteinelor citoplasmatice și afectând metabolismul bacteriilor [42-44], dar mecanismele de bază rămân în mare parte necunoscute [ 27].
Inhibarea stresului oxidativ celular de către peptidele mici din dietă în intestinul subțire. Peptidele mici, care sunt completate cu dietele animalelor (în special animalele tinere), pot reduce producția de oxidanți de către intestinul subțire și pot îmbunătăți îndepărtarea oxidanților, ducând la o scădere a concentrațiilor lor intracelulare și ameliorarea stresului oxidativ. (-), inhibitie; (+), activare; ↓, scade
Peptide opioide
Hidroliza anumitor proteine [de exemplu, cazeină, gluten (prezent în grâu, secară și orz) și soia] în tractul gastro-intestinal poate genera peptide opioide [45]. Acest lucru poate fi realizat in vitro prin utilizarea enzimelor digestive din intestinul subțire al mamiferelor (de exemplu, porci). Peptidele opioide sunt oligopeptide (de obicei 4-8 reziduuri AA în lungime) care se leagă de receptorii opioizi din creier pentru a afecta funcția intestinală [46, 47], precum și comportamentul și aportul alimentar al animalelor (Tabelul 5). Mai mult, hidrolizatele proteice care conțin peptide asemănătoare opioidelor pot fi utilizate ca aditivi furajeri pentru a atenua stresul, a controla durerea și somnul și a modula satietatea la animale.
Aplicații ale hidrolizaților de proteine vegetale și animale în hrana animalelor
Considerent general
Peptide vegetale
Peptide animale
Scara potențială și valoarea economică pentru utilizarea globală a hidrolizatelor de proteine animale și vegetale în hrana animalelor
Prelucrarea industrială a animalelor domestice de fermă generează cantități mari de țesuturi (30-40% din greutatea corporală) care nu sunt consumate de oameni, inclusiv viscere, tăieturi de carcase, os (20-30% din greutatea corporală), grăsimi, piele, picioare, mici -țesut intestinal (2% din greutatea corporală), pene (până la 10% din greutatea corporală) și sânge colecționabil (5% din greutatea corporală), subprodusele globale de animale și păsări fiind necomestibile
54 miliarde kg/an [66-68]. De asemenea, industriile de prelucrare a peștelui produc cantități mari de deșeuri (până la 55% din greutatea corporală), cum ar fi tăieturile musculare (15-20%), pielea și aripioarele (1-3%), oasele (9-15%), capete (9-12%), viscere (12-18%) și solzi, subprodusele mondiale de pește necomestibile fiind
6 miliarde kg/an [66-69]. Astfel, volumul anual global al subproduselor animale totale generate de industriile de prelucrare este de aproximativ 60 miliarde kg anual. Presupunând că doar 5% din subprodusele de origine animală și produsele vegetale destinate hranei pentru animale sunt utilizate pentru hidroliza proteinelor și pe baza prețurilor medii actuale ale hidrolizatelor de proteine animale, soia și grâu [70], randamentele acestora sunt de 3, 6,75 și 12,75 miliarde kg/an, respectiv, și valorile lor economice sunt 4,5, 3,88 și 20,02 miliarde USD/an (Tabelul 6). Astfel, hidrolizatele de proteine din subprodusele porcilor sau păsărilor de curte și din ingredientele vegetale sunt promițătoare în susținerea agriculturii animale și gestionarea animalelor de companie din întreaga lume.
- Izolat de proteine din zer pur prin calibru muscular Nutriție cele mai mici prețuri la mușchi; Putere
- Institutul de nutriție neuroprotectoare pentru medicina funcțională
- Nicole Ceil Nutrition Functional
- Rezultatele oncologice și funcționale ale nutriției parenterale totale postoperatorii după radical
- Reflex Nutrition Diet Protein 2kg; Cardiff Sports Nutrition