Blandine Laferrère
1 Divizia de endocrinologie, New York Obesity Nutrition Research Center, Departamentul de Medicină, Colegiul Columbia al Medicilor și Chirurgilor de la Columbia University, New York, NY, Statele Unite
François Pattou
2 Cercetări translaționale privind diabetul, UMR 1190, Inserm, Université Lille, Lille, Franța
3 Chirurgie endocrină și metabolică, CHU Lille, Lille, Franța
Abstract
Ocolirea gastrică Roux-en-Y are ca rezultat pierderea în greutate mare și susținută și rezolvarea diabetului de tip 2 în 60% din cazuri la 1-2 ani. Pe lângă restricția calorică și pierderea în greutate, diferite mecanisme mediate gastro-intestinale, independente de pierderea în greutate, contribuie și la controlul glucozei. Reorganizarea anatomică a intestinului subțire după by-pass gastric are ca rezultat un tranzit accelerat al nutrienților, îmbunătățește eliberarea hormonilor intestinali post-prandiali incretinici și de insulină, modifică metabolismul și ciclul entero-hepatic al acizilor biliari, modifică absorbția glucozei intestinale și metabolismul și modifică compoziția și funcția microbiomului. Ameliorarea funcției celulelor beta după bypass gastric la persoanele cu diabet de tip 2 necesită stimulare enterică. Cu toate acestea, funcția celulelor beta ca răspuns la stimulul intravenos al glucozei rămâne grav afectată, chiar și la persoanele cu remisie clinică completă a diabetului. Afectarea permanentă a celulei beta poate explica recăderea diabetului la ani după operație.
Prevalența obezității severe, definită ca indicele de masă corporală (IMC) peste 40 kg/m 2, este în creștere. Afectează femeile mai mult decât bărbații, iar femeile afro-americane (16,9%) mai mult decât femeile caucaziene (9,3%) sau hispanice (8,9%) (1). Numărul de intervenții chirurgicale bariatrice efectuate anual în SUA a crescut doar minim în ultimii ani și a fost estimat la 216.000 în 2016. Prin urmare, doar un procent mic de persoane care îndeplinesc criteriile pentru chirurgia bariatrică, cea mai eficientă și durabilă formă de pierdere în greutate, de fapt beneficiați de aceasta. Bypass-ul gastric Roux-en-Y (RYGB) a fost tipul dominant de intervenție chirurgicală efectuată în SUA până în 2011. Gastrectomia verticală a mânecii (VSG) este acum cea mai efectuată intervenție chirurgicală și a reprezentat 58% din toate procedurile bariatrice în 2016 (2, 3 ). Cu toate acestea, RYGB este modelul chirurgical cel mai mult studiat pentru a investiga mecanismele intestinale, independent de pierderea în greutate, care pot contribui la controlul post-operator al glucozei. În plus, există mai multe date pe termen lung privind remisiunea clinică a diabetului de tip 2 (T2D) după RYGB. Prin urmare, această revizuire va fi mai centrată pe RYGB.
Bazând date din studii observaționale (14) și RTC (15, 28-30), rata remisiei T2D este de aproximativ 60% la 2 ani după RYGB. Mecanismul prin care RYGB are ca rezultat această remarcabilă rată ridicată de remisiune a diabetului nu este pe deplin elucidat. Întrebarea cheie este dacă remisia diabetului este în întregime dependentă de pierderea în greutate sau nu. Dacă este determinată de pierderea în greutate, atunci cercetările ar trebui să se concentreze asupra mecanismelor, probabil mediate central, prin care pacienții mănâncă mai puțin, pierd aproximativ 30% din greutatea corporală totală și sunt capabili să mențină greutatea, toate obiectivele neegalate cu dieta și exercițiile singur (31) sau cu farmacoterapie (32). Dacă unele efecte independente ale pierderii în greutate sunt în joc în remisiunea diabetului, acestea sunt probabil mediate de intestin. Cu toate acestea, deși RYGB are ca rezultat numeroase modificări ale mecanismelor endocrine mediate de intestin, dintre care unele joacă un rol în controlul glucozei post-prandial, rolul lor în remisiunea diabetului nu a fost pe deplin demonstrat. Înțelegerea acestor mecanisme este crucială, deoarece poate ajuta la identificarea unor ținte noi pentru tratamentul T2DM.
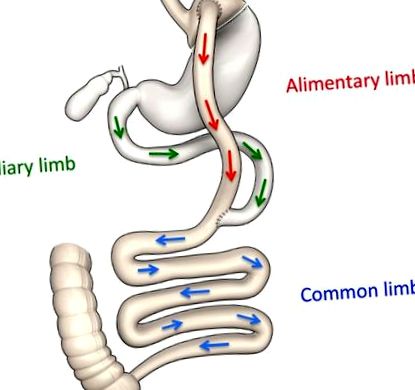
Reprezentarea schematică a modificărilor anatomice după RYGB.
Model mecanic al glicemiei îmbunătățite după RYGB. RYGB îmbunătățește metabolismul glucozei prin scăderea în greutate și prin mecanisme independente de greutate, inclusiv stimularea peptidelor intestinale, modificarea ciclului enterohepatic al acizilor biliari, remodelarea urmelor gastro-intestinale și modificarea microbiomului. Linii solide: mecanisme bazate pe dovezi; linii punctate: mecanisme posibile. RYGB, chirurgie de by-pass gastric Roux-en-Y; HGP, producție hepatică de glucoză; Derivarea BA, derivarea acizilor biliari; GI, intestin gastro-intestinal; GNG, gluconeogeneză; GLP-1, peptida asemănătoare glucagonului 1; PYY, peptida YY; OXY, oxyntomodulin; GSIS, secreție de insulină stimulată de glucoză; PPG, glucoză post-prandială; ↑: creștere; ↓: scădere.
Rolul GLP-1 endogen crescut asupra controlului secreției de insulină ca răspuns la glucoza orală după RYGB este bine demonstrat; Totuși, implicația sa pe termen lung asupra remisiunii diabetului rămâne evazivă (79). Funcția beta-celulară, evaluată ca răspuns la stimulul glucozei intravenos, se îmbunătățește doar minim și rămâne afectată la persoanele cu remisie clinică a diabetului și pierderea în greutate susținută, până la 3 ani după RYGB (76). Inversarea hipoglicemiei hiperinsulinemice post-prandiale prin administrarea alimentelor direct prin gastrostomie în stomacul rămas, mai degrabă decât per os, evidențiază absența ameliorării permanente a funcției endocrine pancreatice la ani după RYGB (80, 81). Prin urmare, creșterea secreției de insulină legată de masă după RYGB depinde de stimularea enterică mai degrabă decât de reacția îmbunătățită a celulelor beta la glucoză (82) sau la stimuli incretinici (83). Defectul persistent al funcției celulelor beta, depășit în timpul meselor, poate explica, parțial, potențialul recăderii diabetului la ani după RYGB, la pacienții mai în vârstă care consumă o dietă mai puțin restrictivă și recâștigă o anumită greutate.
tabelul 1
Mecanisme de control glicemic după RYGB, VSG și AGB.
| Pierdere în greutate | +++ | ++ | + |
| Tranzitul accelerat al nutrienților | + | + | ↔ |
| ↑ GLP-1, PYY, OXY | ++ | +/ - | ↔ |
| Derivarea acidului biliar | + | - | - |
| Rezerva de acid biliar circulant | ↑ | ↑/↔ | ↓/↔ |
| Remodelarea tractului gastro-intestinal | + | - | - |
| Microbiom | + | + | + |
În ansamblu, rezultatele studiilor clinice și pe animale sugerează un rol important al grupării, compoziției, redirecționării și semnalizării modificate a acizilor biliari care poate contribui la efectele metabolice ale RYGB sau VSG (Tabelul (Tabelul 1). 1). Experimentele elegante de derivare a acizilor biliari și FXR și TGR5 KO propun un rol pentru acizii biliari luminali în îmbunătățirea metabolismului după intervenția chirurgicală bariatrică. Cu toate acestea, traducerea clinică a acestor date este încă evazivă. Disocierea temporală între creșterea imediată a GLP-1 și creșterea întârziată a acizilor biliari circulanți, face mai puțin probabil ca cele două procese să fie legate, cel puțin în primele luni după RYGB. Lipsesc informații importante despre concentrația biliară intraluminală după RYGB (sau VSG) la om. Compoziția și, prin urmare, funcția acizilor biliari diferă între specii și se adaugă dificultății cercetării translaționale în acest domeniu. În cele din urmă, variabilitatea mare a concentrațiilor circulante de acizi biliari în studiile la om (115) indică alte mecanisme, poate dependente de dietă și/sau microbiom, care le pot modula compoziția și funcția.
O variabilă importantă adesea trecută cu vederea în studiile secțiunilor transversale este schimbarea în timp a multor mecanisme descrise mai sus. Timpul accelerat de tranzit al nutrienților și eliberarea stimulată de GLP-1 apar ambele imediat după RYGB și sunt susținute în timp. Cu toate acestea, varianța răspunsului GLP-1 crește între 1 lună și 3 ani după operație (147). Noi (113) și alții (111) am demonstrat o schimbare temporală a grupului de acizi biliari circulanți după RYGB. Adaptarea intestinului (hipertrofie, densitatea celulelor endocrine, detectarea glucozei, GNG) și microbiomul sunt susceptibile de a suferi transformări temporale, în parte, dependente de dietă. Aceste date arată complexitatea fiziologiei și adaptabilității intestinului, dificultatea studiilor clinice și importanța studiilor longitudinale pe termen lung pentru o mai bună înțelegere a contribuției intestinului la glicemia post-prandială, precum și la remisiunea diabetului.
Pe scurt, RYGB are ca rezultat remisia T2DM ca urmare a pierderii în greutate mari și susținute. RYGB declanșează, de asemenea, mecanisme gastro-intestinale independente de greutate, inclusiv stimularea incretinelor, modularea transportului și metabolismului glucozei intestinale, modificarea ciclului acizilor biliari entero-hepatici și modificarea microbiomului. Aceste sisteme legate de intestin sunt interconectate, deoarece diversificarea bilei afectează absorbția glucozei intestinale superioare, malabsorbția nutrienților și acizii biliari pot stimula GLP-1, iar microbiomul modulează multe dintre aceste ținte gastro-intestinale. Este posibil ca mecanismele descrise mai sus să acționeze împreună pentru a contribui, cu pierderea în greutate și restricția caloriilor, la controlul glucozei după intervenția chirurgicală bariatrică (Figura (Figura 2). 2). Cu toate acestea, trebuie făcute mai multe cercetări clinice pentru a înțelege mecanismele moleculare prin care aceste diferite sisteme interacționează pentru a îmbunătăți metabolismul glucozei și pentru a duce la remisiunea diabetului. Lipsa normalizării funcției celulelor beta ca răspuns la stimulul glucozei IV poate fi un factor determinant important al riscului viitor de recidivă a diabetului după intervenția chirurgicală RYGB.
Contribuțiile autorului
Toți autorii enumerați au adus o contribuție substanțială, directă și intelectuală la lucrare și au aprobat-o pentru publicare.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Îi mulțumim lui Kapila Patel pentru ajutorul acordat în formatarea referințelor și figurilor. BL și o parte din lucrările la care face referire în această revizuire, au fost susținute, parțial, de granturi acordate de Institutul Național de Sănătate (NIH) R01DK067561, P30DK26687-30, P30DK063608 și parțial de Centrul Național pentru Progresul Științelor Translaționale, NIH, prin numărul de grant UL1TR001873. Conținutul este exclusiv responsabilitatea autorilor și nu reprezintă neapărat opiniile oficiale ale NIH. FP a fost susținut de Féréphone Francophone de Recherche sur le Diabète (FFRD).
- Spre deosebire de restricția de calorii, operația de by-pass gastric Roux-en-Y nu crește AgRP hipotalamic
- Pierderea totală în greutate ca măsură a rezultatului la alegere după ocolirea gastrică Roux-en-Y - PubMed
- Pierderea totală în greutate după by-pass gastric laparoscopic Roux-en-Y este influențată de greutatea preoperatorie
- Care sunt cele mai bune centre medicale de ocolire gastrică mini din Nijnevartovsk, Rusia
- Diabetul Lancet; Endocrinologie Bypassul gastric ajută adolescenții cu obezitate severă să mențină greutatea