Adăugați la Mendeley
Repere
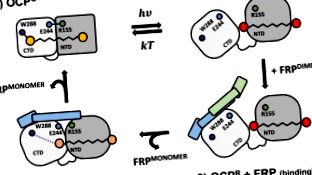
OCP W288A este capabil de stingerea fluorescenței PBs.
Mecanismele de stingere a PB-urilor prin OCP R și OCP W288A sunt echivalente.
La fel ca OCP R, OCP W288A se leagă de FRP la stoichiometrie 1: 1.
Legarea FRP necesită monomerizarea sa; cauzează compactarea și „oranjarea” OCP W288A .
FRP pare să funcționeze ca un adaptor sau o proteină de schelă în raport cu OCP.
Abstract
În cianobacterii, Proteina Carotenoidă Portocalie (OCP) și Proteina de Recuperare a Fluorescenței (FRP) sunt centrale în mecanismul fotoprotector constând în stingerea reglementată a fluorescenței ficobilizomului (PBs). Datorită naturii tranzitorii și flexibile a formei de stingere roșie activată prin lumină, OCP R, care se obține din forma portocalie stabilă întunecată adaptată, OCP O, prin fotoconversie, mecanismul detaliat al fotoprotecției rămâne neclar. Aici demonstrăm că mutantul nostru recent descris W288A al OCP Synechocystis (denumit în continuare OCP W288A) este un analog complet funcțional al formei OCP R, care este capabil să stingă in vitro fluorescența PB constitutivă, fără a fi nevoie de fotoactivare. Acest efect de stingere a PB este abolit în prezența FRP, care interacționează cu OCP W288A cu afinitate micromolară și o stoichiometrie aparentă de 1: 1, în mod neașteptat, implicând disocierea dimerilor FRP. Acest lucru stabilește OCP W288A ca un sistem model robust care oferă perspective noi despre interacțiunea dintre OCP și FRP pentru a regla fotoprotecția în cianobacterii.
Abstract grafic
- Descărcare: Descărcați imaginea de înaltă rezoluție (147 KB)
- Descărcare: Descărcați imaginea la dimensiune completă
Anterior articolul emis Următorul articolul emis
- Yunnan Jinggu Ziya puer 100g castron crud mini mini ceai ceai pur de slăbire, îngrijire a frumuseții alimente verzi pentru piele
- Zijuan, ceai purpuriu, produse de ceai slăbitor puerh, China zijuan, ceai purpuriu, ceai slăbitor puerh
- Ceai negru purpuriu Yunnan, China maro Ziya ceai de slăbit îngrijire frumusețe shin alimente, Vezi chinezesc
- Chirurgie de reducere a greutății - Centrul de excelență pentru chirurgia bariatrică - Bronx, New York City -
- Răspunsul la Ali Fedotowsky; Postarea vulnerabilă despre corpul ei post-bebeluș a fost incredibil de puternică