Abstract
Autofagia este o cale catabolică intracelulară extrem de conservată care degradează proteinele și organitele celulare de lungă durată. Autofagia este activată în mod normal ca răspuns la lipsa de nutrienți și alte stresuri ca mecanism de supraviețuire celulară. Dovezile acumulate indică faptul că autofagia joacă un rol critic în fiziopatologia ficatului, pe lângă menținerea echilibrului energetic hepatic și al nutrienților. Consumul de alcool provoacă modificări metabolice hepatice, stres oxidativ, acumularea de picături lipidice și mitocondrii deteriorate, toate acestea pot fi reglate de autofagie. Această revizuire rezumă concluziile recente despre rolul și mecanismele autofagiei în boala hepatică alcoolică și posibila intervenție pentru tratarea bolilor hepatice alcoolice prin modularea autofagiei.
Introducere
Autofagia este activată ca răspuns la medii adverse, cum ar fi privarea de nutrienți sau factorii de creștere, ca mecanism de supraviețuire 4-7. Este o cale de degradare intracelulară foarte conservată prin care citoplasma în vrac și organitelele de prisos sau deteriorate sunt învelite de structuri cu membrană dublă numite autofagozomi 4-7. Conținutul autofagozomilor este degradat după fuziunea cu lizozomii, care sunt numiți apoi autolizozomi. Cu toate acestea, autofagia poate apărea și în condiții bazale, care se numește autofagie bazală. În plus față de rolul său în menținerea homeostaziei celulare, autofagia joacă, de asemenea, un rol în dezvoltarea 8, apărarea împotriva infecțiilor microbiene 9 și eliminarea proteinelor pliate greșit. Prin urmare, disfuncția autofagiei poate duce la patogeneza numeroaselor boli umane, inclusiv cancer, boli neurodegenerative, diabet, boli infecțioase și atrofie musculară 10, 11 .
Consumul și abuzul de alcool sunt cauzele majore ale bolilor hepatice, care reprezintă o problemă majoră de sănătate în Statele Unite. Consumul excesiv de alcool induce schimbări metabolice dramatice, leziuni mitocondriale, perturbarea homeostaziei lipidelor, stresul oxidativ și moartea celulară în hepatocite. Toate acestea pot fi reglementate de autofagie. În această revizuire, vom rezuma rolul emergent al autofagiei în boala hepatică alcoolică.
Mașini autofagice
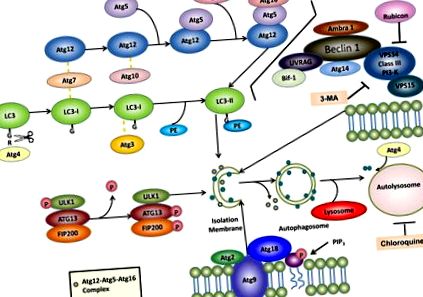
Până în prezent, peste 30 de gene diferite legate de autofagie (Atg) au fost identificate în drojdie și majoritatea au omologi de mamifere care participă la autofagie sau la un proces legat de autofagie 12. S-a găsit că mai mulți complexe multi-moleculare contribuie la formarea autofagozomilor, inclusiv: (1) complex proteină-kinază ULK1, (2) complex VPS34-Beclin1 clasa III PI3-kinază, (3) complex Atg9-Atg2-Atg18 și (4) )) sistemele de conjugare Atg5-Atg12-Atg16 și Atg8/LC3 (Figura 1).
Autofagia implică formarea de autofagozomi cu membrană dublă care se fuzionează cu lizozomii pentru a forma autolizozomi pentru degradarea proteinelor intracelulare și a organelor. Pentru autofagie sunt necesare cel puțin patru grupe funcționale importante de proteine Atg: (1) complexul protein-kinază ULK1 și (2) complexul VPS34-Beclin 1 clasa III PI3-kinază reglează inițierea autofagiei, (3) complexul Atg9-Atg2-Atg18 reglează expansiunea PAS prin transportarea lipidelor și (4) sistemele de conjugare Atg5-Atg12-Atg16 și LC3 reglează alungirea membranelor autofagozomice. LC3 conjugat cu fosfatidiletanolamină (PE) (denumit LC3-II) rămâne pe membranele de izolare și membranele autofagozomului, în timp ce complexul Atg12-Atg5-Atg16 se asociază temporar cu membranele de izolare și se disociază de membranele autofagozomului. Odată ce autofagozomii se fuzionează cu lizozomii pentru a forma autolizozomi, membrana interioară LC3-II este degradată de enzimele lizozomale, în timp ce membrana exterioară LC3-II este deconjugată și reciclată de Atg4. De asemenea, sunt evidențiați inhibitori ai autofagiei farmacologice, cum ar fi 3-metiladenina (3-MA) și clorochina. Pentru mai multe detalii, consultați textul.
Complexul ULK din celulele mamiferelor este compus din ULK1 (care este un omolog de drojdie Atg1), FIP200 (o moleculă asemănătoare drojdiei Atg17), Atg13 și Atg101 13-15. Acest complex este localizat în principal în citosol și se asociază cu membrana de izolare a autofagiei la inducerea autofagiei pentru a regla stadiul incipient al formării autofagozomilor. Acest complex funcționează, de asemenea, în aval de mTOR și servește ca senzor celular pentru starea nutrienților pentru a iniția autofagia prin recrutarea proteinelor autofagice din aval către autofagozomi. În timpul înfometării sau al tratamentului cu rapamicină, mTOR este suprimat, ceea ce duce la defosforilarea ULK1. ULK1 este o protein kinază serină/treonină și defosforilată ULK1 este activă enzimatic, conducând la fosforilarea Atg13 și FIP200 15. Activitatea kinazică a ULK1 este considerată a fi importantă pentru recrutarea altor proteine Atg din aval, cum ar fi Atg16L și formarea ulterioară a autofagozomilor 16 .
Atg6 și omologul său la mamifere, Beclin 1, sunt importante pentru inițierea și reglarea autofagiei 17. Beclin 1/Atg6 formează un complex cu VPS34, VPS15 și Atg14. VPS34 este o PI-3-kinază de clasa III care acționează ca un regulator esențial al autofagiei prin producerea de fosfatidilinozitol-3-fosfat (PI-3-P). Activitatea VPS34 este reglementată de complexul Beclin 1/Atg6. Bcl-2 și Bcl-xL interacționează cu Beclin1 pentru a menține autofagia sub control prin disocierea interacțiunii Beclin 1 și VPS34. Beclin 1 se leagă, de asemenea, de alte câteva proteine care induc autofagia, inclusiv ambra-1 18 și UVRAG 19. Bif-1/endofilina B1 interacționează cu Beclin 1 prin UVRAG acționând ca un regulator asupra complexului Atg6-VPS34 20. Rubiconul (Run protein protein as Beclin 1 interacting and cysteine-bogat care conține) interacționează cu VPS34 și acționează ca un regulator negativ al autofagiei 21, 22. 3-metiladenina (3MA), un inhibitor de autofagie utilizat pe scară largă, inhibitori ai clasei III PI-3-kinază și, la rândul său, inhibă formarea de autofagozomi 23 .
Atg9 este singura proteină transmembranară dintre proteinele de bază ale autofagiei care este conservată la toate speciile 24. Are șase domenii transmembranare propuse cu termenii săi carboxil expuși în citosol 25. Există doi ortologi funcționali ai Atg9 în celulele mamiferelor: Atg9L1 și Atg9L2. Atg9L1 este exprimat omniprezent, în timp ce Atg9L2 este exprimat numai în placentă și glanda pituitară 26. Șoarecii knockout Atg9 mor imediat după naștere, asemănător altor șoareci knockout proteici de mașini autofagice, cum ar fi Atg3, Atg5, Atg7 și Atg16 27. În drojdie, Atg9 interacționează cu Atg11 și Atg17, iar această interacțiune este necesară pentru reglarea căii citoplasmei la vacuole (Cvt) și a autofagiei 28. Atg9 este localizat pe locul de asamblare a fagoforului (PAS) și interacționează cu Atg18, o proteină de legare a PI3-P și o proteină de membrană periferică, Atg2. Se propune Atg9 să circule între rețeaua trans-Golgi, endosomii tardivi și PAS pentru a aduce sursele de membrană suplimentare necesare pentru creșterea membranelor autofagosomale, în funcție de starea nutrienților celulari 24, 25 .
În celulele mamiferelor, autofagsomii nou formați sunt distribuiți aleatoriu în citoplasma 31. În timpul maturării lor, autofagozomii se deplasează de-a lungul microtubulilor spre centrul de organizare a microtubulilor, unde lizozomii sunt îmbogățiți. Autofagozomii se fuzionează apoi cu lizozomii pentru a forma autolizomii posibil prin mica GTPază Rab7 și/sau două proteine de membrană lizozomală, Lamp1/2A 32-34. Substanțele chimice care perturbă structurile microtubulilor, cum ar fi vinblastina, pot inhiba autofagia 35. În plus față de întreruperea mașinilor de fuziune, substanțele chimice care cresc pH-ul lizozomal, cum ar fi clorochina și bafilomicina A 1 sau inhibitorii lizozomali ai proteazei, cum ar fi leupeptina, pepstatina A și E64D, toate sunt inhibitori puternici ai autofagiei 7, 31 .
Căi de semnalizare care reglementează autofagia mamiferelor
Clasa I PI3K-Act-mTOR
Proteine din familia Bcl-2
Stresul ER
Specii reactive de oxigen și autofagie
Consumul de etanol și activarea autofagiei
Fiind unul dintre cele mai active organe, ficatul joacă un rol central în reglarea echilibrului energetic general al organismului prin controlul metabolismului carbohidraților și lipidelor. Ficatul funcționează ca un sistem major de tamponare pentru a menține homeostazia macro- și micronutrienților pentru a permite altor țesuturi să funcționeze normal sub stres fiziologic 75. Deficitul de autofagie vizată de ficat (eliminare Atg7) are ca rezultat acumularea de agregate proteice pozitive la ubiquitină, mitocondrii deteriorate, steatoză și leziuni hepatice 76. Aceste descoperiri susțin un rol de supraviețuire al autofagiei în menținerea controlului calității proteinelor, lipidelor și organelor, eliminând proteinele și organele deteriorate, precum și picăturile excesive de lipide din ficat în timpul stresului. În plus, acumularea de dovezi indică acum că autofagia este implicată și în moartea celulelor hepatocitelor, steatohepatita, infecția cu virusul hepatitei și carcinomul hepatocelular 77-79 .
Hepatocitele șoarecilor au fost infectate cu Adenovirus-GFP-LC3 (10 particule virale pe celulă) timp de 16 ore și apoi fie netratate (A) sau tratate cu etanol (80 mM) timp de 6 oreb) urmată de microscopie confocală pentru GFP-LC3 sau microscopie electronică (c - d). N: nuclee, M: mitocondrii. Capete de săgeți: autofagozomi; săgeți: autolizozomi.
(A) Hepatocitele șoarecilor au fost infectate cu Adenovirus-GFP-LC3 (10 particule virale pe celulă) timp de 16 ore și apoi au fost încărcate cu Mitotracker Red (50 nM) timp de 15 minute, urmate de tratament cu etanol (80 mM) pentru încă 6 ore și microscopie confocală . Săgeți: GFP-LC3 structuri pozitive asemănătoare inelului învelite mitocondrii (mitofagie). (b) Șoarecii transgenici GFP-LC3 au fost tratați cu etanol (4,5 g/kg) prin gavaj acut timp de 16 ore. Criosecțiunile hepatice au fost preparate și colorate cu Bodipy 581/591-C11 pentru picături de lipide urmate de microscopie confocală. Panoul c a fost fotografia mărită din zona în cutie din panoul b. Săgeți: GFP-LC3 structuri pozitive în formă de inel învelite picături lipidice (lipofagie).
Mecanisme ale autofagiei induse de etanol
S-a speculat că etanolul poate inhiba autofagia, deoarece consumul cronic de etanol reduce activitatea AMPK în ficat 97. Cu toate acestea, așa cum am discutat mai sus, rolul AMPK în autofagie este încă controversat, iar inhibarea AMPK poate induce, de asemenea, autofagia 98. În plus, AMPK induce autofagia în principal prin inhibarea mTOR. Deoarece mTOR este activat de Akt, statutul mTOR în hepatocitele tratate cu etanol se bazează pe gradul de Akt și AMPK afectate de etanol. Constatarea că etanolul acut suprimă mTOR sugerează că Akt afectat ar putea juca un rol mai dominant decât AMPK afectat în autofagia indusă de etanol în hepatocite 79. Prin urmare, este posibil ca activarea AMPK, cum ar fi prin tratarea animalelor cu agoniști ai AMPK, să sporească în continuare autofagia indusă de etanol prin inhibarea maximă a mTOR. S-a raportat că mai mulți agoniști AMPK precum AICAR și metformina protejează semnificativ împotriva leziunilor hepatice induse de etanol la modelele animale 99, 100. Cu toate acestea, rămâne de stabilit dacă aceste efecte protectoare sunt asociate și cu inducerea autofagiei la aceste modele.
De asemenea, trebuie remarcat faptul că, deși o varietate de criterii pentru evaluarea autofagiei indică faptul că afecțiunile acute de etanol conduc la inducerea autofagiei în hepatocite și în ficatul de șoarece, dovezile care susțin o astfel de inducție în modelul de consum cronic de alcool sunt relativ rare. Datele din două rezumate prezentate în 2010 The Liver Meeting a sugerat că autofagia poate fi crescută în ficatul șoarecilor atunci când au fost hrăniți cu dieta Lieber-DeCarli timp de 4 săptămâni 84, 85. Cu toate acestea, nu este clar dacă testele de flux autofagic au fost efectuate în aceste studii. Prin urmare, relevanța autofagiei în consumul cronic de alcool trebuie încă determinată. În cele din urmă, ar fi interesant să vedem dacă autofagia ar fi modificată și la pacienții cu ALD. Centrul pentru ficat de la Universitatea din Kansas Medical Center a colectat peste 100 de exemplare de ficat uman. În prezent planificăm să examinăm autofagia la unele dintre exemplarele de la pacienții cu alcool.
Abordări terapeutice potențiale pentru tratarea ALD prin modularea autofagiei
S-a recunoscut bine că ALD este o cauză majoră de morbiditate și mortalitate în lume. Cu toate acestea, există puține alte tratamente de succes pentru ALD, pe lângă abstinența de a bea. Deși este dificil să se dezvolte un tratament eficient pentru patogeneza hepatică asociată expunerii cronice la alcool, ar fi mai aplicabil pentru dezvoltarea tratamentelor pentru pacienții spitalizați cu leziuni hepatice asociate intoxicației alcoolice acute.
Concluzii
Studii recente au indicat că alcoolul poate activa autofagia ca mecanism de protecție împotriva leziunilor hepatice alcoolice prin îndepărtarea selectivă a mitocondriilor deteriorate și a picăturilor de lipide hepatice. Autofagia indusă de alcool necesită metabolizarea alcoolului și producerea ROS. În plus, alcoolul poate induce și autofagie prin afectarea căii Akt-mTOR. Inhibarea proteazomului indusă de alcool și stresul ER, precum și căile independente de AMPK și mTOR, ar putea fi, de asemenea, implicate în autofagia indusă de alcool în ficat. Modularea autofagiei ar putea oferi noi abordări terapeutice pentru tratarea ALD (Figura 5).
Autofagia indusă de etanol ar putea fi mediată de mai multe mecanisme. (1) Autofagia indusă de etanol necesită metabolismul etanolului și producția de ROS. ROS poate activa autofagia prin suprimarea suplimentară a activității mTOR, Atg4B și proteazomului. Inhibarea proteazomului poate declanșa în continuare stresul ER și activarea JNK pentru a activa autofagia. (2) Etanolul poate suprima, de asemenea, Akt și mTOR prin reglarea în sus a PTEN. (3) AMPK și Akt afectate de etanol pot contracara reciproc pe mTOR, iar Akt afectat joacă un rol dominant în inhibarea mTOR. (4) Alte căi independente de AMPK și mTOR rămân a fi determinate în autofagia indusă de alcool. (5) Autofagia indusă de etanol îndepărtează selectiv mitocondriile deteriorate (mitofagia) și picăturile de lipide (lipofagia) pentru a proteja împotriva steatozei induse de etanol și a leziunilor hepatice.
Autofagia în celulele mamiferelor poate fi activată de diverși stimuli. Deși suprimarea țintei rapamicinei la mamifere (mTOR) este o cale majoră de semnalizare care reglează autofagia, autofagia poate fi activată, de asemenea, independent de mTOR de către diferiți stimuli. Două căi majore care reglează mTOR în celulele mamiferelor sunt căile PI3K-Akt și AMPK. Calea PI3K-Akt este declanșată de legarea factorilor de creștere a insulinei (IGF sau alți factori de creștere) la receptorul său, activând astfel PI3K. PI3K activat convertește PIP2 în PIP3 pentru a activa Akt. Akt apoi fosforilează și inactivează complexul TSC1/TSC2 rezultând activarea Rheb și mTOR. AMPK este activat în mod normal de kinaza sa în amonte LKB-1 sau de un raport intracelular crescut de AMP/ATP. AMPK poate fi suprimat de inhibitori chimici precum compusul C. AMPK activ apoi fosforilează direct TSC2 și inhibă mTOR pentru a activa autofagia. mTOR fosforilează, de asemenea, două ținte în aval 4E-BP1 și p70S6K care controlează traducerea proteinelor.
- Rolul vitaminelor în patogeneza bolilor hepatice grase nealcoolice
- Tratamentul bolilor hepatice alcoolice; Gastroenterologie; Hepatologie
- Înțelegerea bolii hepatice grase cheie pentru prevenirea cancerului hepatic
- Femeile cu boli hepatice grase au un risc cardiovascular mai mare - Hep
- Acest lucru din legume poate ajuta la combaterea bolilor hepatice grase