Subiecte
Abstract
Introducere
Luate împreună, aceste rezultate sugerează că inhibarea parțială a mai multor mediatori proinflamatori, inclusiv TNF-α și IL-17, pot juca un rol cheie în mecanismul de acțiune al apremilastului în tratamentul bolilor psoriazice. Extinderea unor seturi mai mari de biomarkeri proteici care leagă boala și efectul medicamentului va ajuta la organizarea următoarelor generații de terapii eficiente.
Rezultate
Abundența a 155 de proteine plasmatice, inclusiv chemokine și citokine, a fost măsurată prin imunoanalize sandwich Myriad RBM și analizate în spondilita anchilozantă, artrita psoriazică sau subiecții cu psoriazis care au participat la 3 studii clinice independente de fază III apremilast (POSTURE, ESTEEM2, PALACE1). Pe scurt, subiecții au fost selectați în mod aleator pentru a fi primit apremilast (20 mg sau 30 mg) sau placebo în primele 16 săptămâni ale studiilor respective și au fost evaluați pentru starea răspunsului în conformitate cu punctele finale pre-specificate. Pentru toate analizele post-hoc din prezentul studiu, brațele de 20 mg și 30 mg au fost combinate împreună (Tabelul 1). O multitudine de date RBM au fost colectate din plasma subiectului la fiecare vizită la momentul inițial, săptămâna 4 și săptămâna 16 (detalii în metode).
Descoperirea sistematică a biomarkerilor bolii
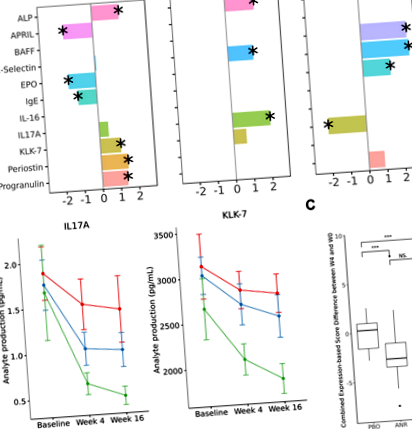
Ne-am propus să determinăm cei mai proeminenți biomarkeri ai proteinelor plasmatice de severitate a bolii, pentru fiecare boală. Regresia lazo cu regularizare L1 a fost aplicată pentru a selecta proteinele cu cel mai mare coeficient de corelație independent la severitate. Analizele au fost efectuate inițial la momentul inițial și au fost repetate pentru perioade de timp ulterioare pentru a estima soliditatea. Dintr-un panou de 122 de proteine plasmatice care au trecut QC, 10 au arătat diferite grade de corelație cu scorurile PASI la subiecții cu psoriazis. Când s-a făcut referință încrucișată cu puncte de timp ulterioare în care scorurile PASI s-au schimbat pentru unii indivizi, KLK-7 și IL-17A au rămas drept corelațiile cele mai consistente și robuste bazate pe mărimea efectului și direcționalitate (Fig. 1A). În timp ce IL-17A a fost un marker bine cunoscut, KLK-7 a reprezentat un biomarker plasmatic nou al psoriazisului. Au fost efectuate analize similare pentru subiecții cu spondilită anchilozantă și artrită psoriazică. LRG-1 a fost cel mai bine asociat cu scorul ASDAS la pacienții cu spondilită anchilozantă (Supliment Fig. 1). Nu s-a constatat că proteinele plasmatice consistente sunt corelate cu scorul DAS28 în cohorta de artrită psoriazică.
În urma explorării inițiale, am selectat analiți proeminenți pentru a înțelege relațiile IL-17A și KLK-7 în psoriazis și, respectiv, LRG-1 la subiecții cu spondilită anchilozantă. În cohorta de psoriazis, am confirmat că corelațiile cu scorurile PASI au fost independente de subiectele demografice prin analize de regresie univariate care controlează vârsta și sexul (Tabelul 2). Modificarea cantitativă a scorurilor PASI a urmărit bine cu magnitudinea modificării expresiilor analitelor, denumite corelații delta-deltă (tabelele suplimentare 1-3). Mai mult, efectul farmacodinamic al ambilor analiți a diferit semnificativ între grupurile placebo, apremilast responder și non-responder (Fig. 1B). În mod similar, în cohorta de spondilită anchilozantă, LRG-1 a fost confirmat a fi corelat semnificativ cu scorul ASDAS (Tabelul 3) și în analizele delta-delta (tabelele suplimentare 4-6), independent de vârstă și sex.
Analiza expresiei diferențiale (DE) între placebo și brațele de tratament la momente de timp specificate și meta-analiză în toate bolile. Proteinele DE semnificative sunt marcate. Ultimul rând „săptămâna 4 și săptămâna 16” denotă modelarea cu efect mixt pe date cumulate din cele două puncte de timp. Ultima coloană „Meta-analiză” denotă modelarea diferențială a expresiei pe date cumulate în toate cele trei boli.
Efecte Apremilast la fiecare moment
Am examinat apoi modelele biomarkerului temporal și general, care corespund efectului farmacodinamic apremilast și diferențelor de răspuns. Analizele de expresie diferențială au arătat foarte puțini analiți care erau puternic diferiți între placebo și apremilast atunci când se comparau săptămânile 4 și 16 separat (Fig. 2). Combinarea ambelor puncte de timp și modelarea prin modele cu efect mixt a crescut puterea de detectare în cadrul fiecărei boli. La subiecții cu psoriazis, AXL, CA-15-3 și SP-D au fost semnificativ subregulate de apremilast. De remarcat, AXL și stimulul său din amonte, IL-16 sunt cunoscute a fi implicate în reglementările Th1 16,17, Treg 18 și Th17 19. La subiecții cu artrită psoriazică, MPIF-1 (CCL23) a fost reglat în sus în brațul apremilast. MPIF-1 este o chemokină care induce migrația celulelor epiteliului reducând în același timp proliferarea celulelor progenitoare mieloide 20 și este produsă de neutrofile ca răspuns la agoniștii TLR și expresia TNF 21 .
Efect farmacodinamic Apremilast prin analize seriale de timp
Analizele diferențiale din secțiunea anterioară au elucidat cele mai robuste diferențe relative între grupuri la fiecare instantanee (individuale sau grupate). Rămân întrebări cu privire la direcționalitatea tendinței generale și rata de schimbare. Prin urmare, am căutat să surprindem modelele dinamice complete prin analize de serii temporale. Algoritmul CoGAPS 29, o metodă bazată pe factorul de matrice non-negativ al lanțului Markov Monte Carlo (MCMC NMF), a fost adaptat pentru a caracteriza tiparele de tranziție. Când s-au aplicat în comun cu PatternMarkers 30, analiții au fost atribuiți probabilistic fiecărui model prin calcularea distanței traiectoriei (vezi Metode).
Analizele de serii temporale utilizând date grupate pe boli au dus la 3 modele farmacodinamice apremilast (Fig. 3A, B). LRG-1 a fost asociat cu modelul roșu care a fost caracterizat printr-o tranziție diferențială de la 0 la 4 săptămâni între placebo și brațele apremilast. Mai exact, LRG-1 a scăzut în grupul placebo în primele 4 săptămâni, în timp ce apremilast a indus o creștere, subliniind în continuare că efectul LRG-1 indus de apremilast poate fi și mai nedorit față de placebo, având în vedere că biomarkerul sa deplasat spre direcția de marcare pentru mai rău. severitatea bolii. În schimb, celelalte două modele CoGAPS (verde și albastru) au captat o „lovitură” sau o reglare ascendentă a analiților din grupul placebo în primele 4 săptămâni, în timp ce apremilast a indus o reglare descendentă susținută la 16 săptămâni. În general, 37 de proteine au fost grupate în modelul albastru, în timp ce uPar a fost singurul în modelul verde. De remarcat, IL-17A și RAGE ale modelului albastru afișează cele mai robuste semnale, asociate în mod constant cu același model în analize separate pentru fiecare boală individuală (Fig. 3C, model D roșu pentru studiul psoriazisului, Fig. Suplimentară 5A, B model verde pentru spondilita anchilozantă și model albastru CD pentru studiu artritei psoriazice).
Discuţie
Descoperirile biomarkerului bolilor, împreună cu studiile farmacodinamice induse de medicamente, sunt esențiale pentru îmbunătățirea beneficiilor pacienților. Utilitățile acestor studii de cercetare legate sunt două falduri: selecția pacienților pentru medicina de precizie și traducerea înapoi în următoarea generație de terapii. Generarea de date și analizele ulterioare necesită eforturi comune din partea companiilor farmaceutice și a partenerilor tehnologici în cadrul unor studii clinice bine alimentate. În acest studiu, am demonstrat valorile legăturii dintre studiile biomarkerului centrate pe boală și cele medicamentoase prin metanalize în 3 studii de fază III apremilast de psoriazis, spondilită anchilozantă și artrită psoriazică. Analitele plasmatice au fost profilate la subiecții participanți pre și post-tratați, iar modelele de calcul au fost aplicate pentru a explora implicațiile asupra severității bolii, efectului apremilast și stării răspunsului clinic.
Revizuirea sistematică a literaturii KLK-7 și a fenotipurilor. Coloanele panourilor A și B sunt aliniate și etichetate în panoul B. (A) Cea mai înaltă clasă HPO părinte pentru fiecare fenotip care a apărut împreună cu KLK-7 în rezumatele Medline. Frecvența de asociere a KLK-7 cu anomalia tegumentului este a doua cea mai mare în spatele neoplasmului; (B) Scorul de specificitate pentru fiecare pereche unică genă-fenotip extrasă din rezumatele Medline pe baza co-apariției nivelului de propoziție a KLK-7 și a termenilor fenotip. Dimensiunea unui cerc indică rădăcina pătrată a numărului de publicații care acoperă o pereche genă-fenotip. Top 3 afecțiuni cu cea mai mare specificitate a tuturor bolilor legate de piele.
- Izolarea și caracterizarea nanocristalelor de celuloză din coaja de jackfruit Rapoarte științifice
- Icter pentru sugari Federația Rusă PDF PPT Rapoarte de caz Simptome Tratament
- Boala inflamatorie a intestinului Diareea de dimineață Cunoașteți simptomele, cauzele și prevenirea
- Servicii de Boli Infecțioase Spitalul General Tampa
- Efectele histologice și ultrastructurale ale cavitației induse de ultrasunete asupra adipozei pielii umane