Laboratorul de metabolizare moleculară, Universitatea Rockefeller, New York, NY 10065
Dana-Farber Cancer Institute și Departamentul de biologie celulară, Harvard Medical School, Boston, MA 02115
Abstract
Epidemia mondială de obezitate și diabetul de tip 2 a crescut foarte mult interesul pentru biologia și fiziologia țesuturilor adipoase. Celulele adipoase (grase) sunt specializate pentru stocarea energiei sub formă de trigliceride, însă cercetările din ultimele decenii au arătat că celulele adipoase joacă, de asemenea, un rol critic în detectarea și răspunsul la schimbările de echilibru energetic sistemic. Celulele grase albe secretă molecule importante de tip hormonal, cum ar fi leptina, adiponectina și adipsina, pentru a influența procesele precum consumul de alimente, sensibilitatea la insulină și secreția de insulină. Grăsimile brune, pe de altă parte, disipă energia chimică sub formă de căldură, apărându-se astfel împotriva hipotermiei, obezității și diabetului. Acum se apreciază că există două tipuri distincte de celule grase termogene, denumite adipocite maro și bej. În plus față de aceste proprietăți distincte ale celulelor adipoase, adipocitele există în țesutul adipos, unde se află în comunicare dinamică cu celulele imune și sunt strâns influențate de inervație și de aportul de sânge. Această revizuire este destinată să servească drept introducere în biologia celulelor adipoase și să familiarizeze cititorul cu modul în care aceste tipuri de celule joacă un rol în bolile metabolice și, probabil, ca ținte pentru dezvoltarea terapeutică.
INTRODUCERE
TIPURI DE GRASIME
Până de curând, termenul „grăsime brună” era folosit pentru a se referi la celulele UCP1 + în două locații anatomice distincte: 1) depozite formate în dezvoltare în regiunile interscapulare și perirenale, compuse în principal din adipocite UCP1 +, care au multe picături lipidice mici (denumite multiloculare) și mitocondrii dense, conferind țesutului culoarea maronie caracteristică; și 2) celulele UCP1 +, care sunt intercalate în multe depozite de grăsime albă, în special în regiunile subcutanate ale rozătoarelor și ale oamenilor. Aceste două tipuri de „grăsime brună” nu sunt doar tipuri de celule distincte (Wu și colab., 2012), dar provin și din linii celulare complet diferite (Seale și colab., 2008). Celulele grase brune formate în curs de dezvoltare, denumite acum „celule grase brune clasice”, derivă dintr-o linie asemănătoare mușchilor scheletici, așa cum este marcată de Myf5 sau Pax7 (Seale și colab., 2008; Lepper și Fan, 2010). Celulele bej sunt derivate, cel puțin parțial, dintr-o linie vasculară asemănătoare mușchiului neted, așa cum este marcat de promotorul Myh11 (Long și colab., 2014; Berry și colab., 2016).
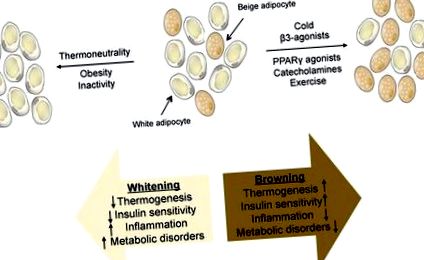
Majoritatea studiilor nu au făcut distincția între rolurile funcționale ale acestor două tipuri de celule grase UCP1 +, deoarece expunerea la frig sau stimularea β-adrenergică activează ambele tipuri de celule. Recent, a fost dezvoltat un model murin care nu are celule de grăsime bej, dar are grăsimi brune complet funcționale (Cohen și colab., 2014). Acești șoareci dezvoltă obezitate ușoară pe o dietă bogată în grăsimi, comparativ cu martorii. Mai mult, această obezitate apare exclusiv printr-un exces de grăsime subcutanată, o constatare destul de neobișnuită. Aceste animale au rezistență severă la insulină hepatică și steatoză hepatică, sugerând că grăsimea bej protejează ficatul; nu se cunoaște dacă acest lucru se produce prin oxidarea lipidelor circulante de către celulele bej sau prin producerea unui hormon secretat care protejează ficatul de acumularea de grăsimi. S-au identificat un număr tot mai mare de factori care duc la creșterea („rumenirea”) sau scăderea („albirea”) activității grăsimii bej (Figura 1).
FIGURA 1: Reprezentarea țesutului adipos bej, care constă dintr-un amestec de adipocite albe și bej. O schemă a stimulilor care duc la creșterea („rumenirea”) sau scăderea („albirea”) activității grăsimii bej, împreună cu consecințele fiziologice.
BIOLOGIA CELULARĂ A ȚESUTULUI ADIPOS
Țesutul adipos a fost odată văzut ca un depozit pasiv pentru acumularea de trigliceride în adipocite, dar acum este apreciat a fi un țesut complex care conține o serie de tipuri de celule care interacționează, inclusiv celule grase, celule imune, endoteliu, fibroblaste, neuroni și celule stem. Deși adipocitele reprezintă> 90% din volumul de grăsime, aceste alte tipuri de celule (denumite în mod colectiv fracția vasculară stromală), predomină prin numărul total (Kanneganti și Dixit, 2012). Se știe acum că mai multe subseturi de celule imune se acumulează în țesutul adipos și îndeplinesc funcții importante. Acest lucru poate fi urmărit înapoi la observația că țesutul adipos produce TNF-α și alte citokine proinflamatorii, cu niveluri crescute în condițiile obezității; acestea mediază rezistența la insulină locală și sistemică (Hotamisligil și colab., 1993). Aceste citokine sunt produse în mare măsură de macrofage din țesutul adipos (Weisberg și colab., 2003; Xu și colab., 2003). Histologic, macrofagele pot fi văzute în jurul adipocitelor în ceea ce au fost denumite „structuri asemănătoare coroanei” (Cinti și colab., 2005)
Fenotipurile țesutului adipos depind, de asemenea, de aportul de sânge și de inervație, deși reglementarea acestor procese a fost comparativ mai puțin studiată. Pe măsură ce masa de grăsime se extinde în contextul supranutriției, se poate dezvolta hipoxie locală, iar factorul de transcripție sensibil la oxigen factorul inductibil hipoxia 1α (HIF1α) poate deveni activ și colab., 2012). Studiile genetice și farmacologice arată că ștergerea sau inhibarea specifică adipoză a HIF-1α poate proteja împotriva disfuncției metabolice legate de obezitate (Jiang și colab., 2011; Soare. și colab., 2013). Datele indică, de asemenea, că țesutul adipos alb și maro poate produce factorul de creștere endotelial vascular A și alți factori pentru a spori aportul de sânge (Fredriksson și colab., 2000; Mick și colab., 2002). Țesutul adipos, în special grăsimea brună, este, de asemenea, foarte inervat cu fibre simpatice care stimulează lipoliza în condiții de post, administrare de leptină și expunere la frig (Bartness și colab., 2010a, b; Zeng și colab., 2015). În contrast, fibrele parasimpatice pot stimula acumularea de lipide (Kreier și colab., 2002). Adipocitele maro și bej exprimă ambele niveluri ridicate ale receptorului β3-adrenergic, iar activarea farmacologică de către CL 316,243 promovează termogeneza (Himms-Hagen și colab., 1994). Factorii care reglează inervația celulelor adipoase rămân o zonă de investigație activă.
ÎNTREBĂRI ȘI PERSPECTIVE RĂSPUNSURI PENTRU TERAPEUTICA UMANĂ
Direcționarea cu succes a țesutului adipos în beneficiul terapeutic va depinde de clarificarea suplimentară a mai multor întrebări cheie fără răspuns. În primul rând, care este completul complet al regulatorilor transcripționali care guvernează dezvoltarea și întreținerea grăsimii albe, maronii și bej? În al doilea rând, care este spectrul complet de fenotipuri ale fiecărui tip de adipocit? De exemplu, devine din ce în ce mai clar că grăsimile maro și bej fac mult mai mult decât generează căldură și pot fi organe endocrine importante (Kajimura și colab., 2015). În al treilea rând, cum semnalează diferite tipuri de celule adipoase către alte tipuri de celule și țesuturi și cum afectează aceste semnale metabolismul sistemic și susceptibilitatea la diabet, hipertensiune, boli cardiovasculare și cancer? În cele din urmă, regulatorii moleculari cheie ai țesutului adipos pot fi modulați pentru a crea un țesut adipos mai sănătos? Atingerea acestui obiectiv va necesita o înțelegere de bază a modului în care factori importanți precum PRDM16 sunt reglementați fiziologic (de exemplu, transcripțional, translațional, posttranslational).
În cele din urmă, orice discuție despre țesuturile adipoase ca țintă pentru terapeutica umană trebuie să se întoarcă la noțiunea de țesuturi adipoase ca cel mai sănătos loc pentru depunerea excesului de energie calorică (Unger și colab., 2013). Din genetică umană știm că orice inhibare a dezvoltării grăsimilor va provoca depunerea de lipide ectopice și boli grave (Savage și colab., 2003). Având în vedere acest lucru, care sunt potențialele ținte legate de țesuturile adipoase? În primul rând, în ceea ce privește grăsimea albă, am putea viza anomalii care leagă țesuturile adipoase de consecințele obezității, inclusiv diabetul, tulburările cardiovasculare și bolile hepatice grase. După cum sa menționat mai devreme, țesuturile adipoase din obezitate demonstrează aspecte ale inflamației, inclusiv secreția de citokine inflamatorii; neutralizarea citokinelor precum TNFα îmbunătățește rezistența la insulină la rozătoare (Hotamisligil și colab., 1994). În mod similar, s-a demonstrat că antagonismul protein kinazelor inflamatorii I-kappa-B kinază epsilon (IKKε) și a kinazei de legare TANK 1 (TBK1) îmbunătățește diabetul la șoareci (Reilly și colab., 2013). Provocarea viitoare va fi obținerea de beneficii terapeutice în diabetul sau bolile cardiovasculare fără a provoca toxicitatea asociată cu suprimarea generalizată a inflamației.
- Biologie - Poate supraviețui ceva mâncând pietre și alte minerale din pământ Worldbuilding Stack
- Bioinformatică și Biologie Computațională (BCB); Universitatea Saint Louis
- Biologie pentru nutriția copiilor
- Biologie pentru copii Mendel și moștenire
- Biologie - Ce este un uriaș; cu Diet Worldbuilding Stack Exchange