Gijs H K Berkelmans
1 Departamentul de Chirurgie, Spitalul Catharina, Eindhoven, Olanda
Bas J W Wilts
1 Departamentul de Chirurgie, Spitalul Catharina, Eindhoven, Olanda
Ewout A Kouwenhoven
2 Departamentul de chirurgie, grupul de spitale Twente, Almelo, Twente, Olanda
Koshi Kumagai
3 Divizia de Chirurgie, CLINTEC, Institutul Karolinska și Centrul pentru Boli Digestive, Spitalul Universitar Karolinska, Stockholm, Suedia
4 Departamentul de Chirurgie Gastroenterologică, Spitalul Institutului pentru Cancer, Fundația Japoneză pentru Cercetarea Cancerului, Tokyo, Japonia
Magnus Nilsson
3 Divizia de Chirurgie, CLINTEC, Institutul Karolinska și Centrul pentru Boli Digestive, Spitalul Universitar Karolinska, Stockholm, Suedia
Teus J Weijs
1 Departamentul de Chirurgie, Spitalul Catharina, Eindhoven, Olanda
Grard A P Nieuwenhuijzen
1 Departamentul de Chirurgie, Spitalul Catharina, Eindhoven, Olanda
Marc J van Det
2 Departamentul de chirurgie, grupul de spitale Twente, Almelo, Twente, Olanda
Misha D P Luyer
1 Departamentul de Chirurgie, Spitalul Catharina, Eindhoven, Olanda
Abstract
Introducere
Începerea timpurie a unei diete orale este sigură și benefică în majoritatea tipurilor de intervenții chirurgicale gastro-intestinale și este o parte crucială a protocoalelor de recuperare rapidă sau îmbunătățite. Cu toate acestea, fezabilitatea și siguranța administrării orale direct după esofagectomie rămân neclare. Scopul acestui studiu este de a investiga efectele inițierii timpurii versus întârzierea administrării orale asupra recuperării postoperatorii după esofagectomie.
Metode și analiză
Punctele tari și limitările acestui studiu
Un studiu deschis, controlat randomizat, multicentric.
Număr mare de participanți (n = 148).
Rezultatul raportat de pacient în ceea ce privește calitatea vieții și economia sănătății.
Protocolul postoperator din acest studiu ar putea să nu fie aplicabil altor spitale, având în vedere marea varietate de protocoale de îngrijire postoperatorie.
Sunt incluși numai pacienții supuși esofagectomiei minim invazive cu anastomoză intratoracică.
Introducere
Programele de recuperare îmbunătățită după intervenția chirurgicală (ERAS) sunt aplicate din ce în ce mai mult după esofagectomie, rezultând o durată redusă de ședere, morbiditate perioperatorie și taxe spitalicești. 1 Începerea timpurie a unei diete orale este o parte critică a protocoalelor ERAS și s-a dovedit a fi sigură și benefică în majoritatea tipurilor de intervenții chirurgicale gastro-intestinale. 2-6 Cu toate acestea, fezabilitatea și siguranța administrării orale direct după esofagectomie rămân neclare. 7
În cea mai mare parte, în prima săptămână postoperatorie se aplică un regim nul de gură și se plasează un tub nazojejunal sau jejunostomie pentru a ocoli anastomoza. 8 9 Se crede că acest lucru reduce incidența și severitatea pneumoniei postoperatorii și a scurgerilor anastomotice, deși nu a fost stabilită nicio relație de cauzalitate. Pe de altă parte, un tub nazojejunal sau jejunostomia pot provoca disconfort pacientului și sunt asociate cu complicații care pot împiedica recuperarea. 7 10
Nu se cunoaște cel mai bun moment pentru a începe administrarea orală după esofagectomie. O întârziere a inițierii dietei orale de 4 săptămâni după esofagectomie s-a dovedit a fi benefică în două studii de cohortă retrospective. 11 12 Ambele studii au constatat o reducere semnificativă a scurgerilor anastomotice cu o întârziere extinsă a nutriției orale după esofagectomie, comparativ cu un regim convențional de 5-7 zile nil-prin-gură. Cu toate acestea, aceste studii au fost expuse riscului de părtinire și extrapolarea acestor rezultate la situația clinică poate să nu fie valabilă. 11 12
Pe de altă parte, inițierea timpurie a nutriției orale s-a dovedit a fi fezabilă în multe tipuri de intervenții chirurgicale gastro-intestinale superioare. 4 13 În plus, un studiu de fezabilitate a sugerat că administrarea orală directă după esofagectomie este fezabilă și nu are ca rezultat o creștere a complicațiilor majore. 14 Complicațiile pulmonare nu au fost semnificativ diferite la pacienții care au fost hrăniți oral direct după operație, în comparație cu o cohortă istorică în care aportul oral a fost întârziat. Interesant este că aportul oral direct a dus chiar la mai puține complicații pulmonare postoperatorii. Rămâne neclar care este cea mai bună strategie pentru protocoalele de dietă postoperatorie în faza postoperatorie timpurie după esofagectomie.
Scopul acestui studiu este de a investiga efectele inițierii timpurii față de începutul întârziat al administrării orale asupra recuperării postoperatorii după esofagectomie.
Metode și analiză
Proiecta
Proiectarea acestui studiu este un studiu prospectiv controlat randomizat multicentric realizat la Spitalul Catharina Eindhoven și la Grupul de spitale Twente. Ambele spitale sunt situate în Olanda. Alte centre vor fi abordate pentru a crește rata de includere. Scopul acestui studiu de superioritate este de a investiga efectele inițierii timpurii versus începutul întârziat al administrării orale asupra recuperării funcționale postoperatorii după esofagectomie. Se așteaptă ca pacienții să fie incluși pe o perioadă de 2 ani. Pe baza unui studiu anterior, este de așteptat ca 80-90% dintre pacienții eligibili să poată fi incluși. Protocoalele perioperatorii sunt standardizate.
Populația de studiu
Pacienții supuși esofagectomiei elective minim invazive sau hibride (laparoscopie și toracotomie) pentru cancerul cu anastomoză intratoracică sunt eligibili pentru includere. Trebuie să aibă vârsta de cel puțin 18 ani. Criteriile de excludere sunt incapacitatea de administrare orală (anomalii anatomice congenitale sau traumatice), incapacitatea de a plasa o jejunostomie de hrănire, incapacitatea de a furniza consimțământul scris, tulburarea de înghițire, acalazia, starea de performanță Karnofsky 15% pierdere în greutate înainte de începerea intervenției chirurgicale. Anchetatorul și chirurgul responsabil verifică eligibilitatea. Pacientul va primi informații scrise și verbale despre acest proces în timpul unei întâlniri programate. Este oferit timp suficient pentru a întreba detalii despre acest proces.
Calculul dimensiunii eșantionului și analiza statistică
Calculul mărimii eșantionului se bazează pe recuperarea funcțională ca rezultat primar. Recuperarea funcțională este timpul până la recuperarea chirurgicală conform definiției descrise anterior. 15-17 Pe baza controalelor istorice, pacienții care au primit hrănire orală întârziată au fost cel puțin considerați ca fiind recuperați funcțional cu o medie de 12 zile postoperator. Pacienții care au fost hrăniți pe cale orală direct după esofagectomie au fost cel puțin recuperați funcțional în ziua 10 postoperator (medie). Folosind o putere de 80%, un α de 5% și o SD de 4 zile, au fost necesari un total de 128 de pacienți (64 de pacienți din fiecare grup) pentru a arăta această diferență. Se așteaptă ca rezultatul primar să nu fie împărțit în mod normal și, prin urmare, este necesară o incluziune suplimentară de 15%, necesitând un total de 148 de pacienți (74 de pacienți din fiecare grup). Un medic independent va efectua o analiză de siguranță în urma a 50 și 100 de pacienți. Se utilizează un principiu limită Haybittle-Peto în ceea ce privește scurgerile anastomotice, pneumonia (aspirația) sau mortalitatea.
Randomizare
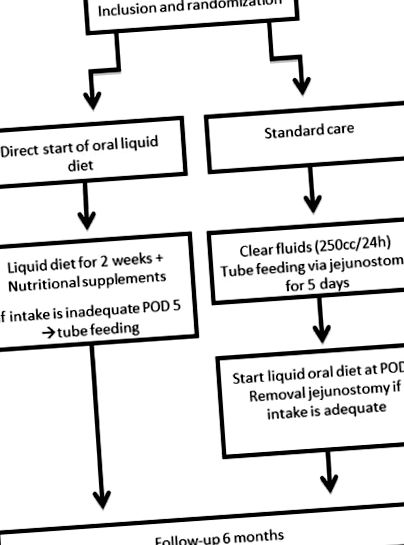
După obținerea consimțământului informat în scris, pacienții vor fi repartizați aleatoriu în una din cele două grupuri prin intermediul unui software de randomizare online (TENALEA Clinical Trial Data Management System). Acest program computerizat va genera o listă de randomizare. Se va utiliza un site de randomizare corespunzător care generează numărul de randomizare secvențială corespunzător listei de randomizare stratificată a randomizării unui pacient. Spitalul de incluziune și tratament și tipul de intervenție chirurgicală (hibrid/total minim invaziv) sunt criterii de stratificare în procesul de randomizare. Randomizarea va fi efectuată înainte de operație și după terapia neoadjuvantă (∼3 săptămâni înainte de operație). Rezultatul randomizării va fi comunicat la ambulatoriu, prin apel telefonic sau la internare (cu 1 zi înainte de operație). Diagrama de flux pentru participanții incluși în acest studiu este prezentată în figura 1 .
Diagrama de flux a protocolului de studiu. POD5, ziua 5 postoperator.
Procedura perioperatorie
Procedura nutrițională
Pacienții din grupul de dietă timpurie vor primi o dietă orală lichidă (supă, iaurt, terci, alimente solide lichefiate etc.) susținută de suplimente nutritive (hrană pentru înghițituri) direct postoperator până în ziua postoperatorie 14. Această dietă orală lichidă va fi extinsă treptat și o dietă solidă va începe la POD15.
Pacienții din grupul de control vor primi hrănirea standard a tubului după operație printr-o jejunostomie hrănitoare. Acești pacienți au voie să bea lichide limpezi de până la 250 cc/zi. După 5 zile, pacienții din grupul de control vor începe cu o dietă orală lichidă de la 2 săptămâni în urmă. În ziua 20 postoperatorie, se va începe o dietă solidă. Alimentarea cu sonda va fi oprită atunci când cel puțin 50% din nevoile zilnice sunt satisfăcute numai cu nutriție orală.
Un dietetician va calcula necesarul de energie pentru fiecare pacient folosind formula Harris-Benedict cu un surplus de 30% pentru cheltuielile de energie în faza postoperatorie. În zilele 2, 5 și 14 postoperatorii, au fost măsurate și calculate aportul caloric și aportul de proteine. Când pacienții din grupul de administrare orală timpurie nu au atins un aport> 50% din consumul de energie calculat în ziua 5 postoperatorie, se va începe alimentarea cu tub. Alimentarea cu tub poate fi inițiată prin jejunostomie prezentă la toți pacienții. Nu este inițiată hrănirea parenterală standard pentru a stabili începutul hrănirii enterale. În cazul în care hrana enterală nu este posibilă sau nu se dorește (de exemplu, din cauza unui chilotorax), se va începe hrănirea parenterală.
Rezultate
Parametrul principal al rezultatului este recuperarea funcțională (tabelul 1), definit ca pacienți postoperatori care nu conțin lichide intravenoase, au un control adecvat al durerii, restabilirea mobilității la un nivel independent, aport caloric suficient și nu prezintă semne de infecție activă. 15-17 Data recuperării funcționale este ziua în care sunt îndeplinite toate criteriile.
tabelul 1
Criterii funcționale de recuperare
| Controlul adecvat al durerii cu analgezie orală | Scara de evaluare numerică 19 Măsurările nutriționale ale amilazei de aport și de scurgere sunt atent monitorizate postoperator până la POD14. Starea nutrițională va fi măsurată folosind aportul caloric și proteic real față de aportul caloric și proteic necesar. |
Calitatea vieții și simptomele sunt punctate folosind chestionarul „Organizația Europeană pentru Cercetarea și Tratamentul Cancerului” (QLQ-C30/EORTC-OG25). 20 Aceste chestionare sunt instrumente fiabile și valabile pentru a investiga calitatea vieții la pacienții cu cancer esofagian. Pacienții sunt rugați să completeze acest chestionar online sau pe hârtie în timpul urmăririi regulate: la momentul inițial (5 săptămâni după tratamentul neoadjuvant) și la 6 săptămâni, 3 luni și 6 luni postoperator. Parametrii de rezultat pe termen lung, cum ar fi recurența locală, supraviețuirea globală și specifică cancerului, vor fi înregistrați prospectiv într-o bază de date.
Pneumonia este definită în funcție de Scorul Pneumoniei Uniforme. 21 Pneumonia prin aspirație este marcată separat, definită ca pneumonie după aspirarea clinică a salivei, a alimentelor lichide sau solide sau a vărsăturilor.
Sindromul de detresă respiratorie acută este definit conform definiției de la Berlin. 22
Scurgerile anastomotice sunt clasificate conform Low et al 23 și definite ca orice semn de scurgere a anastomozei esofagogastrice la endoscopie, reoperare, investigații radiografice, examinare postmortem sau când s-a găsit conținut gastro-intestinal în lichidul de scurgere. Tipul I este definit ca o scurgere tratată cu antibiotice intravenoase și un regim nul de gură. Tipul II este definit ca scurgere tratată prin reintervenții endoscopice sau radiologice. Tipul III este definit ca scurgere tratată cu o intervenție chirurgicală.
analize statistice
Toate analizele se vor face în conformitate cu abordarea intenției de a trata în care sunt incluși toți pacienții randomizați, indiferent de respectarea protocolului de studiu. Aparițiile punctelor finale primare și secundare au fost comparate între grupurile de tratament. Rezultatele sunt prezentate ca raporturi de risc cu IC corespunzătoare de 95%. Un p2 cu două cozi sau testul exact al lui Fisher dacă numărul de celule este 7
Hrănirea enterală timpurie după esofagectomie, comparativ cu hrana parenterală, restabilește funcția intestinală 9 și reduce rata complicațiilor care pun viața în pericol. 8 Practica obișnuită este o schemă nulă prin gură și plasarea unui cateter de jejunostomie în prima săptămână postoperatorie după esofagectomie. Cu toate acestea, hrănirea cu jejunostomie este asociată cu complicații minore, inclusiv infecție la locul de intrare, scurgere la locul de intrare și simptome ale tractului gastro-intestinal cu un risc mic de reoperare și mortalitate. 7 Acest lucru ar putea împiedica recuperarea funcțională, rezultând o ședere mai lungă la spital.
Un argument important pentru întârzierea administrării orale după o esofagectomie este reducerea sechelelor scurgerii anastomotice și reducerea riscului de pneumonie (prin aspirație). 11 12 Aceste două studii și-au bazat concluziile pe o analiză retrospectivă a datelor istorice ale pacienților. Din câte știm, niciun studiu prospectiv nu a comparat hrănirea orală timpurie cu hrănirea orală întârziată după esofagectomie.
Pe de altă parte, începutul timpuriu al administrării orale sa dovedit a fi benefic în programele ERAS în multe tipuri de intervenții chirurgicale gastro-intestinale, inclusiv în chirurgia gastro-intestinală superioară. Cu toate acestea, datele care includ pacienții care au suferit o esofagectomie sunt rare. Un studiu anterior de siguranță și fezabilitate efectuat de grupul nostru demonstrează că administrarea orală directă după esofagectomie este sigură și nu are ca rezultat o creștere a complicațiilor majore, cum ar fi pneumonia și scurgerea anastomotică (TJ Weijs, GHK Berkelmans, GAP Nieuwenhuijzen, și colab. 2016) ).
Ipotezăm că inițierea timpurie a dietei orale după o intervenție chirurgicală esofagiană poate îmbunătăți recuperarea funcțională cu o medie de 2 zile. Mai mult, posibilele beneficii viitoare includ un disconfort mai mic în alimentarea cu jejunostomie și potențialele sale complicații și calitatea vieții pot fi îmbunătățite prin începerea timpurie a aportului oral.
Note de subsol
Colaboratori: GHKB, TJW, MDPL, EAK și MJvD au proiectat studiul. GHKB și MDPL au scris propunerea consiliului etic. GHKB, BJWW, TJW, MDPL, EAK, MJvD, KK, MN și GAPN au contribuit la redactarea protocolului de studiu.
Interese concurente: Niciunul nu a declarat.
Aprobare etică: Formularele de consimțământ informat specifice site-ului, materialele de educație și recrutare ale acestui protocol sunt revizuite și aprobate (1 septembrie 2015) de Comitetele de etică pentru cercetare medicală (MEC-U).
Proveniență și evaluare inter pares: Nu este comandat; extern evaluat de colegi.
- Studiați protocolul efectelor diferențiale ale dietei și intervențiilor bazate pe activitatea fizică în timpul sarcinii
- Strategii nutriționale și de hrănire pentru a reduce la minimum pierderile de nutrienți din gunoiul de grajd de porc
- Studiați principiul nutrițional simplu din spatele oricărei pierderi de greutate de succes; Dietele; Călugăr modern de sănătate
- Starea nutrițională, cariile dentare și erupția dentară la copii, un studiu longitudinal în Cambodgia,
- Protocol nutrițional pentru osteoartroză (boală articulară degenerativă) Insight Medical Publishing