Abstract
În epilepsie, convulsiile și comorbiditățile (de exemplu, deficitele cognitive și depresia) apar atunci când sunt trecute praguri specifice. Aceste praguri depind de diateza (sau vulnerabilitatea) unui individ dat. Diateza este controlată de mai mulți factori genetici și de mediu. Diateza se modifică pe mai multe perioade de timp: zilnic și ca parte a proceselor de dezvoltare/îmbătrânire etc. Modelul de diateză - epilepsie introdus aici oferă un cadru conceptual pentru a înțelege modul în care evenimentele din trecut (de exemplu, un eveniment foarte stresant) pot influența direct apariția epilepsiei și a comorbidităților mai târziu în viață. Dovezile experimentale susțin acest model, iar existența biomarkerilor predictivi ai unei stări de vulnerabilitate au dus la dezvoltarea unor strategii terapeutice preventive. Modificările epigenetice ar putea fi un factor determinant cheie al diatezei. Rolul lor este discutat.
O criză este un tip de activitate endogenă pentru majoritatea rețelelor neuronale ale creierului. Tot ce trebuie este să oferiți rețelei un impuls suficient de greu. De exemplu, un șoc electroconvulsiv va declanșa o criză în orice creier uman „normal” (Luttges și McGaugh 1967). Indiferent dacă este forțată în țesutul „normal” sau apare spontan în rețelele „epileptice” cronice, dinamica convulsiilor cu debut focal pare să urmeze regulile universale din regiunile și speciile creierului (Jirsa et al. 2014). În special, convulsiile apar atunci când activitățile creierului traversează un anumit prag (Jirsa și colab. 2014). În țesutul „normal”, pragul este ridicat, iar convulsiile sunt mai greu de declanșat decât în epilepsia cronică (Bankstahl și colab. 2013). Se poate ipoteza astfel că pragul este redus în epilepsie (adică, probabilitatea de a avea o criză este crescută la pacienții cu epilepsie în comparație cu populația generală).
Apoi, întrebarea pe care trebuie să o abordăm este: Ce determină pragul la un individ dat? Multe epilepsii pot fi urmărite până la o insultă originală a creierului, cum ar fi o mutație genetică, stresul timpuriu al vieții, traume cerebrale, meningită etc. (Goldberg și Coulter 2013). Această insultă cerebrală va induce modificări ale circuitelor, care ar putea să scadă în cele din urmă pragul și să permită apariția convulsiilor spontane. Urmărirea mecanismelor care stau la baza modificării pragului este o sarcină foarte complexă, deoarece epilepsia este multifactorială, în sensul că o insultă dată nu va duce la un rezultat similar la doi indivizi. Cele mai bune exemple pot fi găsite în genetică umană. Mutațiile în formele familiale de epilepsie sunt caracterizate printr-o penetrare incompletă și prin diferite forme de epilepsie la membrii familiei care poartă aceeași mutație (Depienne et al. 2010; Scheffer 2011). La fel, insultele cerebrale, cum ar fi o leziune cerebrală traumatică sau convulsii febrile, cresc doar probabilitatea de a dezvolta epilepsie mai târziu în viață (adică nu toți indivizii afectați vor dezvolta crize spontane) (Bolkvadze și Pitkanen 2012; Choy et al. 2014).
Important, dacă o insultă cerebrală poate reduce pragul convulsivant, pragul poate fi, de asemenea, mărit. Dovada conceptului că un prag poate fi manipulat genetic a fost furnizată în modele experimentale de moarte subită în epilepsie (SUDEP) (Aiba 2015). În aceste modele, un val de despolarizare răspândită (SD) în trunchiul creierului duce la moarte. SD este, de asemenea, un tip de activitate endogen pentru majoritatea rețelelor cerebrale și se caracterizează printr-un prag (El Houssaini și colab. 2015). Acest prag poate fi ridicat printr-o manipulare genetică adecvată, crescând astfel durata de viață a modelelor SUDEP (Aiba 2015), dezvăluind în continuare natura poligenică a epilepsiei și consecințele acesteia.
Considerentele anterioare se învârt în jurul mutațiilor moștenite. Pentru a face lucrurile mai complexe, pot apărea mutații somatice în timpul dezvoltării embrionare (Poduri și colab. 2013), care afectează populații specifice de neuroni din anumite zone cerebrale. Aceste mutații ar putea fi ratate de analize genetice comune. În acest caz, de asemenea, mutațiile somatice ar putea duce la o stare patologică sau pot contrabalansa o mutație moștenită. Mutațiile somatice pot să nu fie un epifenomen, deoarece se crede că sunt frecvente în timpul diviziunii celulare, deși rezultatul lor funcțional nu este cunoscut (Frumkin și colab. 2005; Lynch 2010).
Aceste studii arată în mod direct că fundalul genetic poate influența direct pragul pentru activități patologice. Un alt factor determinant principal este mediul, care include istoria trecută a unui individ. Studiile de asociere/retrospective sugerează că mai mulți factori de risc cresc probabilitatea de a dezvolta epilepsie. De exemplu, un episod de depresie mai devreme în viață poate favoriza dezvoltarea epilepsiei (Hoppe și Elger 2011; Hesdorffer și colab. 2012). Prin urmare, experiența trecută a indivizilor îi poate determina să dezvolte epilepsie (Hoppe și Elger 2011; Hesdorffer și colab. 2012). Această problemă este foarte dificil de investigat clinic și experimental, deoarece evenimentele din trecut pot lăsa o amprentă în sistem fără a da naștere unui fenotip evident. Cu toate acestea, este un parametru la fel de important de luat în considerare ca și fundalul genetic.
Ce fel de urmă poate fi lăsată în rețelele neuronale de evenimentele de mediu? Candidații evidenți includ moartea celulară, inflamația cronică sau stresul oxidativ, care pot fi identificate relativ ușor. O schimbare mai subtilă, dar mai drastică în ceea ce privește consecințele funcționale, poate fi adusă prin reprogramarea epigenetică. În linii mari, epigenetica se referă la diferite moduri de a regla dinamic expresia genelor prin atingerea codului ADN.
Stresul este cel mai studiat eveniment în relație cu patologiile (McEwen 2013). Evenimentele stresante din trecut pot schimba peisajul epigenetic, inducând astfel o reorganizare funcțională a rețelelor (Klengel și Binder 2015). Există, de asemenea, un corp larg de literatură care leagă stresul, epilepsia și depresia. Dar aici, accentul va fi pus pe influența evenimentelor stresante din trecut care au avut loc înainte de epileptogeneză asupra dezvoltării ulterioare a epilepsiei și comorbidităților (Koutsogiannopoulos și colab. 2009; Lanteaume și colab. 2009) și rolul unei posibile reprogramări epigenetice.
INFLUENȚA EVENIMENTELOR STRESE PASSATE: DIATEZA - MODELUL DE EPILEPSIE
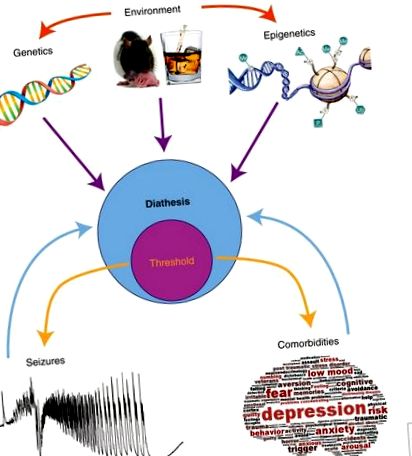
Diateza - modelul epilepsiei. Diateza este vulnerabilitatea unui individ, aici la convulsii și comorbidități (de exemplu, depresie și deficite cognitive). Vulnerabilitatea la epilepsie și comorbidități nu implică neapărat mecanisme similare, deși este probabil o discuție încrucișată. Convulsiile și comorbiditățile apar atunci când un anumit prag este trecut (pragul face parte din diateză, așa cum este determinat de acesta). Numeroși factori controlează diateza: fundalul nostru genetic, factorii de mediu și modificările epigenetice. Factorii de mediu ne pot schimba fondul genetic (de exemplu, mutații) și peisajul nostru epigenetic (de exemplu, îngrijirea maternă, expunerea la substanțe psihoactive). Epigenetica acoperă multiplele moduri de a schimba expresia genelor (de exemplu, schimbarea codului cozilor de histone, starea de metilare a ADN-ului etc.). Modificările epigenetice apar în mod natural în timpul ciclului de noapte/zi, îmbătrânire etc., dar și în urma provocărilor de mediu (de exemplu, stres intens). Scăderea pragurilor va crește probabilitatea apariției convulsiilor și comorbidităților. Odată ce acestea din urmă apar, acestea ar putea feedback negativ asupra diatezei, crescând în continuare vulnerabilitatea.
TESTAREA DIATEZEI - MODELUL DE EPILEPSIE
Folosind o procedură experimentală similară, a devenit posibilă testarea modelului de diateză - epilepsie (Becker et al. 2015). Șobolanii expuși înfrângerii sociale s-au separat în două grupuri de animale, vulnerabile și nevulnerabile, pe baza nivelurilor lor BDNF serice. Animalele vulnerabile au avut un prag mai mic pentru a atinge statusul epileptic și au accelerat considerabil epileptogeneza în comparație cu animalele nevulnerabile. Prin urmare, o istorie trecută, nerezolvată de stres, a schimbat diateza la unele animale, făcându-le mai susceptibile la dezvoltarea epilepsiei.
Făcând un pas mai departe, prezența deficitelor cognitive și a depresiei a fost evaluată la animalele cu convulsii spontane (Becker și colab. 2015). Un profil asemănător depresiei și deficite cognitive severe au fost găsite numai în populația vulnerabilă (cu niveluri serice scăzute de BDNF după prima lovitură). Foarte important, animalele expuse numai la status epilepticus nu au prezentat nici depresie, nici deficite cognitive odată epileptice. Acest lucru arată că, în aceste condiții experimentale, insulta cerebrală care a declanșat epileptogeneza (status epilepticus) a acționat ca un revelator al comorbidităților într-o populație vulnerabilă.
În cele din urmă, starea de vulnerabilitate la depresie ar putea fi inversată folosind un mimetic BDNF (Becker et al. 2015). Prin urmare, și aici, pragul poate fi manipulat în cealaltă direcție, pentru a reveni la nivelurile de diateză „normale”. Cu toate acestea, tratamentul nu a normalizat progresia epileptogenezei, sugerând că procesele biologice care controlează vulnerabilitatea la depresie și vulnerabilitatea la epilepsie nu sunt identice (Becker și colab. 2015).
Astfel, modelul de diateză - epilepsie oferă un cadru conceptual util pentru a înțelege de ce epilepsia și comorbiditățile asociate se dezvoltă numai la unii indivizi (deși aceasta este o posibilitate printre multe altele). Într-un astfel de model, pragul de convulsii și comorbidități poate fi inclus în diateză (Fig. 1). Identificarea potențialilor biomarkeri ai vulnerabilității (modelele serice BDNF și EEG) face posibile studii prospective la om. Cum putem explica o astfel de vulnerabilitate? Așa cum am menționat anterior, totul se reduce la genetica X factorii de mediu (în sensul lor cel mai larg). Epigenetica constituie o legătură utilă între genetică și mediu.
EPIGENETICA CA PROCES FIZIOLOGIC CHEIE
Definiția utilizată de Institutele Naționale de Sănătate (NIH) pentru Proiectul Epigenomică Foaie de parcurs este utilizată aici: „În sensul acestui program, epigenetica se referă atât la modificările ereditare ale activității genei, cât și ale expresiei (în descendența celulelor sau a indivizilor) și, de asemenea, modificări stabile, pe termen lung, ale potențialului transcripțional al unei celule care nu sunt neapărat ereditare ”(vezi www.roadmapepigenomics.org/overview). Practic, epigenetica poate include orice poate regla expresia genelor în mod independent pe secvențele genetice (de exemplu, metilarea ADN-ului, modificarea histonei și ARN-urile micro/lungi necodificate) (Kobow și Blumcke 2014). În cazul modificării histonei (ca exemplu), există numeroase enzime care pot transfera grupări acetil, grupări metil sau fosfor (printre altele) pe cozile histonice, care influențează transcrierea genei (Fig. 1). În plus față de aceste molecule de „scriere”, există „radiere”, care elimină aceste semnale de pe cozile de histone și, desigur, există „cititori”, care informează despre codul lăsat pe histone (Borrelli et al. 2008). Prin urmare, există mai multe enzime care pot schimba peisajul epigenetic și influența modul în care genele vor fi exprimate sau nu.
EPIGENETICA ÎN EPILEPSIE ȘI COMODITĂȚI
În secțiunea anterioară, epigenetica este considerată ca un fenomen care influențează toate cazurile vieții noastre, ca parte a unui proces normal programat dependent de timp. Dar, factorii de mediu pot lăsa și o urmă epigenetică profundă, afectând modul în care sunt exprimate genele. Unele fac, de asemenea, parte din viața noastră de zi cu zi, deoarece anumite procese de memorie și învățare depind de mecanisme epigenetice (Graff și Tsai 2013). Dar unii factori de mediu pot avea, de asemenea, consecințe dăunătoare prin reprogramarea epigenetică. Acest lucru a fost bine stabilit în timpul dezvoltării (Bale 2015). De exemplu, îngrijirea maternă (linsul/îngrijirea) joacă un rol cheie în determinarea sensibilității la stres, printr-un mecanism epigenetic, care rămâne stabil odată ce puii au ajuns la vârsta adultă, dar care pot fi inversate cu medicamente care modifică cromatina (Szyf 2009a, b ).
Epigenetica este un domeniu relativ nou, dar care se extinde rapid în epilepsie. Multe modificări epigenetice au fost deja identificate (Kobow și Blumcke 2014). Dar interpretarea acestora este o sarcină dificilă, deoarece schimbarea expresiei genelor și proteinelor cu epigenetică va crește dramatic numărul posibilităților de a construi celule și rețele funcționale și disfuncționale. În plus, nu există o separare clară între genetică și epigenetică, deoarece mutațiile asociate cu apariția epilepsiei pot implica factori epigenetici direcți/indirecți (de exemplu, ARX și MeCP2) (Amir și colab. 1999; Poeta și colab. 2013; Kobow și Blumcke 2014). Prin urmare, mecanismele epigenetice pot fi centrale în anumite forme de epilepsie moștenită sau patologii asociate cu epilepsia.
În formele dobândite de epilepsie, epigenetica ar putea juca, de asemenea, un rol cheie. Insulta cerebrală care declanșează epileptogeneza (de exemplu, starea epileptică sau leziunea traumatică a creierului) poate modifica peisajul epigenetic, poate modifica diateza și pragul inferior de convulsii (Fig. 2). Numeroase gene sunt reglate în sus sau în jos în urma unei insulte cerebrale și în regiunile epileptogene cronice (Becker și colab. 2002; Gorter și colab. 2006). Mecanismele epigenetice pot sta la baza acestor schimbări în expresia genelor (Qureshi și Mehler 2010). Un exemplu tipic este BDNF, care este reglat în epilepsie printr-o metilare scăzută a ADN-ului Bdnf (Ryley Parrish și colab. 2013). Într-un astfel de context de modificări ample la nivel de epigenom, nu este surprinzător să găsim agenți modificatori ai cromatinei printre medicamentele antiepileptice. De exemplu, acidul valproic are mai multe moduri de acțiune, inclusiv acțiunea sa ca inhibitor al histonei deacetilazei (Monti și colab. 2009).
În cele din urmă, pentru a face lucrurile și mai complexe, epilepsia se caracterizează prin modificări dependente de timp în urma insultei cerebrale inițiale (inclusiv mutații moștenite) care a dus la epilepsie. Unele mecanisme epigenetice găsite într-o anumită perioadă de timp pot să nu fie valabile în alte momente de timp. Un aspect cheie al epigeneticii este natura sa dinamică, care apare în mod natural de la dezvoltarea creierului până la îmbătrânire (Fig. 2).
EPIGENETICA ȘI DIATEZA - MODELUL DE EPILEPSIE
Epigenetica oferă un cadru util pentru a studia impactul evenimentelor din trecut asupra dezvoltării epilepsiei și a comorbidităților sale. Evenimentele din trecut (de exemplu, situații stresante [Becker și colab. 2015] și expunerea la medicamente psihoactive în timpul dezvoltării [Silva și colab. 2013]), ar fi putut lăsa o urmă epigenetică, insuficientă pentru a produce un fenotip de la sine, dar creșterea diatezei, făcând acești indivizi mai vulnerabili (aducându-i, de fapt, aproape de prag). Apariția unei insulte cerebrale ar acționa astfel ca un factor declanșator și ar permite dezvoltarea epilepsiei și/sau comorbidităților. Este probabil ca diateza să se schimbe constant în ambele direcții în funcție de diferite evenimente pozitive/negative ale vieții (Fig. 2). Dar diateza rămâne un factor determinant cheie pentru dezvoltarea epilepsiei și comorbidităților, care apar la unii indivizi și nu la alții în funcție de fondul lor genetic și de peisajul epigenomic la un moment dat dat.
Poate că cea mai bună, deși speculativă, ilustrare a acestui concept (și a complexității sale) este faptul că convulsiile arată un model circadian în TLE mezial și modele experimentale (Quigg et al. 1998). Deoarece pragul de convulsii este, de asemenea, reglementat într-o manieră circadiană într-o manieră dependentă de BMAL1 (Gerstner et al. 2014), se poate propune, ca ipoteză de lucru, că mecanismele epigenetico-circadiene normale pe lângă modificările aduse de experiențele de viață din trecut și insultele cerebrale proepileptogene, aduc rețelele neuronale aproape de pragul de convulsii în anumite momente de timp din timpul ciclului de noapte și de zi. Astfel, diateza este probabil reglementată pe mai multe scale de timp (Fig. 2).
CONCLUZII FINALE
Fundalul nostru genetic este un factor determinant al vulnerabilității noastre la epilepsie și comorbidități. Un astfel de fundal poate fi „reglat fin” prin mecanisme epigenetice. Acestea din urmă sunt procese fiziologice care schimbă peisajul proteic pe mai multe perioade de timp (ore până la decenii), schimbându-ne astfel constant diateza și pragul în epilepsie și comorbidități. Factorii de mediu ne pot modula dinamic diateza, fără a afecta neapărat pragul (adică ar acționa ca factori de amorsare). Ar putea fi necesare alte accesări pentru a afecta pragul. Este important să rețineți că pragurile pentru epilepsii și comorbidități pot fi diferite, implicând mecanisme subiacente distincte, deși este de așteptat o anumită intersecție. Desigur, convulsiile și comorbiditățile se pot retroalimenta asupra diatezei și a pragului (de obicei, crescând și mai mult vulnerabilitatea). De asemenea, este important să rețineți că diateza poate fi, de asemenea, redusă (în mod natural cu experiențe de viață pozitive sau farmacologic). În concluzie, convulsiile și comorbiditățile apar într-un mediu neuronal în continuă schimbare (dinamic), în funcție critic de experiențele din trecut, care ar trebui luate în considerare pentru a înțelege originea lor și a planifica viitoarele strategii terapeutice.
MULȚUMIRI
Autorul recunoaște INSERM și al șaptelea program-cadru al Uniunii Europene (FP7/2007-2013) în temeiul acordului de subvenționare nr. 602102 (EPITARGET), și Dr. P. P. Quilichini pentru ajutorul ei cu manuscrisul și cifrele.
- Testarea validității alimentelor „cu calorii negative” cu un model de reptile
- Performanța texturală a ingredientelor proteice din lapte reticulate sau cu calciu redus în model
- Impactul pierderii în greutate induse de dietă asupra biomarkerilor pentru cancerul colorectal Un studiu exploratoriu
- Impactul obezității copilăriei asupra articulațiilor în creștere - Ortopedie Tuckahoe
- Impactul cofeinei asupra dispoziției, funcției cognitive, performanței și hidratării o revizuire a beneficiilor