Departamentele de anatomie și
Departamentele de anatomie și
Departamentele de anatomie și
Departamentele de anatomie și
Neurologie, Case Western Reserve University, Facultatea de Medicină, Cleveland, Ohio 44106
Abstract
Factorul-1 inductibil al hipoxiei (HIF-1) este un factor de transcripție care reglează răspunsurile adaptative la lipsa de oxigen din celulele mamiferelor. HIF-1 constă din două proteine, HIF-1α și HIF-1β. HIF-1α se acumulează în condiții hipoxice, în timp ce HIF-1β este exprimat constitutiv. Expresia HIF-1α și HIF-1β au fost măsurate în timpul adaptării la hipoxie hipobarică (0,5 atm) în cortexul cerebral de șobolan. Analizele Western blot au indicat faptul că HIF-1α s-a acumulat rapid în timpul debutului hipoxiei și nu a scăzut timp de 14 zile, dar a scăzut la normal cu 21 de zile, în ciuda tensiunii arteriale scăzute continue de oxigen. Imunomarcarea a arătat că neuronii, astrocitele, celulele ependimale și posibil celulele endoteliale au fost tipurile de celule care exprimă HIF-1α. Genele cu elemente sensibile la hipoxie au fost activate în aceste condiții, dovadă fiind factorul de creștere endotelial vascular crescut și nivelurile de ARNm transportor de glucoză-1. Când șobolanii adaptați de 21 de zile au fost expuși la o provocare hipoxică mai severă (8% oxigen), HIF-1α s-a acumulat din nou. Pe baza acestor rezultate, speculăm că remodelarea vasculară și modificările metabolice declanșate în timpul hipoxiei prelungite sunt capabile să restabilească nivelurile normale de oxigen tisular.
expunerea la un mediu cu conținut scăzut de oxigen declanșează mai multe mecanisme adaptative imediate și pe termen lung. La nivel sistemic, acestea includ hiperventilația și policitemia, care îmbunătățesc livrarea oxigenului către organele critice, cum ar fi creierul (15, 20). Cu toate acestea, aceste mecanisme compensatorii nu sunt suficiente pentru a satisface cererea de oxigen a sistemului nervos central, în special în timpul expunerii prelungite la hipoxie. Creierul prezintă o remarcabilă capacitate de răspuns structural și metabolic la hipoxia prelungită. Unul dintre cele mai dramatice răspunsuri structurale este remodelarea considerabilă a rețelei microvasculare cerebrale. Studiile anterioare au arătat că 3 săptămâni de expunere la hipoxie hipobarică au determinat o creștere semnificativă a densității microvaselului în tot creierul (2, 9, 15,19). Această plasticitate structurală este, de asemenea, însoțită de adaptarea metabolică la tensiunea scăzută a oxigenului. De exemplu, creșterea transportului glucozei (7), creșterea ratei metabolice cerebrale a glucozei (10) și a activității citocrom oxidazei (4.14) au fost raportate în creierul șobolanilor după 3 săptămâni de expunere la hipoxie hipobarică.
În timpul expunerii prelungite la hipoxie, HIF-1α trebuie exprimat atâta timp cât echilibrul dintre aportul de oxigen și utilizarea în țesut nu a fost atins. Rezultatele noastre au arătat că nivelurile de HIF-1α revin la valorile normoxice după 3 săptămâni de hipoxie, sugerând că remodelarea vasculară cerebrală și modificările metabolice au fost capabile să compenseze hipoxia țesutului cerebral.
Expunerea la hipoxie cronică.
Șobolanii masculi Wistar cu vârsta de 2-3 luni au fost păstrați până la 3 săptămâni în camere hipobarice menținute la o presiune de 380 Torr (0,5 atm, echivalent cu 10% oxigen normobaric). În grupuri păstrate timp de> 1 zi, camerele au fost deschise 30 de minute în fiecare zi pentru curățarea coliviei și alimentarea cu alimente și apă. Durata hipoxiei a fost de 6 ore, 12 ore sau 1, 4, 7, 14 sau 21 de zile. Fiecare grup experimental de șobolani a avut propriul grup de control al coechipierului, care a fost ținut în afara camerelor hipobarice, dar în aceeași locație. Un grup de șobolani păstrați timp de 21 de zile în camera hipobarică a fost în continuare expus fie la 10%, fie la 8% oxigen normobaric timp de 4 ore imediat după ce a fost îndepărtat din camera hipobarică. Probele de sânge venos din coadă au fost obținute pentru determinarea hematocritului înainte ca șobolanii să fie uciși.
Analiza Western blot.
După expunerea hipoxică, șobolanii experimentali și de control au fost uciși, iar creierul lor a fost îndepărtat rapid și înghețat în azot lichid. Probele corticale au fost disecate și omogenizate în tampon rece cu gheață (20 mM HEPES, pH 7,5, 1,5 mM MgCl2, 0,2 mM EDTA, 0,1 M NaCl) suplimentat cu 0,2 mM ditiotreitol, 0,5 mM vanadat de sodiu și inhibitori de protează (0,4 mM fluorură de fenilmetilsulfonil și 2 μg/ml fiecare de leupeptină, pepstatin și aprotinin). Ulterior, s-a adăugat NaCI la o concentrație finală de 0,45 M, iar omogenatul a fost centrifugat la 10.000 g timp de 30 min. Supernatantele au fost colectate și amestecate cu un volum egal de tampon de omogenizare conținând 40% (vol/vol) glicerol înainte de a fi depozitate la -80 ° C. Probele (total de 200 μg de lizat) au fost supuse electroforezei în gel de poliacrilamidă SDS-7% și transferate în membranele de nitroceluloză prin proceduri standard.
Membranele au fost blocate cu lapte praf degresat 5% și incubate timp de 2 ore la temperatura camerei cu următorii anticorpi: anti-HIF-1α monoclonal (1: 500, Novus Biologicals, Littleton, CO), anti-HIF-1β policlonal (1: 1.000, Novus Biologicals) și anti-VEGF policlonal (1: 400, Santa Cruz Biotech, Palo Alto, CA). Aceasta a fost urmată de incubare cu anticorpi secundari conjugați cu peroxidază de hrean și detectare îmbunătățită a chemiluminescenței (ECL, Amersham, Piscataway, NJ). Extractele nucleare brute ale celulelor Hepa 1 (American Type Culture Collection, CRL-1830) expuse la 1% sau 20% oxigen au fost utilizate ca martori pozitivi (30 μg de proteine) în analizele Western blot. Concentrațiile de proteine au fost determinate prin testul proteinei Bradford (Bio-Rad).
Extracția ARN și analiza Northern blot.
ARN-ul total a fost extras din cortexul cerebral folosind sistemul de izolare a ARNgentilor (Promega, Madison, WI) conform instrucțiunilor producătorului. Eșantioane egale (10 μg) de ARN total au fost electroforezate în 1% geluri de agaroză-formaldehidă, transferate în membrane de nailon (Millipore, Bedford, MA), reticulate cu ultraviolete și hibridizate cu sonde primare aleatorii. Bloturile au fost hibridizate cu soluție Quickhyb (Stratagene, La Jolla, CA) și spălate în 0,2 × citrat de sodiu salin, 0,1% SDS la 55 ° C. Sondele VEGF și GLUT-1 au fost achiziționate de la Research Genetics (numerele de acces GenBank AA154722 și respectiv AA451073), iar sonda oligonucleotidică pentru ARN 18S a fost obținută de la Life Technologies (Rockville, MD).
Imunohistochimie HIF-1α.
Șobolanii normoxici și hipoxici (4 și 21 de zile de hipoxie) au fost profund anesteziați cu Nembutal și perfuzați intracardic cu soluție salină tamponată cu fosfat rece cu gheață (pH 7,4) urmată de paraformaldehidă tamponată cu fosfat 4%. Creierele au fost îndepărtate și postfixate în paraformaldehidă 2% timp de 24 de ore și încorporate în parafină. Secțiunile seriale (6 μm) au fost tăiate pe un microtom, montate pe lamele acoperite cu gelatină, uscate la aer și depozitate la temperatura camerei până când au fost procesate pentru imunohistochimie. Pentru a identifica unele dintre celulele care exprimă HIF-1α, s-a efectuat o imunomarcare dublă utilizând doi markeri celulari, antigen specific nucleului neuronal (NeuN) și proteină acidă fibrilară glială (GFAP). Pe scurt, secțiunile au fost deparafinizate, hidratate și supuse recuperării antigenului la 90 ° C timp de 25 de minute folosind soluția Target de recuperare (Dako, Carpinteria, CA), conform instrucțiunilor producătorului. Anticorpul monoclonal de șoarece împotriva HIF-1α (1: 200, Novus Biologicals) a fost detectat prin utilizarea unui sistem de streptavidină-biotină-hrean peroxidază (sistem de amplificare a semnalului catalizat, Dako). Anti-GFAP monoclonal (1: 500, Sigma Chemical) și anti-NeuN (1: 500, Chemicon, Temecula, CA) au fost detectate folosind anticorpi secundari Texas roșu și, respectiv, fluorescenți conjugați (Vector, Burlingame, CA).
analize statistice.
Datele sunt raportate ca mijloace ± SD. Pentru a calcula abundența relativă de ARN, densitățile optice ale VEGF și GLUT-1 au fost normalizate în raport cu semnalul ARN 18S. Valorile normalizate au fost apoi mediate pentru cele două pete replicate preparate dintr-un singur set de probe de ARN. Valorile densitometriei obținute pentru imunoblotii HIF-1α, HIF-1β și VEGF au fost utilizate pentru a calcula creșterea procentuală față de valorile normoxice ale aceluiași gel. Un singur eșantion t-testul a fost utilizat pentru a determina dacă raporturile hipoxice-control ale densităților proteinelor au fost semnificativ mai mari de 1. Comparațiile raporturilor ARN și proteine în diferite momente de timp au fost evaluate de ANOVA cu corecția lui Tukey (procedura ONEWAY, SPSS v8.0). În toate cazurile,P 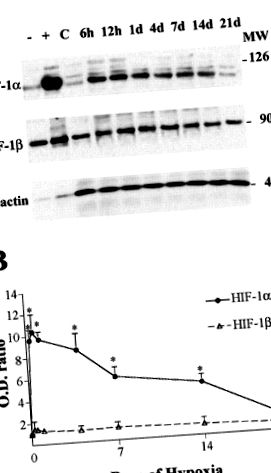
FIG. 1.A: Analiza Western blot a factorului inductibil de hipoxie (HIF) -1α, HIF-1β și β-actină (controlul încărcării) în cortexul cerebral al șobolanilor expuși la normoxic (C) și hipoxic [6 ore până la 21 zile (d)] condiții. Extractele nucleare brute de celule Hepa 1 expuse la 20% (-) și 1% (+) oxigen au fost utilizate ca martori negativi și, respectiv, pozitivi pentru imunoblotii HIF-1α. Indicat ladreapta sunt pozițiile standardelor de greutate moleculară (MW).B: raporturile densității optice (OD) HIF-1α (●) și HIF-1β (▵) în raport cu valorile de control. Valorile sunt medii ± SD din 3 experimente (n = 3 pe punct de timp; *P
Inducția HIF-1α ca răspuns la hipoxia incrementală după adaptare.
În experimentul anterior, am arătat că HIF-1α nu se mai acumulează în creierul șobolanilor expuși timp de 21 de zile la hipoxie hipobarică. Revenirea HIF-1α la nivelurile inițiale s-ar putea datora restaurării cu succes a tensiunii oxigenului în țesut. Pentru a exclude posibilitatea ca o afectare a mecanismului responsabil de acumularea HIF-1α să împiedice apariția acestuia, unii șobolani au fost expuși fie la 10%, fie la 8% oxigen normobaric (n = 3 fiecare grup) timp de 4 ore imediat după ce a fost ținut timp de 21 de zile în hipoxie hipobarică. După cum era de așteptat, după 21 de zile de expunere la hipoxie, nivelurile de HIF-1α au fost similare cu valorile martor. Expunerea suplimentară timp de 4 h până la 10% oxigen normobaric nu a produs modificări în expresia HIF-1α. Cu toate acestea, expunerea la oxigen de 8% a fost însoțită de o creștere de șase ori a densității HIF-1α comparativ cu lizatele corticale expuse la hipoxie de 21 de zile (Fig.2). Aceste rezultate indică faptul că a fost atins un nou echilibru între livrarea de oxigen și consum după 3 săptămâni de expunere la hipoxie, dar că un stimul hipoxic suplimentar a fost încă capabil să provoace acumularea de HIF-1α.
FIG. 2.Răspunsul HIF-1α în cortexul creierului la hipoxie incrementală după adaptare. Șobolanii expuși la hipoxie hipobarică timp de 21 de zile (21d,n = 6) au fost ulterior expuse la 10% (n = 3) sau 8% (n = 3) oxigen normobaric timp de 4 ore (21d + 10%, 21d + 8%). Sunt prezentate, de asemenea, probe de normoxie (C) și hipoxie de 4 zile (4d). Extractul nuclear al celulelor Hepa 1 expuse la 1% O2 a fost utilizat ca control pozitiv (+).
Genele țintă HIF-1.
De asemenea, am analizat activarea a două gene țintă HIF-1 din aval: VEGF și GLUT-1. Prin analize Northern blot, am reușit să detectăm transcripții unice pentru VEGF (4,5 kb) și GLUT-1 (4,8 kb). Ambele transcrieri au urmat modele similare de reglare ascendentă tranzitorie prin hipoxie cronică (Fig. 3A), prezentând o creștere de trei până la patru ori la 12 ore, 1 zi și 4 zile de expunere la hipoxie. După aceea, ambele transcrieri au început să scadă. La 21 de zile de hipoxie, ambele transcrieri au revenit la niveluri aproape normale. În plus, am evaluat și nivelurile de proteine VEGF. A fost detectată o singură bandă la 23 kDa care corespunde probabil monomerului VEGF164. Nivelurile de proteină VEGF au fost, de asemenea, induse în mod tranzitoriu, dar reglarea sa a fost întârziată. O creștere semnificativă a proteinei VEGF a fost detectată numai după 24 de ore de hipoxie și a rămas crescută până la 14 zile. Ca și în cazul mARN-ului său, nivelul proteinei VEGF a scăzut, de asemenea, până la nivelul de control la 21 de zile (Fig.3B).
FIG. 3.A: Analiza Northern blot a factorului de creștere endotelial vascular (VEGF) și a nivelului de mARN al transportorului de glucoză-1 (GLUT-1) al probelor corticale cerebrale de șobolani expuși la normoxie (C) și hipoxie hipobarică (6 ore până la 21 de zile). Bloturile care conțin 10 μg de ARN total au fost hibridizate cu 32 de sonde ADNc marcate cu P specifice pentru VEGF și GLUT-1. Același blot a fost hibridizat cu sonda ARN 18S ca control de încărcare. B: analiza imunoblot a nivelurilor de proteine VEGF și β-actină în cortexul cerebral al șobolanilor expuși la hipoxie normoxică (C) și hipobarică.
Imunolocalizarea HIF-1α în creier.
FIG. 4.Localizarea imunohistochimică a HIF-1α în creierul de șobolan normoxic și hipoxic. A: Colorare negativă HIF-1α în secțiuni cerebrale normoxice. B: Imunoreactivitate HIF-1α într-o secțiune hipoxică a creierului care prezintă colorare nucleară intensă (× 100). C: mărire mai mare (× 400) a unei secțiuni cerebrale hipoxice la nivelul stratului IV din cortex. Colorarea pozitivă este asociată cu nuclei de formă rotundă, probabil corespund nucleelor neuronale sau gliale.D: Imunoreactivitatea HIF-1α asociată cu nuclee plate în jurul capilarelor și vaselor mici (vârfuri de săgeți), care ar putea corespunde nucleelor celulelor endoteliale. De asemenea, sunt prezentate colorarea pozitivă a pialului (E) și imunocolorarea pozitivă a HIF-1α a epiteliului (F) celulele plexului coroidian și celulele ependimale care căptușesc ventriculii laterali ai creierului hipoxic. Bare de scară, 50 μm, A și B sunt la × 100,C-F sunt la × 400.
FIG. 5.Imunocolorare dublă pentru HIF-1α și antigenul nuclear neuronal NeuN (A și B) și HIF-1α și proteină acidă fibrilară glială (GFAP; C și D) la nivelul straturilor IV și V ale cortexului somatosenzorial al șobolanilor expuși la hipoxie hipobarică timp de 4 zile. Vârfuri de săgeată în A șiB indicați nuclei mari, rotunziți pozitivi pentru HIF-1α care se colocalizează cu NeuN. Mai puțin abundenți, nuclei mici imunorați cu anti-HIF-1α colocalizați cu GFAP (vârfuri de săgeată în C șiD). Bara de scalare, 50 μm.
Factorul de transcripție HIF-1 a fost identificat ca o componentă critică a răspunsului celular și sistemic la hipoxie la mamifere (22). Acesta mediază expresia dependentă de oxigen a genelor țintă care codifică eritropoietina, transportorii de glucoză, enzimele glicolitice și VEGF, printre altele (3). Produsele acestor gene sunt implicate în reglarea răspunsurilor adaptative hipoxice, cum ar fi eritropoieza, modificările metabolismului energetic și angiogeneza.
Am studiat expresia HIF-1α în creierul șobolanului în timpul adaptării la hipoxie cronică. În condiții normoxice, am găsit niveluri scăzute de proteină HIF-1α prin analiza Western blot, niveluri care nu au fost detectabile de imunohistochimia mai puțin sensibilă. Observațiile noastre sunt în acord cu studiile anterioare care au raportat expresia bazală a HIF-1α și activitatea transcripțională a HIF-1 în creierul rozătorului (1, 26), liniile celulare ale neuroblastomului uman (6) și neuronii corticali murini purificați (6).
Prezentul studiu a arătat că proteina HIF-1α se acumulează semnificativ în creierul șobolanului în timpul hipoxiei hipobarice. Imunomarcarea a arătat că diferite tipuri de celule cerebrale, inclusiv neuroni, astrocite, celule endoteliale și celule ependimale, exprimă HIF-1α, sugerând o hipoxie tisulară generalizată (cel puțin după 4 zile de hipoxie) fără heterogenitate celulară sau regională.
Nivelurile HIF-1α au scăzut progresiv în timpul hipoxiei prelungite, dar au rămas semnificativ crescute timp de cel puțin 14 zile și au revenit aproape de momentul inițial cu 21 zile. Expunerea acută la 8%, dar nu 10% oxigen normobaric la animale adaptate la hipoxie hipobarică timp de 3 săptămâni a dus la acumularea reînnoită a HIF-1α. În concordanță cu scenariul conform căruia acumularea HIF-1α în timpul hipoxiei duce la activarea transcripțională a genelor țintă HIF-1, am găsit o reglare ascendentă a transcrierilor GLUT-1 și VEGF care sunt paralele cu răspunsul HIF-1α. Această observație este în acord cu studiile anterioare care arată o reglare inversă reversibilă a expresiei VEGF și GLUT-1 în creierul șoarecilor și șobolanilor expuși la hipoxie hipobarică (8, 13, 27).
Cu toate acestea, este posibil ca transcrierea și traducerea ARNm-ului HIF-1α la 21 de zile să fie cumva reduse, ducând la o lipsă de acumulare a HIF-1α. Această posibilitate a fost exclusă constatând că, atunci când un stimul hipoxic suplimentar a fost plasat pe țesutul adaptat la hipoxie, HIF-1α s-a acumulat, indicând capacitatea continuă a țesutului de a răspunde la prezența unei tensiuni scăzute a oxigenului tisular. Mai mult, acest lucru a arătat că nivelurile de HIF-1α din creier sunt reglementate de semnale care raportează țesutul, mai degrabă decât deficiența de oxigen sistemică sau ambientală.
Această lucrare a fost susținută parțial de subvențiile Institutelor Naționale de Sănătate NS-37111, NS-38632 și HL-56470.
NOTĂ DE PICIOASĂ
Adresa pentru cereri de reimprimare și alte corespondențe: J. C. LaManna, Dept. of Neurology (BRB), Case Western Reserve Univ., School of Medicine, 10900 Euclid Ave., Cleveland OH 44106–4938 (E-mail: [email protected] cwru. edu).
- Retailerul cu reduceri sportive Decathlon revine în America, dar este binevenit - The Outdoor Journal
- Răspunsul glicemic și rezumatul sănătății unui atelier The American Journal of Clinical Nutrition
- Stimularea electrică a nervului măduvei spinării pentru durerea de spate cronică
- Cadrul de optimizare a topologiei pilonului motorului bazat pe criteriile de performanță și stres Jurnalul AIAA
- Envy Naturals Keto Chinese Diet Pill Shop Ghid de recenzii - ARK JOURNAL
