Krestinina Olga
1 Institutul de Biofizică Teoretică și Experimentală, Academia Rusă de Științe, Pușchino, 142290 regiunea Moscovei, Rusia; ur.relbmar@luyb
Baburina Yulia
1 Institutul de Biofizică Teoretică și Experimentală, Academia Rusă de Științe, Pușchino, 142290 regiunea Moscovei, Rusia; ur.relbmar@luyb
Papadopoulos Vassilios
2 Departamentul de Farmacologie și Științe Farmaceutice, Școala de Farmacie, Universitatea din California de Sud, Los Angeles, CA 90089, SUA; ude.csu@podapapv
Abstract
2 ′, 3′-nucleotidă ciclică-3′-fosfodiesterază (CNPază) este o enzimă asociată mielinei care catalizează hidroliza fosfodiesterică a 2 ’, 3’-nucleotide ciclice la 2’-nucleotide. Cu toate acestea, prezența sa se găsește și în celulele nemelinizate și în alte structuri celulare. Înțelegerea funcțiilor sale fiziologice specifice, în special în celulele nemelinizate, este încă incompletă. Această revizuire se concentrează pe rolul CNPazei mitocondriale (mtCNPază), independent de mielină. mtCNPase este capabil să regleze funcționarea porului de tranziție a permeabilității mitocondriale (mPTP) și, prin urmare, este implicat în mecanismele morții celulare, atât apoptoză, cât și necroză. Participarea sa la dezvoltarea diferitelor boli și condiții patologice, cum ar fi îmbătrânirea, bolile de inimă și dependența de alcool, este, de asemenea, revizuită. Ca atare, mtCNPase poate fi considerată ca o țintă potențială pentru dezvoltarea strategiilor terapeutice în tratamentul bolilor legate de mitocondrie.
1. Introducere
În sistemul nervos central al mamiferelor și al unor vertebrate, este prezentă abundent o enzimă asociată cu mielina 2 ′, 3′-nucleotidă ciclică 3′-fosfodiesterază (CNPază, EC3.1.4.37). Se știe că CNPaza este capabilă să catalizeze hidroliza nucleotidelor 2 ’, 3’-ciclice pentru a produce 2’-nucleotide in vitro [1], dar substratul fiziologic in vivo este încă neclar. În plus, s-a raportat că enzima a fost prezentă într-o varietate de alte tipuri de celule, deși la niveluri inferioare [2,3] și în preparatele cu membrană non-mielină din splină, ficat, timus, glandele suprarenale, rinichi, inimă și mușchi scheletic [4,5,6]. S-a observat că CNPaza este asociată cu mitocondriile din celulele suprarenale [7].
2. Detectarea mtCNPase
Reprezentarea schematică a detectării mtCNPase în mitocondrii.
3. Parteneri de interacțiune ai mtCNPase
Dyer și co-autori au arătat că CNPaza a localizat împreună cu citoscheletele pe bază de actină și pe bază de tubulină în oligodendrocite cultivate. [21]. Mai târziu, De Angelis și Braun au descoperit că CNPaza s-a legat de fapt de citoscheletul pe bază de actină [23]. Dovezile biochimice suplimentare ale interacțiunii CNPază-tubulină au fost obținute din observația că microtubulii din celulele tiroidiene de șobolan cultivate s-au disociat de membrana plasmatică după tratamentul cu lovastatină, un compus care inhibă izoprenilarea. Deoarece funcția tubulinei nu necesită izoprenilare, acest lucru a sugerat că o proteină linker izoprenilată trebuie să fie responsabilă pentru atașarea la membranele microtubulilor. O astfel de proteină izoprenilată cu o greutate moleculară de 48 kDa a fost identificată ulterior ca CNPază [24]. S-a constatat, de asemenea, că CNPaza nu este asociată numai cu microtubuli în celulele tiroidiene de șobolan cultivate și țesutul cerebral, ci și co-purificată cu microtubuli chiar și după cicluri succesive de polimerizare și depolimerizare. Astfel, CNPaza a fost identificată ca o proteină asociată cu microtubuli care are și activitate de polimerizare a microtubulilor in vitro [25].
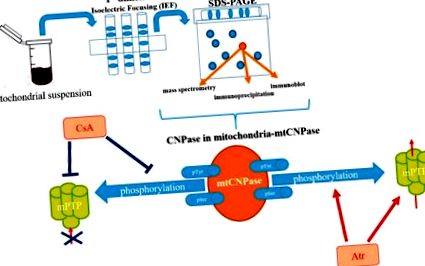
S-a raportat că mtCNPase este asociată în mod specific cu ADAP1, o proteină specifică creierului (cunoscută recent ca p42 IP4 sau Centaurin-α1) și α-tubulină în RBM [26]. Interesant, în mitocondrii, asocierile ADAP1 cu mtCNPase, ADAP1 cu α-tubulină și mtCNPase cu α-tubulină, au fost confirmate prin experimente de co-imunoprecipitare [26]. Co-imunoprecipitarea poate fi luată ca o indicație a interacțiunilor in vivo între proteinele respective. Important, s-a dezvăluit că imunoprecipitatul ADAP1 din RBM conținea benzi imuno-reactive atât pentru anticorpii mtCNPase, cât și pentru α-tubulină. Benzile imuno-reactive nu au fost observate la imunoprecipitații obținuți cu anticorpi control izoformi CNPază pe bază de mielină. Specificitatea co-imunoprecipitării ADAP1 cu α-tubulină și mtCNPază a fost confirmată prin imunocolorare cu anticorp ANT. Astfel, se poate deduce formarea unui complex in vivo între ADAP1, mtCNPase și α-tubulină în RBM. Implicarea ADAP1 și mtCNPase în deschiderea mPTP indusă de Ca 2+ a fost demonstrată independent în mitocondriile izolate din diferite celule [16,26]. Prin urmare, este de mare interes să înțelegem care sunt consecințele funcționale pentru complexul care conține ADAP1, mtCNPază și α-tubulină formată in vivo în RBM.
S-a raportat că mtCNPase este localizată atât la nivelul membranelor mitocondriale interne cât și externe, plasându-l în mod eficient între ele (Figura 2) [16]. Această constatare ne-a determinat să căutăm proteine care interacționează cu mtCNPase în cadrul siturilor de contact, unde se află complexul mPTP. ANT și canalul anion dependent de tensiune (VDAC) au fost considerate anterior a fi componente ale complexului mPTP. Cu toate acestea, studiile genetice au sugerat că compoziția mPTP nu necesită VDAC și ANT [27,28], totuși VDAC și ANT sunt încă considerate a fi regulatori/modulatori ai mPTP [29,30,31]. Cu toate acestea, ciclofilina D (CyP-D) este o proteină matricială mitocondrială considerată ca fiind unul dintre elementele critice pentru funcționarea mPTP [32]. S-a arătat că mtCNPase a co-precipitat cu regulatori de bază mPTP, cum ar fi CyP-D, VDAC și ANT [33]. Găsirea faptului că mtCNPase co-localizat cu CyP-D, ANT și VDAC, precum și cu α-tubulină în mitocondriile încărcate și descărcate cu Ca 2+, indică posibila legare fizică între aceste proteine în mitocondrii.
Reprezentarea schematică a rolului mtCNPase în funcția mPTP.
În membrana mitocondrială externă, mtCNPase poate interacționa cu VDAC, care este proteina principală a membranei externe implicată în permeabilitatea membranei mitocondriale exterioare. VDAC poate fi în stare deschisă sau închisă. În starea închisă VDAC, canalul său este mai permeabil la Ca 2+ [34], astfel încât ar putea rezulta accelerarea deschiderii mPTP, iar legarea α-tubulinei la VDAC facilitează închiderea acestuia [35]. Deoarece atât VDAC cât și mtCNPase sunt legate de α-tubulină, conductanța VDAC ar putea fi reglată direct de mtCNPază sau prin legarea α-tubulinei, permițând modularea permeabilității membranei exterioare.
Asocierea mtCNPase cu complexele I, V, III și II din RBM încărcat cu Ca 2+ a arătat că mtCNPase ar putea exista într-o formă liberă și ar putea fi eliberată din mitocondrii împreună cu citocromul c și alți factori apoptotici. Deschiderea mPTP a facilitat eliberarea mtCNPase din RBM, similar cu eliberarea citocromului c, AIF și Endo G. În plus, în condiții de supraîncărcare cu Ca 2+, 2 ′, 3′-cAMP favorizează eliberarea reglată în sus a mtCNPase, AIF și Endo G, deși nu a modificat eliberarea citocromului c. Corelația dintre eliberarea mtCNPase și AIF și Endo G indică o posibilă legătură a mtCNPase cu calea apoptozei independentă de caspază [33].
4. Implicarea mtCNPase în reglementarea deschiderii mPTP induse de Ca 2+
tabelul 1
Influența eliminării CNPase asupra parametrilor funcționali mitocondriali la deschiderea mPTP indusă de Ca 2+.
| Genul mai sălbatic | 1,00 ± 0,11 | 1,00 ± 0,06 | 1,00 ± 0,14 |
| SiRNA amestecat | 0,97 ± 0,10 | 0,85 ± 0,08 | 0,98 ± 0,05 |
| CNPase siARN | 0,87 ± 0,13 | 0,66 ± 0,09 ** | 0,68 ± 0,11 * |
* Ratele de influx p 2+ au fost observate în mitocondriile izolate din diferite tipuri de celule. Cu toate acestea, capacitatea redusă de Ca 2+ (aproximativ 30%) și faza de întârziere (aproximativ 40%) s-au găsit pentru mitocondriile knop-down CNPase [16]. Astfel, nivelul proteinei mtCNPase din mitocondrii pare a fi important pentru reglarea dezvoltării mPTP indusă de Ca 2+.
CNPaza hidrolizează nucleotidele 2 ’, 3’-ciclice la monofosfații lor corespunzători [1]. Influența substraturilor CNPase, 2 ′, 3′-nucleotide ciclice, asupra funcției mitocondriale a fost, de asemenea, raportată de noi [16]. 2 ′, 3′-cAMP și 2 ′, 3′-cNADP au îmbunătățit semnificativ deschiderea indusă de Ca 2+ a mPTP. Acest efect a fost observat cu transportul Ca 2+, disiparea potențialului membranei și umflarea RBM. Ambele substraturi CNPase au reușit să reducă faza de întârziere și să crească rata de ieșire de Ca 2+ din RBM sub deschiderea mPTP indusă de Ca 2+ [16]. Activitatea enzimatică a mtCNPase a fost redusă sub deschiderea mPTP indusă de Ca 2+ și a fost prevenită hidroliza nucleotidelor 2 ’, 3’-ciclice [16]. În consecință, eficacitatea acțiunilor 2 ′, 3′-cAMP și 2 ′, 3′-cNADP asupra stimulării deschiderii mPTP prin inducția Ca 2+ în bucla de feedback a fost crescută (Figura 2). Prin urmare, s-a propus că, în celulele vii, inhibarea activității mtCNPase sub deschiderea mPTP indusă de Ca 2+ în mitocondrii contribuie la creșterea nivelurilor de nucleotide 2 ′, 3 ′-ciclice. Astfel, substraturile CNPase, cum ar fi 2 ′, 3′-cAMP, par să funcționeze ca al doilea mesager prin promovarea deschiderii mPTP mitocondriale [16].
5. CNPase în patologie și îmbătrânire
5.1. CNPase în patologie și îmbătrânire
Creșterea deficitelor cognitive, care poate fi asociată cu vulnerabilitatea fibrelor nervoase de mielină, apare odată cu îmbătrânirea normală. Se știe, de asemenea, că, odată cu îmbătrânirea creierului, apar modificări dependente de vârstă în proteinele cheie ale mielinei, inclusiv CNPaza. Acest lucru duce, în special, la afectarea funcției cognitive [50]. Pierderea fibrelor nervoase și modificările structurii mielinei duc la conducerea ineficientă a semnalelor neuronale în timpul îmbătrânirii. CNPaza, una dintre cele mai frecvente proteine de mielină, poate juca un rol important în menținerea integrității mielinei și a axonului cu vârsta [51].
Discuția anterioară s-a referit doar la participarea CNPazei asociate cu mielina în mecanismele care stau la baza îmbătrânirii și a patologiilor sistemului nervos central. Cu toate acestea, în ultimii ani au apărut numeroase studii care arată că CNPaza prezentă în țesuturile și celulele nemelinizate joacă, de asemenea, roluri importante în patogeneza diferitelor boli, în special prin intermediul mitocondriilor, care este discutată în secțiunea următoare.
5.2. mtCNPase în îmbătrânire
Rolul CNPazei în mitocondrii în timpul îmbătrânirii.
5.3. CNPase și Cancer
După cum sa menționat anterior, CNPaza este implicată în dezvoltarea inflamației în celulele neuronale [45], iar infecțiile cronice și inflamația sunt considerate un factor de risc pentru dezvoltarea cancerului [57]. Pe de altă parte, mtCNPase participă la funcționarea mPTP și, prin urmare, se presupune că joacă un rol în apoptoză [16]; prin urmare, ar fi interesant să evaluăm ce rol joacă această proteină în dezvoltarea diferitelor tumori.
Într-un alt studiu, s-a observat expresia crescută a CNPazei în celulele HL-60 de leucemie mieloidă acută în prezența acidului retinoic, un agent utilizat în terapia acestui tip de cancer [61]. Mai mult, s-a găsit o corelație cu expresia scăzută a altor proteine care sunt componente ale membranelor mitocondriale și regulatori ai mPTP, VDAC și proteinei translocatoare (TSPO) [61]. S-a raportat că TSPO crește în diferite tipuri de tumori, inclusiv tumori cerebrale și glioame [63,64,65]. Alte rapoarte sugerează un rol cheie pentru TSPO în dezvoltarea tumorilor canceroase [63,66,67,68]. Corelația observată între nivelurile de expresie ale mtCNPase și TSPO sugerează un mecanism comun în carcinogeneză.
5.4. mtCNPase și insuficiență cardiacă acută
Deoarece mitocondriile sunt cel mai important organit pentru funcționarea normală a inimii, întreruperea stării funcționale a mitocondriilor este o cauză frecventă pentru dezvoltarea tulburărilor sistemului cardiovascular [71]. Producția de ATP, menținerea homeostaziei Ca 2+ și permeabilitatea membranelor mitocondriale atât interne cât și externe sunt cele mai importante caracteristici ale funcției mitocondriale; prin urmare, tulburările din aceste procese ar putea duce la patologii. Astfel, s-a observat o aberație în sinteza ATP în mitocondrii, mediată de modificările transportului calciului, în bolile cardiace metabolice. S-a observat scăderea producției de ATP și depozit retractil în miocard în bolile cardiace metabolice [72]. Ca 2+ mitocondrială este, de asemenea, esențială pentru producerea ROS și funcționarea mPTP. În procesele de ischemie/reperfuzie și insuficiență cardiacă, acești factori sunt implicați [73,74,75].
Moartea celulară după astfel de tulburări datorate mecanismelor mitocondriale intrinseci de ucidere, necroză și apoptoză, stă la baza unei serii de boli cardiace [76]. Prin reglarea permeabilității membranelor sale, mitocondriile controlează moartea celulelor miocardice necrotice și apoptotice [77]. Astfel, permeabilizarea membranelor exterioare de către proteinele din familia Bcl-2 și reglarea mPTP a permeabilității membranei interioare pot fi considerate ca un eveniment central în necroză și apoptoză [77]. Rolul mPTP în mai multe boli cardiovasculare a fost larg discutat [78,79,80,81,82]. Dovezile sugerează că mPTP participă la căile de semnalizare cardioprotectoare, fie direct, fie indirect. Astfel, mPTP a devenit o țintă de medicamente promițătoare în abordările terapeutice. Cu toate acestea, în ciuda multor ani de cercetare, complexitatea procesului a împiedicat cercetătorii, iar identitatea moleculară și mecanismul de reglare a mPTP în inimă sunt încă neclare.
În plus, a fost investigat efectul astaxantinei (AST) asupra parametrilor funcției mitocondriale. AST, ca antioxidant, are proprietăți și potențial antiinflamator ca agent terapeutic pentru multe boli de inimă. AST este un carotenoid xantofil, un pigment roșu, care conferă animalelor marine, precum somonul, păstrăvul, creveții obișnuiți și homarul, colorarea lor roșiatică distinctă [92]. Există plante, alge și microorganisme care conțin o concentrație mare de astfel de carotenoizi, care sunt destul de omniprezente. Oamenii nu le pot sintetiza și, prin urmare, li se cere să le furnizeze în alimentația lor [93]. AST conține două grupuri oxigenate pe două structuri inelare, ceea ce determină abilitățile sale antioxidante sporite [94]. Într-un model de cardiotoxicitate indusă de homocisteină, AST a reușit să restabilească integritatea mitocondriilor și să inhibe apoptoza mediată de mitocondrie [95,96]. Adăugarea de AST a împiedicat deschiderea mPTP și, astfel, a îmbunătățit funcția mitocondrială și a redus sensibilitatea mitocondriilor la stres.
S-a propus că mtCNPase îndeplinește o funcție de protecție și poate fi o țintă pentru efectul AST în RHM. Această ipoteză va fi verificată în experimentele de administrare cronică de AST pe șobolani cu insuficiență cardiacă acută în viitor. Cu toate acestea, AST poate fi considerat un medicament eficient pentru îmbunătățirea funcției cardiace în condiții normale și patologice și ținta sa moleculară pare să fie mtCNPase. Figura 4 rezumă rolul mtCNPase în dezvoltarea insuficienței cardiace acute.
- Activitatea 2 ′, 3 ′ - Nucleotidă ciclică 3 ′ - Fosfodiesterază în țesuturi de șobolan - Weissbarth - 1982 -
- Coconul broastei fosforiale Cyclorana australis funcționează în principal ca o barieră împotriva apei
- Cele mai bune beneficii și funcții pentru antrenamentul exercițiului pentru cvadriceps
- Puterea afirmațiilor pozitive vă poate schimba viața
- Reducerea în greutate și beneficii cardiovasculare