Teresa C. Delgado
1 Grup intermediar de metabolizare, Centrul pentru Neuroștiințe și Biologie Celulară din Coimbra, Coimbra, Portugalia
Abstract
Reglementarea apetitului: de la periferie la hipotalamus
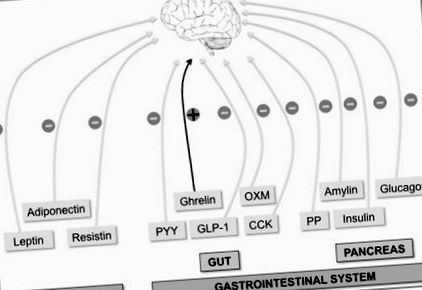
Creierul integrează mai multe semnale periferice pentru a controla apetitul. Factorii periferici indicativi ai stării energiei pe termen lung a întregului corp sunt produși de țesutul adipos (leptină, adiponectină și rezistină). Pe de altă parte, semnalul acut orexigenic (+) de grelină (produs în intestin) și semnalele anorexigenice (-), cum ar fi hormonii intestinali peptida YY (PYY), oxyntomodulin (OXM), glucagon-like peptide-1 (GLP-1 ) și colecistokinina (CCK), iar hormonii pancreatici [insulină, glucagon, amilină și polipeptidă pancreatică (PP)] indică starea energetică pe termen lung.
Studiile care utilizează fie leziuni discrete în hipotalamus (15, 16), fie tranziție chirurgicală (17) ale căilor neuronale au arătat că integrarea centrală a semnalelor derivate periferice are loc mai ales în hipotalamus. Hipotalamusul se află lângă trei organe circumventriculare, care sunt zone care permit substanțelor să părăsească creierul fără a perturba bariera hematoencefalică (BBB), permițând astfel altor substanțe care nu traversează BBB să își exercite acțiunile în creier (18) . În ultimii ani, au fost identificați mai mulți neurotransmițători implicați în reglarea apetitului hipotalamic [a se vedea, de exemplu, recenziile (19–, 22)]. Experimentul de piatră de temelie pentru identificarea unui potențial neurotransmițător constă în injectarea agentului respectiv în hipotalamus sau în ventriculul adiacent al modelelor animale și detectarea unei creșteri sau scăderi rapide a aportului de alimente. Aceste experimente au permis nu numai identificarea și caracterizarea mai multor neurotransmițători implicați în reglarea apetitului hipotalamic, ci și urmărirea precisă a căilor care conțin aceste molecule de semnal. De obicei, neurotransmițătorii sunt clasificați în peptide, aminoacizi și monoamine.
Neurotransmisia hipotalamică peptidergică și reglarea apetitului
În nucleul arcuit al hipotalamusului, două seturi de populații neuronale care exprimă fie neuropeptide orexigenice [Neuropeptidă Y (NPY) și peptidă asociată Agouti (AgRP)], fie neuropeptide anorexigenice [Pro-opiomelanocortină (POMC) și amfetamină legată de cocaină (CART) )] coexista. Neuropeptida Y este sintetizată în neuroni situați în aspectul ventromedial îndepărtat al nucleului arcuat hipotalamic. În cadrul hipotalamusului, fibrele care exprimă NPY proiectează de la nucleul arcuat la nucleul paraventricular, unde peptida este eliberată (23). Astfel, administrarea NPY la nucleul paraventricular hipotalamic are ca rezultat o creștere robustă și susținută a aportului de alimente la rozătoare (24), ducând în cele din urmă la obezitate atunci când este administrată în mod repetat (25). Pe de altă parte, blocarea mediată de anticorpi a acțiunii NPY are ca rezultat reducerea consumului de alimente la animalele înfometate (26). Deoarece populațiile neuronale care exprimă NPY sunt co-localizate cu neuroni care eliberează AgRP, stimularea optogenetică (27) sau farmaco-genetică (28) a neuronilor care exprimă AgRP determină, de asemenea, aportul intens de alimente, în timp ce ablația genetică (29, 30) sau farmaco-genetică inhibiția (28) scade consumul de alimente.
Neuronii localizați în principal în subdiviziunea ventrolaterală a nucleului arcuat hipotalamic conțin atât peptida anorexigenă CART, cât și precursorul acesteia, POMC. Stimularea optogenetică a neuronilor care conțin POMC reduce aportul de alimente (27), în timp ce ablația genetică a celulelor care exprimă POMC (31, 32) mărește pofta de mâncare și consumul de alimente. Gena care codifică POMC dă naștere la produse peptidice din aval, inclusiv melanocortine [hormonul adrenocorticotrop (ACTH), hormonii de stimulare a α-, β- și γ-melanocite (MSH) și β-endorfină (33). Eliberarea peptidei α-MSH la nucleul hipotalamic paraventricular reduce potențial aportul de alimente prin activarea receptorilor de melanocortină, MC3R și MC4R. Dimpotrivă, aportul crescut de alimente și obezitatea sunt văzute ca urmare a ștergerii MC3R (34) și MC4R (35). Pe scurt, activarea neuronilor care exprimă POMC în nucleul arcuat hipotalamic declanșează eliberarea de α-MSH, care activează MC4R la nucleul paraventricular, ducând la suprimarea consumului de alimente și la creșterea cheltuielilor de energie. Pe de altă parte, stimularea neuronilor care exprimă AgRP în nucleul arcuat hipotalamic eliberează peptida AgRP, care antagonizează efectul α-MSH asupra MC4R, crescând astfel aportul de alimente.
Până în prezent, cele mai multe eforturi au fost depuse pentru examinarea reglării directe a neuronilor hipotalamici NPY/AgRP și POMC/CART prin diferiți factori circulanți, în timp ce rolul intrărilor neuronale din amonte a primit o atenție comparativ mai mică. Acest lucru este surprinzător având în vedere că atât neuronii NPY/AgRP, cât și neuronii POMC/CART primesc un aport sinaptic excitator și inhibitor abundent. Cei doi neurotransmițători care reprezintă cea mai mare parte a activității sinaptice din hipotalamus sunt aminoacizii glutamat și acidul γ-aminobutiric (GABA).
Neurotransmisie hipotalamică glutamatergică
Metabolismul glutamat neuronal-astrocitar
Glutamatul este neurotransmițătorul excitator dominant în sistemul nervos central. Pentru ca un neuron să elibereze glutamat, neurotransmițătorul trebuie mai întâi ambalat la concentrații mari în vezicule sinaptice, prin intermediul transportorilor de glutamat vezicular specific (VGLUT1, VGLUT2 și VGLUT3) (36). După stimulare, glutamatul este eliberat în fanta sinaptică pentru a se lega și a provoca efectele sale asupra receptorilor postsinaptici, indiferent dacă [N-metil-d-partat (NMDA) ionotrop, d, 1-alfa-amino-3-hidroxi-5-metil- acidul isoxazol propionic (AMPA), acidul kainic] sau receptorii metabotropici (mGluRs), prezenți atât în neuroni, cât și în astrocite.
Glutamatul în reglarea apetitului
Pentru a evalua rolul intrării glutamatergice în neuronii care exprimă NPY/AgRP și POMC/CART și, mai precis, plasticitatea sa, astfel cum este reglementată de receptorii glutamat NMDA, Liu și colab. șoareci generați lipsiți de receptori NMDA pe neuronii AgRP sau POMC (56). Autorii au descoperit că receptorii NMDA pe neuronii AgRP, dar nu pe neuronii care exprimă POMC, joacă un rol critic în controlul echilibrului energetic, indicând faptul că activarea indusă de post a neuronilor care eliberează AgRP este asociată cu o creștere semnificativă a intrării glutamatergice (56). Mai mult, prin combinarea tehnicilor electrofiziologice, farmacologice și optogenetice specifice tipului de celulă, Yang și colab. a constatat că lipsa alimentelor ridică aportul sinaptic excitator. Potrivit acestor autori, grelina derivată din intestin acționează asupra receptorilor presinaptici pentru a crește eliberarea glutamatului și a activa neuronii care exprimă NPY/AgRP prin receptorii ionotropi de glutamat (57).
Neurotransmisia GABAergică hipotalamică
Metabolismul neuronal-astrocitar GABAergic
GABA în reglarea apetitului
Un rol stimulator pentru GABA în reglarea comportamentului alimentar controlat hipotalamic a fost evident în ultimii ani. Administrarea intracerebroventriculară a agonistului receptorului GABAA, muscimol, stimulează hrănirea la porci saturați, un răspuns blocabil de către antagonistul specific al receptorului GABAA, bicuculina (68). De asemenea, administrarea sistemică și intracerebroventriculară a agonistului receptorului GABAB, baclofen, determină o creștere a aportului de alimente la porcii sățioși (69). Mai mult, aportul crescut de alimente obținut după administrarea baclofenului poate fi abolit prin pretratarea cu antagonistul receptorului GABAB, phaclofen (69). De acord, mai multe dovezi indică faptul că neuronii din nucleul arcuit hipotalamic exprimă în mare măsură transportorul GABA, VGAT (70, 71), precum și enzimele de sintetizare GABA, GAD65 și GAD67 (70). Folosind imunohistochimia, imunoreactivitățile GAD65/GAD67 și GABA au fost demonstrate în majoritatea neuronilor NPY/AgRP situați în nucleul arcuat hipotalamic (70, 71). Pe de altă parte, în ciuda prezenței ARNm GAD65/GAD67 a fost demonstrată la aproximativ o treime din neuronii care exprimă POMC (72), VGAT nu a fost detectat în corpurile celulare POMC hipotalamice (53) sugerând absența eliberării POMC GABA neuroni.
Acțiuni glutamat și GABA asupra mecanismului de cuplare metabolică neuronal-astrocitară care stă la baza reglementării apetitului hipotalamic
Până în prezent, acțiunile glutamatului și GABA asupra mecanismului de cuplare metabolică neuronal-astrocitară care stau la baza reglării apetitului hipotalamic au fost în mare parte neexplorate, în principal din cauza absenței abordărilor metodologice in vivo adecvate. Mai devreme, s-a demonstrat că o varietate de metode de imagistică prin rezonanță magnetică (RMN) și spectroscopie prin rezonanță magnetică (MRS) in vivo oferă informații cuprinzătoare despre activarea cerebrală și mecanismele de cuplare metabolice care operează între neuroni și astrocite. Cu toate acestea, dimensiunea relativ mare a voxelului utilizată la achiziționarea spectrelor in vivo de rezonanță magnetică de 13 C exclude utilizarea sa pentru studierea apetitului relativ redus care controlează zona hipotalamică a rozătoarelor mici. Alternativ, investigațiile de spectroscopie cu rezonanță magnetică nucleară (RMN) de 13 C de înaltă rezoluție asupra metabolismului cerebral al trasorilor, cum ar fi [1-13 C] glucoză sau [2-13 C] acetat, au contribuit la informații complete despre funcționarea ciclurilor TCA neuronale și astrocitare și schimburile transcelulare de glutamat - glutamină sau GABA între neuroni și astrocite ale întregului creier [vezi de exemplu (79–, 82)].
Cu toate acestea, cantitățile relativ mari de țesut cerebral necesare pentru pregătirea extractelor cerebrale pentru spectroscopie RMN de 13 C de înaltă rezoluție constituie o limitare importantă. Pentru a depăși limitările menționate mai sus, spectroscopia RMN de înaltă rezoluție de filare magică (HR-MAS), o tehnică care oferă spectre de înaltă calitate din biopsii tisulare foarte mici (5-10 mg, o dimensiune comparabilă cu dimensiunea hipotalamusului creierului șoarecilor ) s-a sugerat îmbunătățirea rezoluției spațiale și investigarea directă a metabolismului hipotalamic. În timp ce RMN 1 H HR-MAS a fost folosit pentru profilarea metabolică a țesuturilor normale și bolnave (83), spectroscopia RMN HR-MAS 13 C oferă avantajul suplimentar de a furniza informații despre funcționarea căilor metabolice.
Concluzii finale
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
TCD a deținut o bursă post-doctorală de la Fundația pentru Știință și Tehnologie, Portugalia (SFRH/BPD/46197/2008).
- Don; t Du-te unde; s Alunecos - Poate că ar trebui să-ți strici pofta de mâncare
- Scăderea în greutate experimentală a medicamentelor reduce apetitul, arde mai multă energie, studiul sugerează FierceBiotech
- Suprimant al apetitului chinezesc
- Patch-uri de control al apetitului Guarana (60- sau 90-Count) Groupon
- Pierdere rapidă în greutate Pastile pentru slăbit Lida 💶 Supresor puternic al apetitului și arzător de grăsimi ✅ - CREA-RS