Abstract
Atrofia masei musculare scheletice este o problemă aproape universală la supraviețuitorii bolilor critice și este asociată cu morbiditate semnificativă pe termen scurt și lung. Contrar practicii obișnuite, furnizarea de proteine / aminoacizi ca perfuzie continuă limitează semnificativ sinteza proteinelor, în timp ce hrănirea intermitentă stimulează maxim sinteza mușchilor scheletici. Mai mult, proteina pe bază de zer (bogată în leucină) crește sinteza musculară în comparație cu proteina pe bază de soia sau cazeină. În plus față de efectele sale adverse asupra sintezei mușchilor scheletici, hrănirea continuă este nefiziologică și are efecte adverse asupra metabolismului glucozei și lipidelor și a funcției gastrointestinale. Propun ca pacienții cu afecțiuni critice să fie hrăniți intermitent cu o formulă pe bază de zer și că o astfel de abordare este probabil asociată cu un control glicemic mai bun, o steatoză hepatică mai mică și o conservare mai mare a masei musculare. Această lucrare oferă baza științifică pentru abordarea mea privind hrănirea intermitentă a pacienților cu afecțiuni critice.
Revizuire
Supraviețuitorii bolilor critice suferă de pierderi musculare marcate, care pot dura ani de zile pentru a-și reveni. Pierderea masei musculare este asociată cu slăbiciune musculară, suport ventilator mecanic prelungit, oboseală și recuperare întârziată [1-3]. Această tulburare este cunoscută sub numele de miopatie pentru boală critică (CIM) sau slăbiciune dobândită în unitatea de terapie intensivă (ICUAW) [1-3]. CIM se caracterizează printr-o miopatie difuză necrotizantă însoțită de atrofie cu fibre, degenerare grasă a fibrelor musculare și fibroză [4]. Este posibil ca mai mulți factori să joace un rol în inducerea CIM, inclusiv inactivitatea musculară, inflamația, stresul energiei celulare, corticosteroizii, hiperglicemia, agenții blocanți neuromusculari și suportul nutrițional inadecvat [2, 4]. CIM este extrem de frecventă la supraviețuitorii ICU, fiind raportată în până la 46% din cazuri [5]. Herridge și colab. au urmat 109 supraviețuitori ai ARDS timp de până la 5 ani după externarea din UTI [6, 7]. Toți pacienții au raportat o stare funcțională slabă cu slăbiciune proximală și oboseală la externare. La 1 an, distanța parcursă în 6 minute a fost de 66% din estimarea, care a crescut la 76% din estimarea la 5 ani [7].
Defecțiune musculară în timpul bolii acute
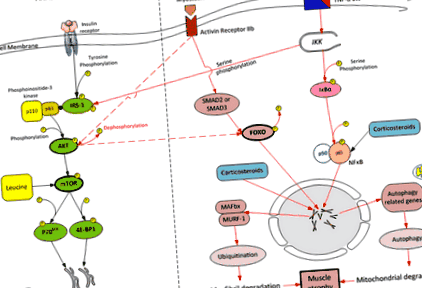
O prezentare simplificată a căilor anabolice și catabolice în mușchiul scheletic.AKT = protein kinază b; FOXO-1 = clasa O-1; IRS-1 = substrat al receptorului de insulină-1; MAFBx = atrofie musculară f-box-1; MURF-1 = proteina degetului inelar muscular 1; NF κB = factor nucelar κB; IKK = inhibitor al factorului nuclear κB kinază; IκB = inhibitor al factorului nuclear κB; 4E-BP1 = factor de inițiere eucariotă (eIF) 4E proteină de legare 1; P70 S6K = 70-kDa proteină ribozomală S6 kinază; mTOR = țintă de rapamicină la mamifere; TNF-α = factor de necroză tumorală-α
În cazul bolilor critice, pierderea masei musculare rezultă dintr-un dezechilibru între proteoliza musculară și sinteza proteinelor, proteoliza copleșind un răspuns sintetic inadecvat [13]. Proteoliza este mediată de mai multe rețele de semnalizare celulară, dar calea proteolitică predominantă activată în modelele de atrofie musculară este sistemul ubiquitin - proteazom [14-16]. Două E3-ligase musculare specifice aparținând complexului ubiquitin-proteazom, mușchiul RING-finger 1 (MuRF1) și atrofia musculară F-box (MAFbx), au fost identificate ca regulatori cheie ai defalcării proteinelor mediată de proteazom [4, 17- 19]. Forkhead box O (FOXO) este o familie de factori transcripționali care joacă un rol major în pierderea musculară, în principal prin creșterea expresiei MuRF-1 și MAFbx [20, 21]. FOXO este activat (defosforilat) prin inflamație și sepsis.
Puthucheary și colegii săi au demonstrat o reducere de 17% a secțiunii transversale rectus femoris la pacienții cu afecțiuni critice după 10 zile de ventilație mecanică [13]. Pierderea masei musculare a fost cea mai mare la cei cu eșec multisistem și a crescut odată cu creșterea duratei de ședere. În acest studiu, modelul de semnalizare intracelulară a demonstrat o descompunere musculară crescută și o sinteză scăzută. Wollersheim și colegii săi au investigat dinamica degradării miozinei la pacienții care au nevoie de ventilație mecanică timp de cel puțin 15 zile [4]. Acești autori au demonstrat o scădere a expresiei genetice a izoformelor lanțului greu cu miozină, cu o expresie semnificativ crescută a mRNA MuRF-1, MAFbx și FOXO-1. Constantin și colab. a raportat descoperiri similare; în plus, acești autori au raportat defosforilarea (inactivarea) pe scară largă a proteinelor care reglementează activarea factorului de inițiere a traducerii și sinteza proteinelor (AKt1, mTOR, 4E-BP1) și expresia crescută a miostatinei [22].
Activarea sintezei musculare și rolul leucinei
Cinetica sintezei proteinelor musculare
Răspunsul sintetic muscular și efectul „mușchiului plin” sunt influențate de exerciții fizice, vârstă, tipul de proteine ingerate și starea anabolică/catabolică a individului [8]. Scăderea sintezei proteinelor musculare postabsorptive denumită „rezistență anabolică” este frecventă la îmbătrânire și poate explica parțial sarcopenia vârstnicului [8, 52]. Dozele crescute de proteine și proteinele de înaltă calitate (zer) par să depășească rezistența anabolică legată de vârstă [53]. O doză de 20 g de proteine din zer este necesară pentru rata maximă de sinteză miofibrilară la mușchiul odihnit și exercitat al bărbaților tineri instruiți pentru rezistență [54], în timp ce 40 g sunt necesari la adulții mai în vârstă [55]. Imobilitatea [56-58], sepsisul [59-61] și inflamația [62] duc la rezistență anabolică. Vary a demonstrat că doza mare de leucină crește sinteza proteinelor musculare și depășește rezistența anabolică într-un model de sepsis murin [63].
Este important să subliniem faptul că cinetica sintezei proteinelor musculare, comparația aportului intermitent versus aportul continuu de proteine și efectul formulei proteice pe bază de zer față de cazeină asupra sintezei proteinelor nu au fost studiate la pacienții cu boli critice. Cu toate acestea, în timp ce amploarea răspunsului sintetic poate fi redusă la pacienții cu afecțiuni critice în comparație cu indivizii sănătoși, nu există niciun motiv fiziologic pentru a crede că modelul stereotip al sintezei musculare observat la indivizii sănătoși și la modelele animale nu ar trebui să se aplice în cazul criticilor bolnav bolnav. La trupele de luptă, dozarea proteinelor la minimum 20 g de proteine de înaltă calitate la fiecare 4-5 ore (în timpul orelor de veghe) a fost recomandată pentru o recuperare funcțională optimă [64]. În timp ce doza optimă de proteine și strategia de dozare la pacienții cu afecțiuni critice sunt necunoscute, sugerez că o abordare similară cu cea a trupelor de luptă poate limita pierderea musculară la acești pacienți.
Studiile clinice nu reușesc să demonstreze un rezultat îmbunătățit cu mai multe proteine (furnizate continuu)
Hrănire intermitentă vs continuă
Nici o specie nu mănâncă continuu (zi și noapte) și un astfel de design evolutiv ar părea absurd. Tractul digestiv și căile metabolice ale oamenilor par concepute pentru ingestia intermitentă de nutrienți de câteva ori pe zi. Oamenii au evoluat, deoarece consumatorii de mese intermitente nu sunt adaptați la un flux continuu de nutrienți; fiziologia normală pare să fie modificată atunci când se adoptă această abordare. Cu toate acestea, hrănirea continuă enterală a pacienților cu afecțiuni critice pare a fi standardul de îngrijire din întreaga lume [73]; o astfel de abordare este în mod clar nefiziologică și probabil să fie asociată cu complicații semnificative. Alimentarea rapidă a bolusului seringii a fost norma înainte de introducerea pompelor de perfuzie continuă. Alimentarea rapidă în bolus a fost asociată cu distensie gastrică bruscă și o incidență ridicată de greață și vărsături. Hrănirea continuă cu o pompă de perfuzie a fost asociată cu mai puțină intoleranță și a devenit în scurt timp considerată standardul de îngrijire. Cu toate acestea, atunci când „bolusul” de hrană enterală este administrat pe o perioadă mai lungă de timp (20-40 min), incidența greaței și vărsăturilor nu crește [74]; această metodă de hrănire este cel mai bine denumită hrănire intermitentă.
Consider că nutriția enterală continuă este nefiziologică, limitează conservarea masei musculare și este asociată cu efecte adverse asupra metabolismului glucozei și lipidelor și că această abordare a sprijinului nutrițional ar trebui abandonată. Studiile experimentale și clinice au arătat că „amortizarea mecanică” a mușchilor scheletici joacă un rol major în CIM [56, 90]. Pierderea masei musculare și a funcției poate fi atenuată prin încărcarea mecanică timpurie [91, 92], sprijinind terapia fizică timpurie la pacienții imobilizați [93-95]. Prin urmare, cred că sprijinul nutrițional optim oferit de hrănirea intermitentă a unei formule enterale pe bază de zer combinată cu terapia fizică timpurie poate atenua CIM.
Concluzii
În concluzie, cred că pacienții cu afecțiuni critice ar trebui hrăniți intermitent cu o formulă pe bază de zer care conține acizi grași omega-3. O astfel de abordare va limita atrofia musculară și va promova stabilitatea metabolică. Alimentarea continuă cu tuburi este nefiziologică și probabil dăunătoare și ar trebui abandonată. Sunt necesare urgent studii mari controlate randomizate pentru a demonstra beneficiile clinice ale unei strategii de hrănire intermitentă.
- Alegerea ruloului corect de acționare este esențială pentru fabricarea și prelucrarea metalelor cu alimentare fără fir
- Abordările terapiei de hrănire diferă atunci când copiii se luptă să mănânce Găsiți ajutorul potrivit pentru familia dvs.
- Ramadanul de post la pacienții cu afecțiuni renale cronice Efecte clinice și biochimice Bernieh B, Al
- Mănâncă bine vara aceasta; În bună sănătate; Ziarul Rochester Area Healthcare
- Mănâncă bine - Experții tăi în alimentație și nutriție