Abstract
La nivel mondial, obezitatea a devenit o criză majoră de sănătate publică. Excesul de greutate și obezitatea nu numai că cresc riscul bolilor cardiovasculare și al diabetului de tip 2, dar sunt și acum factori de risc cunoscuți pentru o varietate de tipuri de cancer. Dintre toate tipurile de cancer, creșterea indicelui de masă corporală este cel mai puternic asociată cu incidența și mortalitatea cancerului endometrial. Mecanismele moleculare care stau la baza modului în care țesutul adipos și obezitatea contribuie la patogeneza cancerului endometrial sunt din ce în ce mai bine înțelese și au relevat o serie de strategii raționale, atât comportamentale, cât și farmaceutice, pentru prevenirea atât a bolii primare, cât și a bolii recurente.
Riscul de obezitate și cancer endometrial: mecanisme și strategii raționale pentru prevenirea cancerului
Deși s-a presupus că excesul de estrogen datorat conversiei periferice a androstendionei în estronă reprezintă riscul crescut de cancer endometrial la femeile obeze, noile studii implică alte mecanisme prin care obezitatea promovează cancerul endometrial. Această revizuire va discuta înțelegerea actuală a factorilor care stau la baza asocierii obezității și a cancerului endometrial și ce strategii sunt disponibile atât pentru prevenire, cât și pentru tratament.
Obezitate și dezechilibru hormonal
Estrogenul promovează creșterea celulelor canceroase endometriale atât prin reglarea directă, cât și indirectă, a transcrierii genelor. Legarea de receptorii citoplasmatici de estrogen alfa și beta (ERα și ERβ) duce la recrutarea co-factorilor transcripționali și la activarea directă a unei largi varietăți de gene receptive la estrogen. Receptorii estrogeni se pot lega, de asemenea, într-o manieră dependentă de estrogen și independent de alți factori de transcripție și pot spori transcrierea genei prin elemente de răspuns alternative 15, 16 De asemenea, este evident că estrogenul însuși exercită efecte rapide, non-genomice, asociate cu o varietate de cascade de semnalizare a kinazei citoplasmatice 16, 17. Tratamentul cu 17β-estradiol (E2) activează atât căile PI3-kinazei, cât și căile MAPK, care sunt asociate cu proliferarea celulară și sunt frecvent hiperactivate în cancer. Asocierea directă între receptorii de estrogen și receptorii de suprafață celulară, inclusiv IGF-1R și EGFR, reprezintă un mecanism care leagă direct estrogenul de cascadele de kinază din aval care promovează creșterea celulară și progresia tumorii.
În endometrul premenstrual normal, progesteronul combate proliferarea condusă de estrogen și induce diferențierea glandulară și decidualizarea stromei endometriale. Condițiile care sunt însoțite de deficiențe prelungite de progesteron promovează, prin urmare, proliferarea endometrială și cresc riscul de hiperplazie endometrială și progresia acesteia către cancer endometrial 18,19. De exemplu, nuliparitatea, menstruația neregulată și terapia extinsă de substituție hormonală post-menopauză cu estrogen neopus, sunt asociate cu un risc crescut de cancer endometrial 18-20. La femeile obeze din perioada pre-menopauză, lipsa progesteronului datorată anovulației, precum cea observată în sindromul ovarian polichistic (SOP), poate contribui, de asemenea, la riscul de cancer endometrial.
SOP este o tulburare eterogenă care afectează 6-8% dintre femei, caracterizată prin exces de androgen, anomalii menstruale datorate disfuncției ovulatorii și este adesea asociată cu morfologia ovariană polichistică 21. Obezitatea se găsește la aproximativ 30 până la 70% dintre femeile cu PCOS 22. Un element de principiu al acestei tulburări este prezența rezistenței la insulină, care este agravată de obezitate. Un studiu australian recent de control al cazurilor la femei sub 50 de ani a arătat că femeile cu SOP au prezentat un risc de patru ori mai mare de cancer endometrial în comparație cu femeile fără SOP 23. Când a fost ajustat pentru IMC, SOP a rămas un factor de risc independent și a fost asociat cu un risc mai mare de două ori mai mare pentru cancerul endometrial.
Diabet de tip 2 și hiperinsulinemie
Hiperinsulinemia și starea rezistentă la insulină sunt strâns asociate cu obezitatea. Epidemiologic, o serie de studii au arătat o asociere modestă a diabetului zaharat cu riscul de cancer endometrial. 24-28 Interesant, în trei studii, cele mai semnificative riscuri au fost observate la femeile care erau atât obeze, cât și diabetice 24, 27, 29. Un studiu realizat de Troisi și colab. A examinat nivelurile de insulină la femeile cu cancer endometrial comparativ cu martorii pentru a determina dacă nivelurile crescute de insulină ar putea explica asocierea obezității și a cancerului endometrial 30. În timp ce nivelurile crescute de insulină serică, măsurate prin peptida C, au fost asociate cu un risc crescut de cancer endometrial, creșterea nivelurilor serice de insulină nu ar putea explica asocierea obezității și a cancerului endometrial.
Mai multe studii recente, inclusiv unul al grupului nostru, demonstrează o asociere a rezistenței la insulină cu riscul de cancer endometrial utilizând adiponectina ca marker surogat pentru rezistența la insulină 31-34. Această adipokină poate fi măsurată în ser sau plasmă și demonstrează niveluri care sunt invers proporționale cu rezistența la insulină. Folosind un proiect de studiu caz-control, grupul nostru a constatat că nivelurile scăzute de adiponectină au fost puternic asociate cu riscul de cancer endometrial, independent de IMC. Ulterior, un amplu studiu prospectiv, cuibărit, de caz-control, sponsorizat de Organizația Mondială a Sănătății, a efectuat un studiu privind adiponectina și riscul de cancer endometrial 34 Toate probele au fost colectate prospectiv, iar cele utilizate pentru analiză au fost dintr-un punct de timp anterior apariției cancerului endometrial. Acest studiu a confirmat că nivelurile scăzute de adiponectină au fost asociate cu riscul de cancer endometrial, din nou independent de IMC, sugerând cu tărie că rezistența la insulină este un factor de risc independent pentru cancerul endometrial.
Efectele specifice ale hiperinsulinemiei asupra patogeniei cancerelor asociate obezității nu sunt bine definite. Grupul nostru a demonstrat că efectul proliferativ al estrogenului asupra endometrului este îmbunătățit la animalele obeze față de cele slabe 35. Folosind modelul hiperinsulinemiei de șobolan Zucker, estrogenul a indus o expresie semnificativ mai mare a genelor proproliferative, ciclina A și c-myc și în endometrul șobolanilor obezi, în comparație cu cea observată la animalele slabe de control. Invers, suprimarea indusă de estrogen a inhibitorului ciclului celular, p27Kip1, și genele anti-proliferative sFRP4 și RALDH2 sunt mai pronunțate în endometrul obez. Prin urmare, obezitatea modifică echilibrul dintre semnalele pro și anti-proliferative pentru a favoriza creșterea endometrială.
Factori de creștere asemănători insulinei
Nivelurile sistemice de IGF sunt, de asemenea, modificate de obezitate. Șase IGFBP se leagă și modulează bioactivitatea IGF prin interferența cu legarea receptorilor. În timp ce producția crescută de estrogen crește direct sinteza IGF-1 36,37, hiperinsulinemia susținută are ca rezultat scăderea sintezei IGFBP1 și 2 7. IGFBP1 este cel mai puternic exprimat de endometrul uman 38, 39. Prin urmare, obezitatea contribuie la creșterea simultană a IGF circulant și la scăderea IGFBP1, rezultând crestere neta de IGF-1 biodisponibil 7, 40, 41 .
Căi de semnalizare insulină și IGF
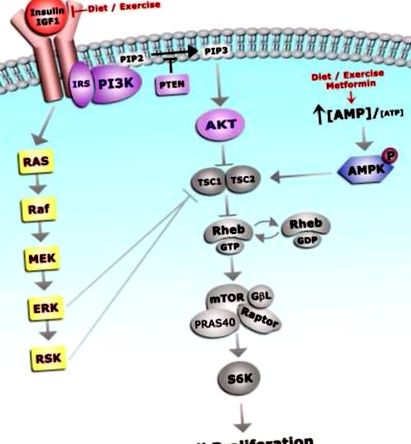
Insulina și IGF utilizează mecanisme comune de semnalizare 42. Așa cum este ilustrat în figura 3, la legarea ligandului, fosforilarea mediată de receptor a proteinei de schelă a substratului receptorului de insulină 1 (IRS-1) are ca rezultat activarea căilor de semnalizare atât ale PI3K/AKT/mTOR, cât și ale MAPK, care promovează supraviețuirea și proliferarea celulelor 42 .
Legarea IGF-1 de receptorul său conduce la autofosforilarea IGF-1R și activarea ulterioară a mai multor căi de semnalizare în aval. Proliferarea celulară este condusă prin căile PI3K și MAPK. Intervenții comportamentale și farmaceutice, care scad nivelul adipozității și IGF-1 și care activează AMPK și, prin urmare, reprezintă strategii terapeutice raționale pentru prevenirea cancerului endometrial.
Hiperactivitatea căii PI3K/AKT/mTOR este frecvent observată în cancerul endometrial. Fosfataza și omologul tensinic exprimat omniprezent (PTEN) lipidă/proteină fosfatază defosforilează substraturi PI3K și acționează ca antagonist PI3K și genă supresoare tumorale. Inactivarea sau pierderea PTEN este observată în mai mult de 40% din tipurile de cancer endometrial de tip I. Prin urmare, împreună cu IGF-1 circulant crescut, pierderea PTEN promovează hiperactivitatea căii PI3K/AKT/mTOR și facilitează creșterea cancerului endometrial la indivizii obezi. Mai mult, insulina și receptorii IGF activează simultan calea de semnalizare MAPK, un alt mecanism care promovează semnalizarea mTOR 42 .
AMPK (proteina kinază activată cu adenozin monofosfat 5 ’) inhibă semnalizarea prin calea PI3K/AKT/mTOR, servind ca un contrabalans la activitatea AKT și ERK. Inactivarea AMPK este frecvent asociată cu obezitatea (exces de energie/caloric) și rezistența la insulină. Când este fosforilat de AMPK, complexul de scleroză tuberoasă (TSC1/2) previne proliferarea endometrială mediată de mTOR. Inactivarea AMPK reprezintă, prin urmare, un mecanism suplimentar care contribuie la hiperactivitatea mTOR și a tumorigenezei în endometru.
Adipokine
Țesutul adipos este un organ endocrin complex care secretă o varietate de factori atât anti-, cât și proinflamatori, clasificați drept „adipokine”. Starea inflamației cronice sistemice asociate cu obezitatea este din ce în ce mai legată de dezvoltarea rezistenței la insulină și a hiperinsulinemiei cronice 43-43. De exemplu, secreția de adipokină, TNFα perturbă semnalizarea receptorilor de insulină prin inducerea fosforilării inhibitoare a proteinelor IRS, decuplând astfel insulina din cascadele de semnalizare din aval 44, este asociată cu includ leptina 46, interleukina-6 (IL-6) 47 și rezistina 48 .
În opoziție cu adipokinele pro-inflamatorii, nivelurile circulante de adiponectină sunt invers proporționale cu IMC și rezistența la insulină și joacă un rol în creșterea sensibilității la insulină și ca antiinflamator. Adiponectina semnalizează prin receptorii săi (AdipoR1/2) pentru a activa AMPK și a inhiba semnalizarea PI3K/AKT/mTOR 49 și, prin urmare, ar trebui să inhibe progresia tumorii condusă de calea PI3K. În sprijinul acestei ipoteze, studiile efectuate de grupul nostru și de alții confirmă faptul că nivelurile de adiponectină sunt asociate independent și invers cu riscul de cancer endometrial 31-34 .
Adipokinele și alte proteine inflamatorii asociate cu obezitatea, cum ar fi proteina C-reactivă, arată promisiune ca biomarkeri ai riscului de cancer endometrial 50-52, cu toate acestea, vor fi necesare studii suplimentare pentru a determina rolul complex al adipokinelor în dezvoltarea rezistenței la insulină și a obezității. -cancer endometrial asociat.
Intervenții raționale
Aceste mecanisme biochimice cunoscute prin care supraponderalitatea și obezitatea contribuie la riscul de cancer endometrial sugerează mai multe strategii raționale pentru prevenirea cancerului. Acestea includ intervenții comportamentale, farmaceutice și chirurgicale care previn sau inversează dezechilibrele hormonale și metabolice asociate cu obezitatea și rezistența la insulină.
Contraceptive orale
Studii epidemiologice multiple demonstrează că femeile care utilizează o combinație de contraceptive orale de estrogen și progesteron (OCP) își reduc riscul de cancer endometrial cu 50% 53, 54, 55. Deși nu există date care să susțină o eficacitate redusă în protecția cancerului endometrial la femeile obeze, există studii care sugerează că femeile obeze au o eficacitate contraceptivă ușor redusă comparativ cu femeile subțiri 56. Un studiu realizat de Maxwell și colab. A constatat că OCP cu progestine cu potență mai mare poate fi mai eficient pentru femeile cu un IMC mai mare 57. Mai multe date vor fi necesare pentru a rafina OCP optim pentru chimioprevenția cancerului endometrial la o populație obeză.
Levonorgestrelul care conține DIU (LNG-DIU) este, de asemenea, un candidat atractiv pentru prevenirea cancerului endometrial. Utilizarea DIU singur este asociată cu un risc mai mic de cancer endometrial 58, iar progestinul poate proteja în continuare endometrul. Câteva studii au raportat utilizarea DIU-GNL pentru inversarea hiperplaziei endometriale și a cancerului, dar vor fi necesare date suplimentare înainte de a putea fi recomandate pentru prevenirea cancerului.
Progestogenii sintetici sunt utilizați în mod obișnuit în contraceptivele orale și dispozitivele intrauterine și pentru tratamentul menoragiei, infertilității și a simptomelor menopauzei. Terapia cu progestin este, de asemenea, standard pentru tratamentul femeilor care au hiperplazie endometrială fără atipie, o leziune probabilă a precursorului cancerului endometrial 59. S-a investigat și răspunsul hiperplaziei complexe cu atipie și carcinom endometrial bine diferențiat la progestin. În studiile efectuate de Wheeler și colab., Remisiunea completă a fost observată la 67% dintre femeile cu hiperplazie atipică complexă, în timp ce 11% au regresat la hiperplazie complexă fără atipie și 22% au avut boală persistentă cu o urmărire mediană de 11 luni 59. La femeile cu carcinom endometrial bine diferențiat, 42% dintre femei au demonstrat o remisie completă, în timp ce 58% au avut boală persistentă pe o perioadă de urmărire de 12 luni.
Comportamental: Dieta și exerciții fizice
Masa corporală și activitatea fizică sunt factori de risc modificabili, care pot fi manipulați pentru a avea un impact favorabil asupra rezultatului pacienților cu cancer. Un studiu recent realizat pe 42.672 de femei aflate în postmenopauză înscrise în Societatea Americană a Cancerului Prevenirea Cancerului II Cohorta de nutriție a evaluat incidența cancerului endometrial în raport cu activitatea fizică și IMC 60. În perioada cuprinsă între 1992 și 2003, au fost diagnosticate un total de 466 de cazuri noi de cancer endometrial. Activitatea fizică recreativă și moderată a fost asociată cu un risc de cancer endometrial cu 33% mai mic, iar efectul a fost pronunțat în rândul femeilor supraponderale sau obeze.
Nivelurile de estrogen circulant se corelează cu creșterea IMC la femeile aflate în postmenopauză, în timp ce scăderea în greutate, fie prin modificări dietetice, fie prin exerciții fizice sau o combinație a acestora, reduce sinteza estrogenilor. Atât restricția calorică, cât și sursa de calorii par să influențeze concentrația hormonului seric. S-a demonstrat că intervențiile dietetice bogate în fibre și cu conținut scăzut de grăsimi scad concentrația biodisponibilă de estradiol la supraviețuitorii cancerului de sân, chiar și în absența pierderii în greutate concomitente 61,62, 63 .
Activitatea fizică demonstrează în mod constant un efect pronunțat asupra nivelului hormonal atât la persoanele slabe, cât și la cele obeze 64-65 și este asociată cu un risc redus de cancer de sân post-menopauză, precum și cu recurența cancerului de sân. Cu toate acestea, dieta și exercițiile fizice sunt, de asemenea, cunoscute pentru a preveni reapariția tipurilor de tumori care, de obicei, nu răspund la hormoni, inclusiv cancerul de sân cu receptor estrogen negativ, sugerând că căile suplimentare activate de activitatea fizică și dieta influențează creșterea tumorii 66, 67 .
Se știe că pierderea în greutate, fie prin modificări de comportament (dietă și exerciții fizice), fie prin intervenții chirurgicale, inversează rezistența la insulină, scade nivelurile bioactive de IGF-1 și previne apariția diabetului de tip 2. Recent, Pendyala și colab. Au realizat profiluri de expresie pe biopsiile mucoasei rectosigmoide obținute de la femeile obeze înainte și după scăderea în greutate indusă de dietă68. După o scădere în greutate de 10%, țesuturile au demonstrat scăderi semnificative într-o varietate de citokine inflamatorii, inclusiv TNFα, IL-6, IL-8 și MCP-1, precum și reglarea descendentă a markerilor căilor proinflamatorii, metabolismului prostaglandinelor și factorilor de transcripție. Acest lucru s-a reflectat prin scăderea TNFα și IL-8 circulante, precum și a glucozei serice, a colesterolului și a trigliceridelor și a numărului mai mic de celule T și macrofage din țesuturi. Luate împreună, aceste date sugerează că pierderea în greutate reduce inflamația colorectală și decuplează cancerul care promovează căile de semnalizare, reducând astfel riscul de cancer colorectal. În plus față de efectele lor asupra insulinei, IGF și semnalizarea inflamatorie, restricția calorică și exercițiul activează AMPK ca o consecință a creșterii sistemice a AMP secundar epuizării ATP. Este probabil ca pierderea în greutate să joace un rol terapeutic în prevenirea tuturor tipurilor de cancer asociate obezității.
Chirurgie metabolică/bariatrică
Scăderea modestă în greutate de 5-10% din greutatea corporală prin dietă și exerciții fizice reduce incidența diabetului de tip 2 și a altor comorbidități asociate obezității și este recomandată în prezent ca obiectiv de scădere în greutate de către Societatea Americană a Cancerului pentru supraviețuitorii cancerului supraponderali 69 . Din păcate, modificările semnificative ale stilului de viață asociate cu pierderea în greutate sunt dificil de adoptat și menținut pentru mulți indivizi obezi și morbi, iar mulți nu reușesc să mențină o greutate sănătoasă.
Aceste mecanisme de acțiune sugerează un rol promițător și nou pentru acest „medicament vechi” în chimioprevenția tumorilor primare și recurente 76, 77. Într-adevăr, acest lucru a fost demonstrat de studii epidemiologice retrospective. Li și colab. Au demonstrat că pacienții diabetici care au luat metformină au un risc semnificativ mai scăzut de cancer pancreatic comparativ cu cei care nu au avut 78. Mai mult, pacienții cu cancer mamar diabetic care primesc metformină demonstrează o incidență mai mare a răspunsului patologic complet la terapia neoadjuvantă 79. Utilizarea metforminei este, de asemenea, asociată cu o scădere a riscului de cancer de prostată 80 .
Recent, s-a demonstrat că metformina inhibă expresia aromatazei de către culturile primare de celule stromale adipoase umane 81. Dacă acest efect este valabil in vivo, ne așteptăm ca metformina să inhibe producția localizată de estrogeni în țesutul tumoral stromal și, de asemenea, să scadă nivelurile circulante de estrogen observate la indivizii obezi. S-a demonstrat, de asemenea, că metformina crește expresia receptorilor de progesteron în liniile celulare de cancer endometrial 82 și la pacienții cu cancer de sân 83. Prin urmare, este posibil ca metformina să mărească efectele anti-proliferative ale progestinelor în virtutea semnalizării PR amplificate.
În timp ce multiplele mecanisme de acțiune ale metforminei au plauzibilitate biologică pentru utilizarea sa ca agent chimiopreventiv pentru cancer în general, este o alegere ideală de medicament pentru prevenirea primară și terțiară a cancerului endometrial.
rezumat
Dovezile actuale sugerează că, vizând dezechilibrele hormonale și căile proliferative hiperactive asociate cu obezitatea, riscul de cancer endometrial pe viață poate fi redus semnificativ. În timp ce obținerea și menținerea unei greutăți corporale sănătoase prin dietă și exerciții fizice reprezintă soluția ideală pentru prevenirea cancerului endometrial, realitatea epidemiei mondiale de obezitate necesită disponibilitatea unor alternative farmaceutice și chirurgicale pentru a reduce impactul obezității asupra riscului de cancer endometrial.
- Femei; s Wellness Obezitatea crește riscul de cancer endometrial; Rețeaua de știri a Clinicii Mayo
- Efectul obezității viscerale asupra caracteristicilor clinicopatologice la pacienții cu cancer endometrial
- Multe fețe ale obezității și influența sa asupra riscului de cancer mamar
- Înțelegerea obezității adulților - la sănătate
- Înțelegerea obezității din interior spre exterior Noua metodă de laborator relevă rolurile GABA în controlul